Содержание
- 2. П Л А Н 16.1 Пептиды, образование, элект-ронное и пространственное строение пептидной связи 16.2 Установление первичной
- 3. 16.1 ПЕПТИДЫ Среди производных α-аминокислот важнейшими являются амиды, где замещенная аминогруппа представляет собой остаток 2-й аминокислоты
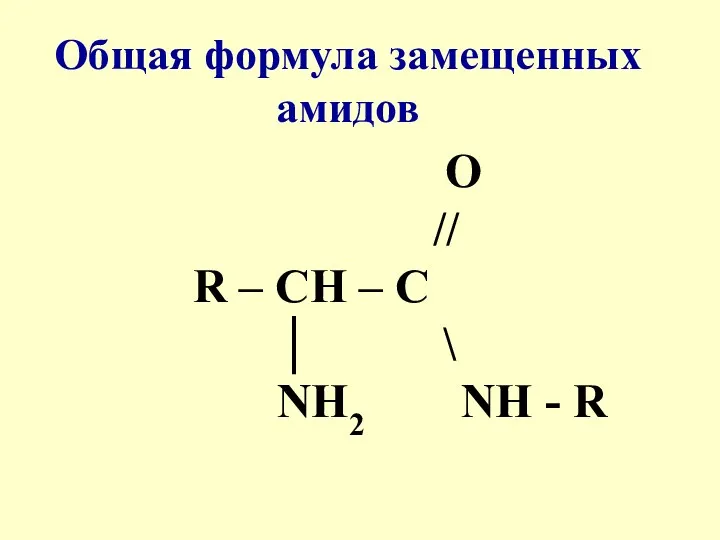
- 4. O // R – CH – C │ \ NH2 NH - R Общая формула замещенных
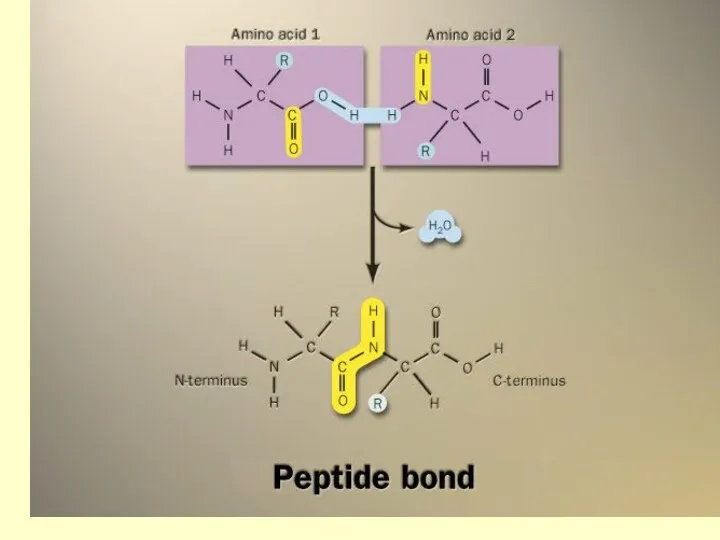
- 5. Пептиды - природные или синтетические вещества, построенные из остатков α-аминокислот, соединенных амидными (пептидными) связями
- 6. Амидная связь была названна пептидной связью Э. Фишером, он первым предположил первичную структуру для белков Э.
- 7. Функции пептидов 1. Выполняют функции биорегуляторов раз-личных биологических и физиологических процессов: регулируют тонус сосудов (вазопрессин, ангиотензин),
- 8. Пептидную природу имеют некоторые антибиотики (циклоспорин А, грамицидины), алкалоиды, токсины пчел и ос, змей, ядовитых грибов
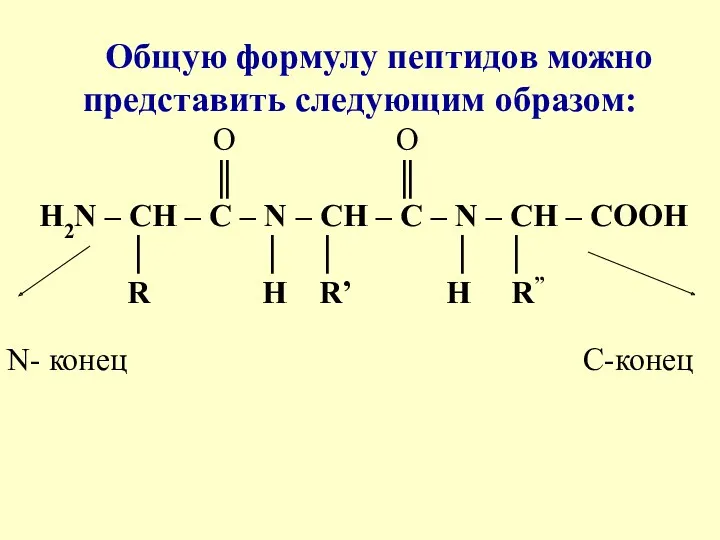
- 9. Общую формулу пептидов можно представить следующим образом: O O ║ ║ Н2N – СН – С
- 11. При построении названий пептидов в названии аминокислот окончание ин заменяется на ил, а название аминокислоты, содержащей
- 12. При построении белковых молекул с диамино- или дикарбоновыми аминокислотами в образовании пептидной связи участвуют α-NH2 или
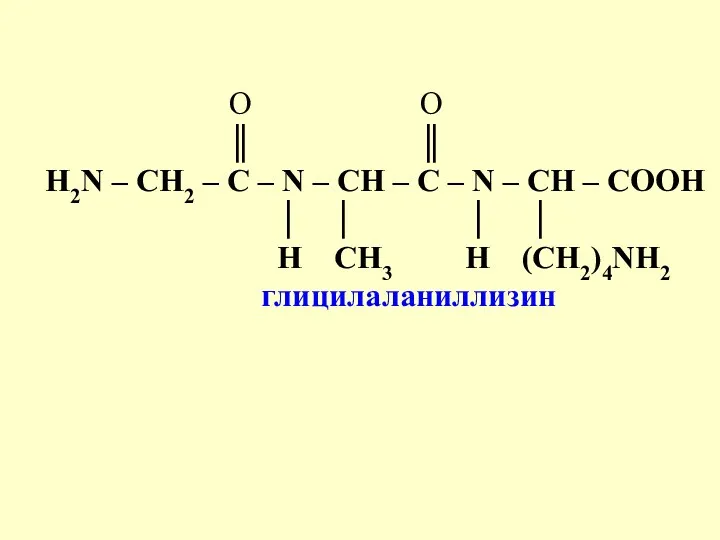
- 13. O O ║ ║ Н2N – СН2 – С – N – CH – C –
- 14. В проявлении биологических функций пептидов и белков важно их пространственное строение. Оно определяется электронным строением пептидной
- 15. p, π - сопряжение в пептидной группе приводит к частичной двоесвязанности С-N связи, что затрудняет вращение
- 16. Такая частичная двоесвязанность C-N связи означает, что пептидная группа представляет собой плоский участок пептидной цепи, рядом
- 19. Химические свойства пептидов вытекают из их амидной природы, они способны гидролизоваться в кислой и щелочной средах,
- 20. Первичная структура пептидов и белков- последовательность остатков α-аминокислот
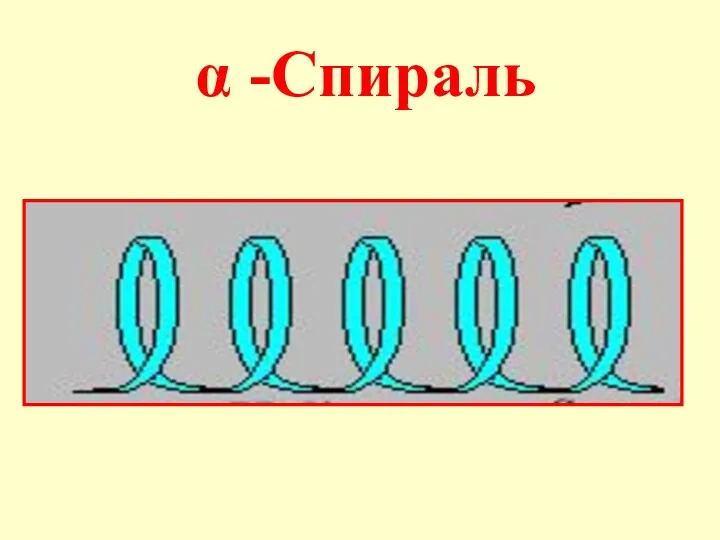
- 22. Вторичная структура пептидов - пространственное расположение цепи (конформация), фиксируемое водородными связями. Отдельные участки цепи образуют α-спираль,
- 24. В одном витке спирали умещаются 3,6 аминокислотных остатка, т.е. каждая аминокислота связывается с 5-ой по счету
- 25. В пептидах возможны другие виды взаимодействий, приводящие к стабилизации цепи в пространстве: ионные между заряженными группами
- 26. 16.2 Установление первичной структуры пептидов Первичная структура пептидов и белков определяется путем последовательного отщепления α-аминокислот с
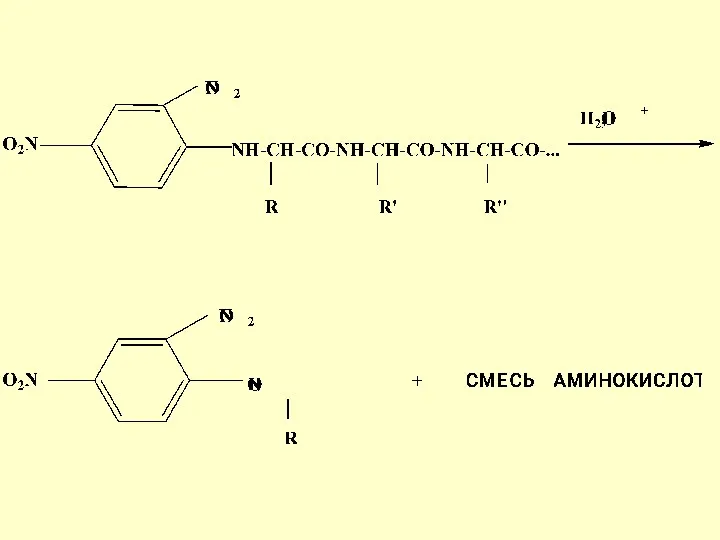
- 27. Метод Сенгера - один из первых методов с 2,4-динитрофторбензолом (ДНФБ) Ф. Сенгер
- 30. Метод Эдмана с фенилизотиоцианатом (ФТГ)
- 31. Преимуществом этого метода является то, что при отщеплении каждой N-концевой α-аминокислоты, остальная часть пептидной молекулы не
- 33. ФТГ-производное (фенилтиогидантоиновое)
- 34. Метод Эдмана лежит в основе автоматического прибора - секвенатора (sequence от английского - последовательность), аминокислотный анализатор.
- 36. 16.3 Стратегия пептидного синтеза Схематично рассмотрим синтез дипептида ГЛИ –ЛЕЙ Для осуществления синтеза пептида с заданной
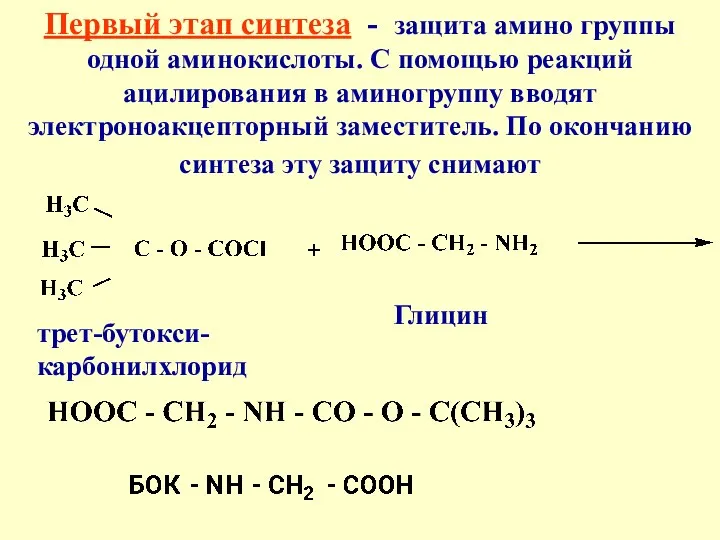
- 37. Первый этап синтеза - защита амино группы одной аминокислоты. С помощью реакций ацилирования в аминогруппу вводят
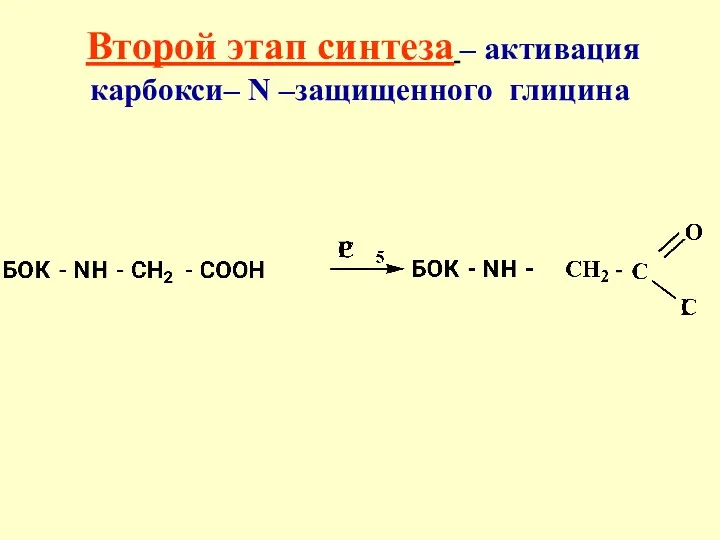
- 38. Второй этап синтеза – активация карбокси– N –защищенного глицина
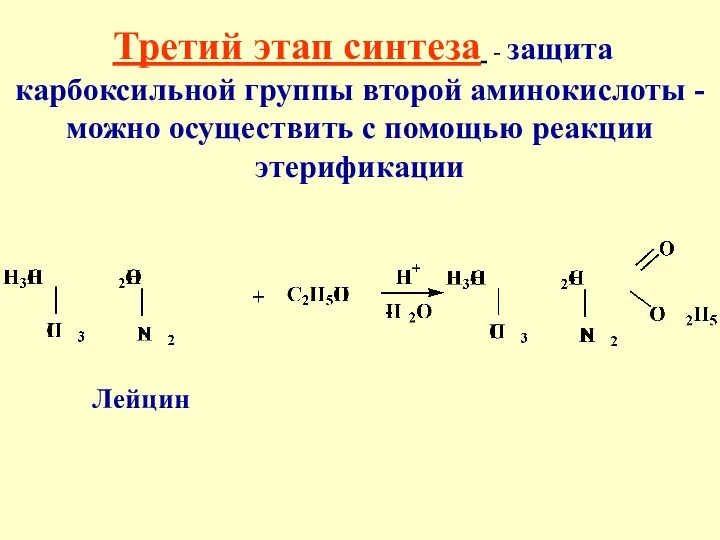
- 39. Третий этап синтеза - защита карбоксильной группы второй аминокислоты -можно осуществить с помощью реакции этерификации Лейцин
- 40. Четвертый этап синтеза – образование пептидной (амидной) связи: Защищенный дипептид ГЛИ-ЛЕЙ
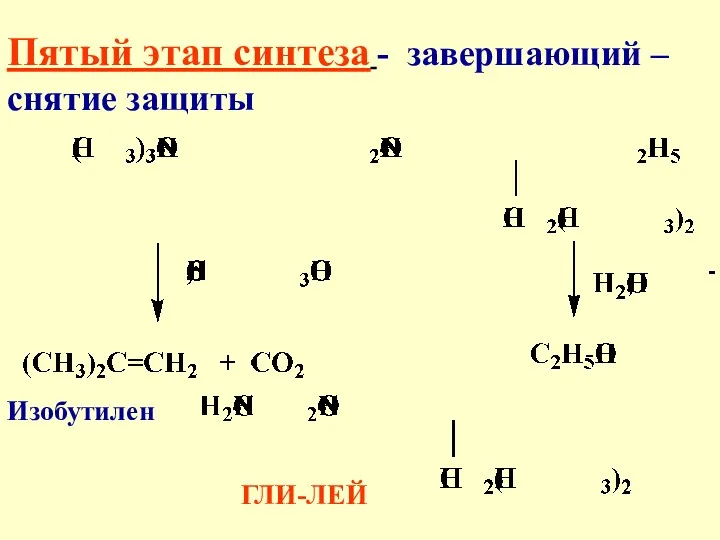
- 41. Пятый этап синтеза - завершающий – снятие защиты ГЛИ-ЛЕЙ Изобутилен
- 42. Пептиды и белки - полиэлектролиты ГЛИ - АЛА H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾ │ │ CH3 СН3
- 43. ГЛИ - ГЛУ H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾ │ │ (CH2)2 -СООН НООС–(СН2)2 ИЭТ находится в области
- 44. ГЛИ - ЛИЗ H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾ │ │ (CH2)4 –NН2 NН2 –(СН2)4 ИЭТ находится в
- 45. 16.4 БЕЛКИ Белки - высокомолекулярные азотсодержащие биологические макромолекулы, состоящие из биогенных α, L-аминокислот, связанных в линейную
- 46. Простейший белок – полипептид, содержащий в своей структуре не менее 70 аминокислотных остатков
- 47. Белки – важнейшие компоненты клетки, на их долю приходится не менее 50% сухого веса. Они осуществляют
- 48. Биологическая роль белков 1. Каталитическая функция 2. Питательная (резервная) 3. Транспортная 4. Защитная функция 5. Сократительная
- 49. Пищевую ценность белка определяют содержанием незаменимых аминокислот - не синтезируются в организме ВАЛИН, ЛЕЙЦИН, ИЗОЛЕЙЦИН, ТРЕОНИН,
- 50. Гистидин и аргинин частично заменимые аминокислоты
- 52. Первичная структура – линейная последовательность биогенных аминокислот, связанных пептидными связями. Первичная структура определяет и более высокие
- 53. Вторичная структура – локальная конформация полипептидной цепи, возникающая в результате вращения отдельных ее участков, приводящая к
- 54. α -Спираль
- 55. β – Структура (складчатого листа)
- 57. Третичная структура - конформация (расположение в пространстве) всей полипептидной цепи. В ее формировании и стабилизации принимают
- 60. Четвертичная структура белка- способ укладки в пространстве отдельных полипептидных цепей (одинаковых или разных) с третичной структурой,
- 62. Каждая отдельная полипептидная цепь в структуре мультимера называется протомером. Протомеры стерически комплементарны и связывают структуру нековалентными
- 63. Гемоглобин – белок эритроцитов, относится к группе гемопротеинов, участвует в транспорте газов в организме. В качестве
- 64. Молекула гемоглобина в отличие от миоглобина обнаруживает ряд существенных особенностей: 1 Кислород связывается молекулой гемоглобина кооперативно,
- 65. Физико-химические свойства белков Белки образуют коллоидные растворы, рассеивают проходящий свет, обладают гидрофильными свойствами, способны связывать воду,
- 66. Денатурация – процесс разрушения природной макроструктуры белков под влиянием ряда факторов: химических веществ (фенол, мочевина), повышенной
- 67. Цветные реакции белков обусловлены наличием в растворе белка аминокислоты отдельных групп или определенных связей БИУРЕТОВАЯ РЕАКЦИЯ
- 68. НИНГИДРИНОВАЯ РЕАКЦИЯ - появление фиолетового окрашивания при взаимодействии с нингидрином - обусловлена наличием свободных аминогрупп в
- 69. КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ - появление желто-коричневого окрашивания при действии концентрированной азотной кислотой - обусловлена наличием в белках
- 70. РЕАКЦИЯ МИЛОНА - - при действии на белок смеси азотно- и азотистокислых солей ртути, белок вначале
- 71. РЕАКЦИЯ АДАМКЕВИЧА - при действии на белок концентрированной уксусной кислоты с примесью глиоксиловой кислоты на границе
- 72. РЕАКЦИЯ ФОЛЯ - нагревание белка со щелочью и солью свинца приводит к выпадению черного осадка -
- 74. Скачать презентацию




























































 Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Приспособленность организмов к среде обитания
Приспособленность организмов к среде обитания Пищеварительная система
Пищеварительная система Мышцы плечевого пояса
Мышцы плечевого пояса Семейство ирисовые
Семейство ирисовые Урок – практикум. Генеалогический метод исследования живых организмов. Составление родословной А. С. Пушкина
Урок – практикум. Генеалогический метод исследования живых организмов. Составление родословной А. С. Пушкина Царство Животные
Царство Животные Аналогичные и гомологичные органы
Аналогичные и гомологичные органы Презентация. Знакомство с ротовой полостью.
Презентация. Знакомство с ротовой полостью. Разделение белков и пептидов
Разделение белков и пептидов Методы диагностики, морфология, микроскопия, методы окраски бактерий
Методы диагностики, морфология, микроскопия, методы окраски бактерий Презентация о профессии Цветовод-декоратор
Презентация о профессии Цветовод-декоратор Плесневые грибы и дрожжи. Грибы-паразиты
Плесневые грибы и дрожжи. Грибы-паразиты Переменно влажные леса. Животные и растения
Переменно влажные леса. Животные и растения Половые железы. Функции
Половые железы. Функции Презентация по теме Класс Головоногие моллюски.7 класс
Презентация по теме Класс Головоногие моллюски.7 класс Образование и эволюция биологических мембран. Первые гетеротрофы
Образование и эволюция биологических мембран. Первые гетеротрофы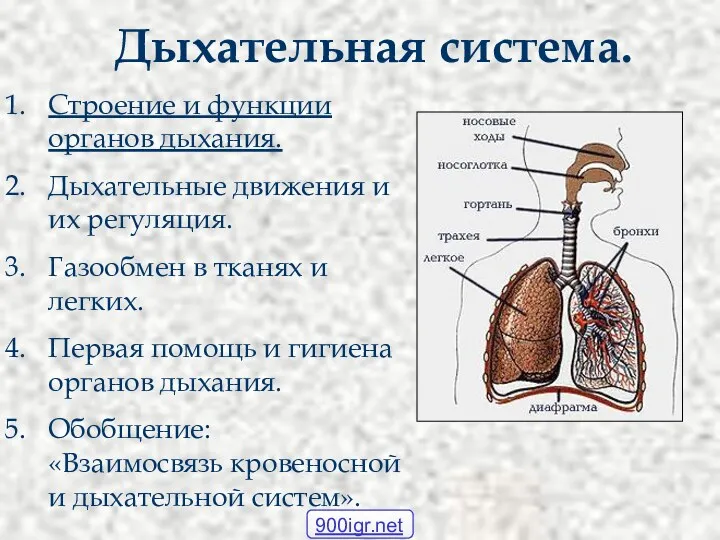 Дыхательная система
Дыхательная система Макроэлементы и микроэлементы почв
Макроэлементы и микроэлементы почв Ендокринна регуляція функцій організму людини
Ендокринна регуляція функцій організму людини Хвостатая семейка. Интересные факты и истории из жизни
Хвостатая семейка. Интересные факты и истории из жизни Краткий систематический обзор прокариот
Краткий систематический обзор прокариот Межполушарная функциональная асимметрия
Межполушарная функциональная асимметрия Отдел мохообразные. Общая характеристика
Отдел мохообразные. Общая характеристика Общее знакомство с растениями
Общее знакомство с растениями Скелет человека. Осевой скелет. Скелет поясов и свободных конечностей. Соединение костей.
Скелет человека. Осевой скелет. Скелет поясов и свободных конечностей. Соединение костей. Питание и пищеварение: простейших и беспозвоночных животных
Питание и пищеварение: простейших и беспозвоночных животных Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины