Переваривание белков. Общие пути обмена аминокислот. Источники и пути обезвреживания аммиака. Лекция №10 презентация
Содержание
- 2. Значение знаний путей обмена аминокислот Из аминокислот построены белки; Из аминокислот синтезируются многие биологически активные соединения
- 3. Белки пищи – 100г/сутки Фонд свободных аминокислот 35 г Белки тканей Синтез заменимых аминокислот Полиамины Гормоны
- 4. Полноценный белок Полноценный белок: 1. набор незаменимых аминокислот; 2. соотношение аминокислот должно быть близким к их
- 5. В организме человека содержится примерно 15 кг белков. Количество свободных аминокислот составляет около 35 г. Ежесуточно
- 6. 1.Заменимые – Ала, Асп, Асн, Глу, Глн, Про, Гли, Сер – синтезируются в необходимых количествах в
- 7. Классификация аминокислот по судьба безазотистого остатка аминокислот Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК
- 8. Большая часть свободных аминокислот используется для синтеза собственных белков организма. Кроме того, из аминокислот синтезируется большое
- 9. Полноценность белкового питания зависит от аминокислотного состава белков и определяется наличием незаменимых аминокислот. Отсутствие в пищевых
- 10. Показателем состояния белкового и аминокислотного обмена является азотистый баланс Азотистый баланс – разница между количеством азота,
- 11. Положительный (количество выделяемого азота меньше поступающего) – у детей, выздоравливающих больных после тяжелой болезни, лактация, при
- 13. Пепсиноген Пептид ПЕПСИН Олигопептиды Желудок рН 1,5 – 2,0 HCI (медленно) Пепсин (быстро) Белок H2N СH
- 14. Переваривание белков (тонкий кишечник) Трипсиноген Пептид ТРИПСИН Энтеропептидаза (медленно) Трипсин (быстро) Пептид Пептид Пептид ХИМОТРИПСИН КАРБОКСИПЕП-
- 15. Переваривание белков в кишечнике Белок Аминокислоты Дипептиды Трипептиды Аминокислоты Всасывание Аминопептидаза Дипептидаза Трипептидаза Тонкая кишка рН
- 16. ГНИЕНИЕ БЕЛКОВ В КИШЕЧНИКЕ При гниении образуются продукты разложения аминокислот, представляющие собой: токсины (кадаверин, путресцин, крезол,
- 22. Мембранный транспорт аминокислот Осуществляется 5 транспортными системами (белки-переносчики) с затратой энергии: Аминокислоты с нейтральными радикалами. С
- 23. Пути обмена АМК общие индивидуальные трансаминирование декарбоксилирование дезаминирование
- 24. Трансаминирование - реакция переноса аминогруппы с аминокислоты (донора) на α-кетокислоту (акцептор), в результате чего образуются новая
- 25. Применение в медицине В клинике широко используется определение активности некоторых аминотрансфераз в сыворотке крови, особенно часто
- 26. Применение в медицине Для определения степени поражения печени и сердца определяют соотношение активностей АСТ-АЛТ в сыворотке
- 27. Реакции трансаминирования выполняют важные физиологические функции: из α-кетокислот синтезируются аминокислоты, необходимые для жизнедеятельности клеток; происходит перераспределение
- 28. Реакции дезаминирования Катаболизм аминокислот начинается с реакции дезаминирования - удаления α-аминогруппы, которая выделяется в виде аммиака
- 29. 1. Прямое: 1.1. Окислительное (ГЛУ); 1.2. Неокислительное (СЕР, ТРЕ, ГИС, ЦИС); 2. Непрямое (все остальные аминокислоты
- 30. НАD+ НАDH+Н+ + NH3 COOH (CH2) 2 C=NH COOH 1.1 Прямое окислительное дезаминирование H2О H2О Глутамат
- 31. H2O CH2 C-NH2 COOH CH3 C=NH COOH + NH3 Серин ПФ H2O Пируват Треонин CH3 CH-NH2
- 32. N NH -CH2-CH-COOH NH2 NH3 N NH -CH=CH-COOH гистидаза 1.2. Прямое неокислительное дезаминирование Гистидин Уроканиновая кислота
- 33. H2O L - Цистеин Пируват 1.2. Прямое неокислительное дезаминирование H2S NH3
- 34. 2.1. Непрямое окислительное дезаминирование Аминокислота глутаматдегидрогеназа НАD+ НАDH+Н+ 1 2 NH3 аминотрансфераза Цитозоль Митохондрия α -
- 35. 2.1. Непрямое окислительное дезаминирование (трансдезаминирования ) На первом этапе различные L-аминокислоты вступают в реакцию трансаминирования с
- 36. 2.2. Непрямое неокислительное дезаминирование (для мышечной ткани и мозга) Асп α-кетокислота Аминокислота α-КГ Глу Оксалоацетат Малат
- 37. Декарбоксилирование – отщепление α-карбоксильной группы, с образованием СО2 и биогенных аминов. R COOH H C NH2
- 38. Биологическая роль и предшественники некоторых биогенных аминов НO НO (СН2)2 NН2 СН2 СН2 СН2 СOOН NН2
- 39. N NH СООH СH СH2 NH2 СО2 NH2 СH2 СH2 Гистидин Гистамин N NH Глутамат ГАМК
- 40. Источники и пути обезвреживания аммиака в различных тканях
- 41. Источники аммиака и пути его превращения в разных тканях Из организма аммиак выводится почками в виде
- 42. Восстановительное аминирование α-кетоглутарата (происходит в основном в мозге) Эта реакция идет с незначительной скоростью, фермент используется
- 43. CO – NH2 (CH2)2 CH – NH2 COOH Глутамат АТФ АДФ Глутамин- синтетаза Глутамин Происходит во
- 44. Образование аммонийных солей Глутамин Глутаминаза Глутамат NH3 H+ NH4 A Аммонийные соли Экскреция Почки H2О Глутамат
- 45. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина.
- 46. Мышцы (другие ткани) Кровь Печень Глюкоза Глюкоза Глюкоза 2 АТФ Пируват глу α-КГ ала Ами-нокис-лоты ала
- 47. ОРНИТИНОВЫЙ ЦИКЛ И ЕГО БИОЛОГИЧЕСКАЯ РОЛЬ Мочевина - конечный продукт азотистого обмена, в составе которого из
- 48. Орнитиновый цикл Кребса-Гензелейта – биосинтез мочевины
- 49. Экскреция конечных продуктов азотистого обмена почками при нормальном белковом питании
- 50. Заболевания печени (гепатит, цирроз) или наследственный дефект ферментов обезвреживания аммиака могут вызвать повышение содержания аммиака в
- 51. Наследственные нарушения орнитинового цикла и основные их проявления
- 52. При увеличении концентрации аммиака в 8 – 10 раз (до 0,6 ммоль/л) проявляется его токсическое действие.
- 53. Образование большого количества NH4+ может привести к сдвигу рН крови в щелочную сторону (алкалозу). Алкалоз отрицательно
- 54. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов — он
- 55. Высокое содержание NH3 в тканях снижает количество α-кетоглутарата, так как он связывает избыток аммиака и превращается
- 57. Скачать презентацию
 Биоинформатические подходы к анализу РНК. Экспрессия генов: анализ микроэррейных данных. Лекция 8
Биоинформатические подходы к анализу РНК. Экспрессия генов: анализ микроэррейных данных. Лекция 8 Рыбы, земноводные и рептилии Кемеровской области
Рыбы, земноводные и рептилии Кемеровской области Мегаспорогенез және микроспорогенез
Мегаспорогенез және микроспорогенез Тварини минулого
Тварини минулого Тип Кишечнополостные
Тип Кишечнополостные Презентация к обобщающему уроку биологии по теме Развитие органического мира
Презентация к обобщающему уроку биологии по теме Развитие органического мира Мы - друзья пернатых
Мы - друзья пернатых Органеллы. Строение клеток эукариот
Органеллы. Строение клеток эукариот Дистанционный курс по биологии. Тема Обмен веществ
Дистанционный курс по биологии. Тема Обмен веществ семейство крестоцветные
семейство крестоцветные Моё увлечение - конный спорт
Моё увлечение - конный спорт Значение опорно-двигательной системы. Состав и строение костей
Значение опорно-двигательной системы. Состав и строение костей Интерактивная викторина Чудо-птицы
Интерактивная викторина Чудо-птицы Домашние питомцы
Домашние питомцы Питание и пищеварение
Питание и пищеварение Исследовательский проект Пластиковая болезнь цивилизации
Исследовательский проект Пластиковая болезнь цивилизации Строение цветка. Опыление цветковых растений
Строение цветка. Опыление цветковых растений Семейство бобовые (Fabaceae)
Семейство бобовые (Fabaceae) Календула в назначениях современного доктора. Аптека в огороде
Календула в назначениях современного доктора. Аптека в огороде Домашние животные и их детёныши. Развивающие упражнения
Домашние животные и их детёныши. Развивающие упражнения Нуклеиновые кислоты
Нуклеиновые кислоты Биотические факторы в биоценозе
Биотические факторы в биоценозе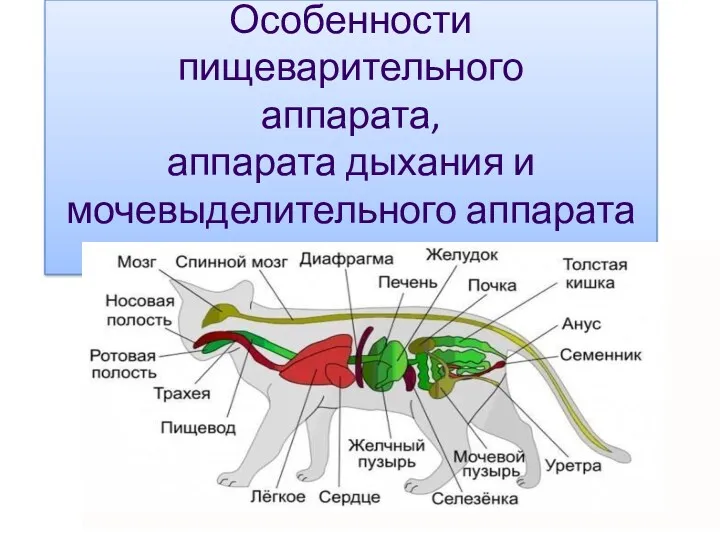 Аппарат пищеварения
Аппарат пищеварения Питание паразитов
Питание паразитов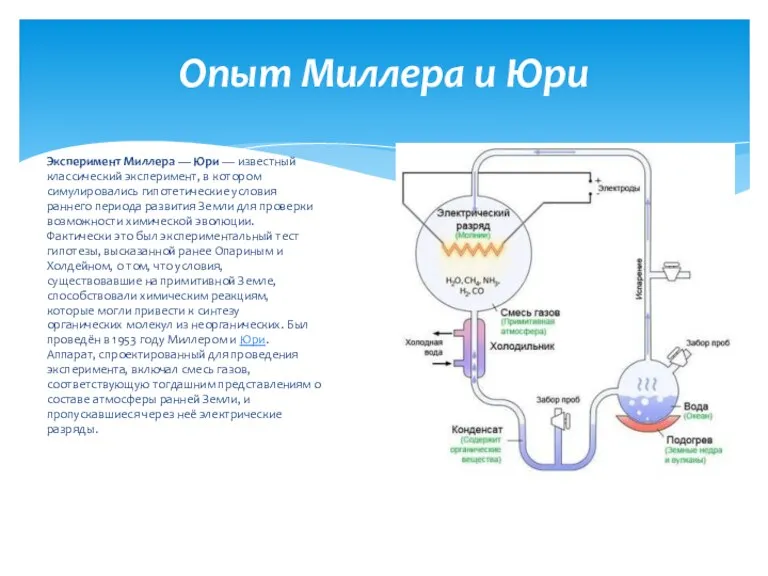 Опыт Миллера и Юри
Опыт Миллера и Юри Биосинтез белка
Биосинтез белка Неклеточные формы жизни
Неклеточные формы жизни Структурно-функциональные уровни жизни. Эволюция жизни
Структурно-функциональные уровни жизни. Эволюция жизни