Содержание
- 2. Гедройц Константин Каэтанович (1872-1932) Выдающийся ученый, академик. Он показал значение коллоидов и обменных катионов в развитии
- 3. Гедройц Константин Каэтанович (1872-1932)
- 4. Виды поглотительной способности в почве Механическая Физическая Физико-химическая Химическая Биологическая
- 5. Механическая поглотительная способность – свойство почвы задерживать в своих порах частицы, взмученные в фильтрующейся через почву
- 6. Физическая поглотительная способность – свойство почвы поглощать из раствора молекулы растворенных в почве электролитов, продукты расщепления
- 7. Химическая поглотительная способность – свойство почвы присоединять к своей твердой части вещества, полученные в результате химических
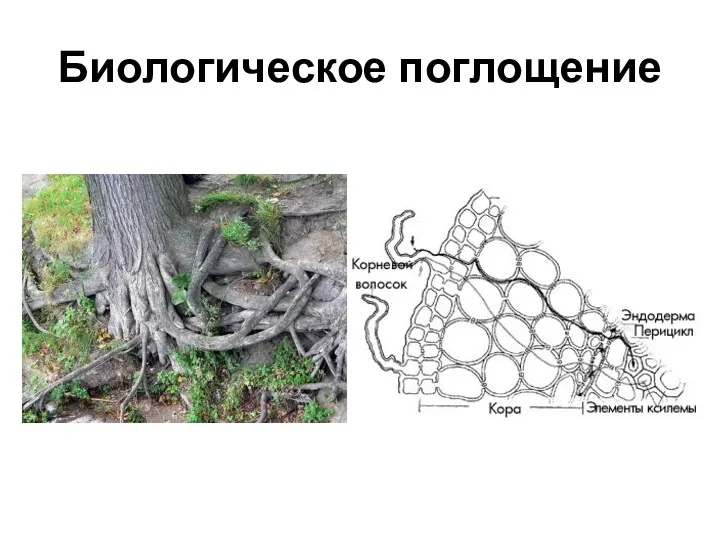
- 8. Биологическая поглотительная способность почвы обусловлена наличием в ней микроорганизмов, корней растений, поглощающих элементы из раствора. Отличительная
- 9. Биологическое поглощение
- 10. Физико-химическая поглотительная способность – свойство почвы обменивать некоторую часть содержащихся в ее твердой фазе катионов на
- 11. Ил – частицы меньше 0,001 мм Почвенные коллоиды – частицы меньше 0,0001 мм.
- 13. Почвенные коллоиды – это совокупность элементарных почвенных частиц (минеральных, органо-минеральных и органических) имеющих определенные размеры и
- 14. Способы образования коллоидов 1. Конденсационное образование – путем физического или химического соединения молекул или ионов 2.
- 15. Состав коллоидов Органические – клеточные оболочки, корневые окончания живых корешков растений, клетки микроорганизмов, ферменты, гумус Органо-минеральные
- 17. Форма существования коллоидов в почве Грубодисперсные суспензии – появляются в почвах периодически: после дождей, во время
- 18. Свойства почвенных коллоидов Специфические свойства почвенных коллоидов в значительной степени передаются почвенной массе, формируя ее облик.
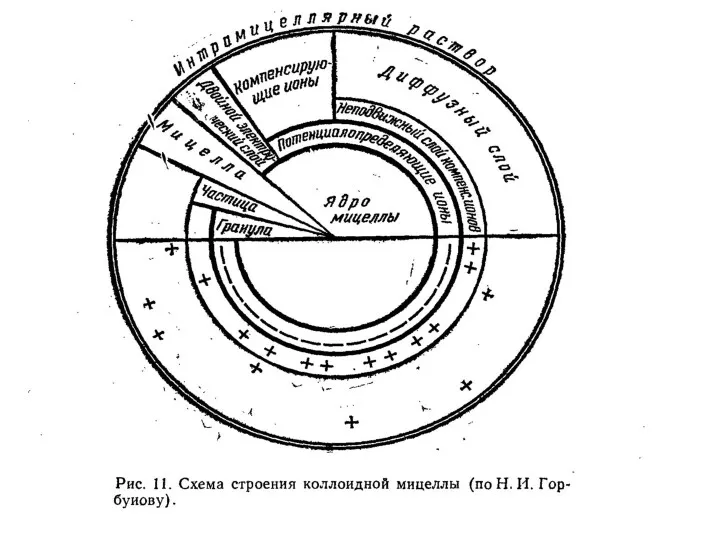
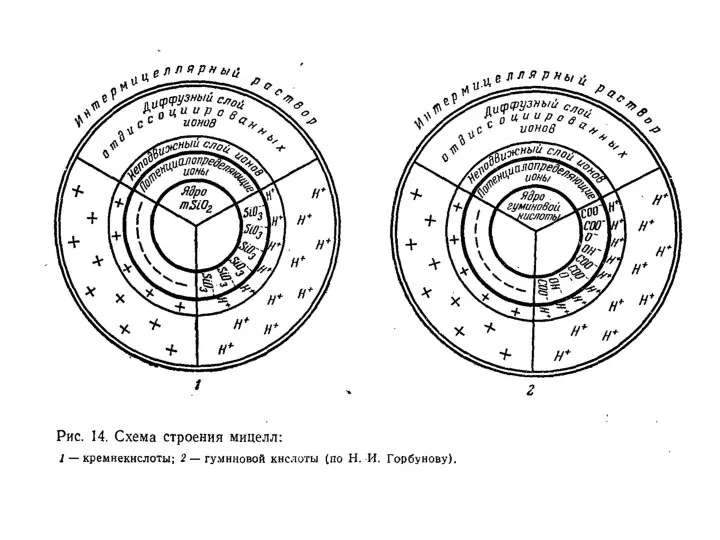
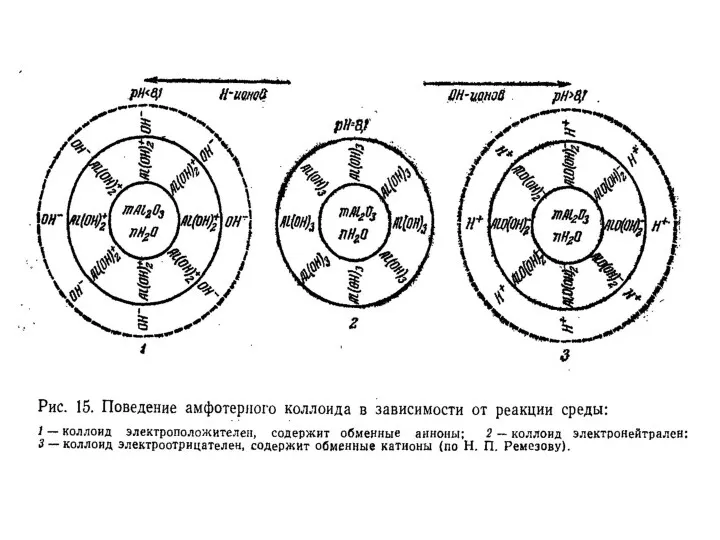
- 19. Классификация коллоидных частиц По знаку заряда потенциалопределяющего слоя : Ацидоиды – отрицательно заряженные (глины, гумус, кремнезем)
- 21. Коллоиды с двойственной природой называются амфолитоидами. В условиях кислой реакции в растворе находится много ионов водорода
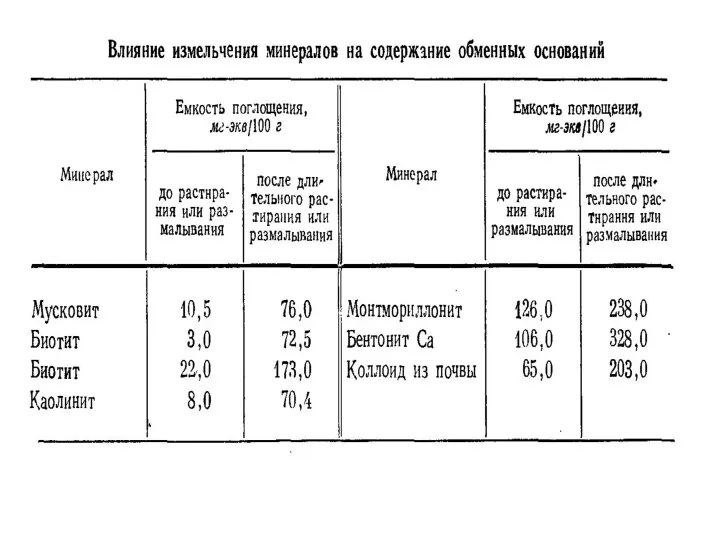
- 23. Коагуляция коллоидов Почвенные коллоиды могут изменять степень дисперсности в результате склеивания и агрегирования коллоидных частиц с
- 24. Тиксотропия коллоидов – особый вид коагуляции Явление, при котором масса геля не отделяется от дисперсной среды,
- 25. Проявление тиксотропии в выкопанном разрезе.
- 26. Пептизация коллоидов Почвенные коллоиды в определенных условиях могут увеличивать степень дисперсности частиц, и из состояния геля
- 27. Результат пептизации и коагуляции почвенных коллоидов Формирование солонцового профиля Поверхность такыра
- 28. Основные закономерности обменной сорбции катионов
- 30. Основываясь на общих законах ионообменной сорбции, М.Б. Минкин выделяет пять последовательных стадий осуществления реакции обмена катионов
- 31. Обменными катионами называются входящие в состав ППК катионы, которые при взаимодействии с растворами нейтральных солей могут
- 32. Обменные основания – обменные катионы Са2+, Mg2+, K+, Na+. Почвы, содержащие в ППК только обменные основания,
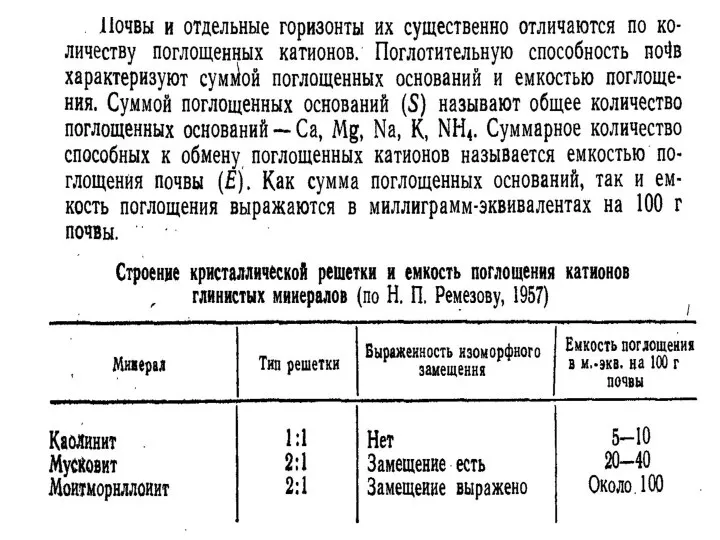
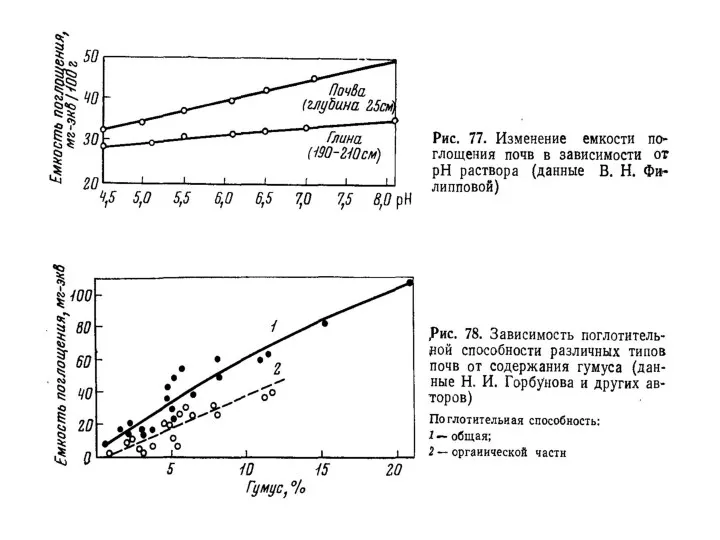
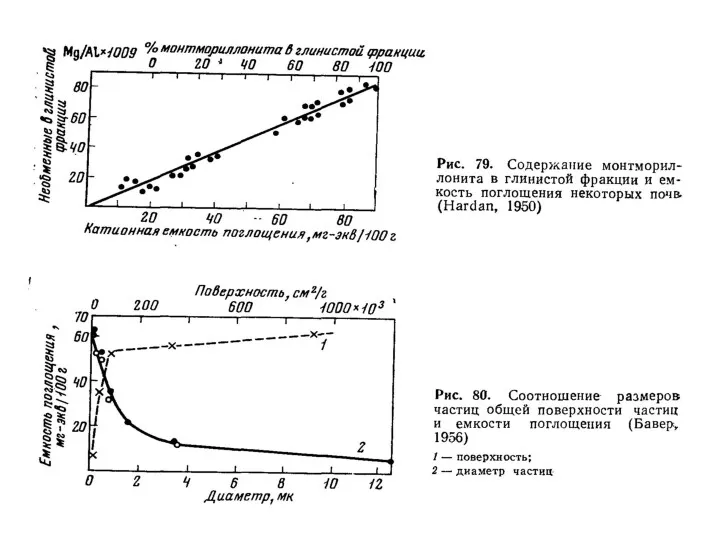
- 34. Величину емкости катионного обмена (ЕКО) выражают в миллиграмм-эквивалентах на 100 г почвы (мг-экв./ на 100 г
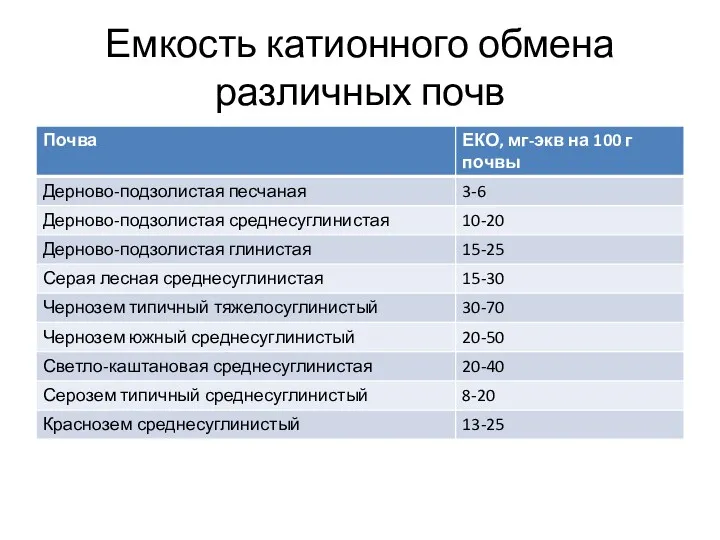
- 38. Емкость катионного обмена различных почв
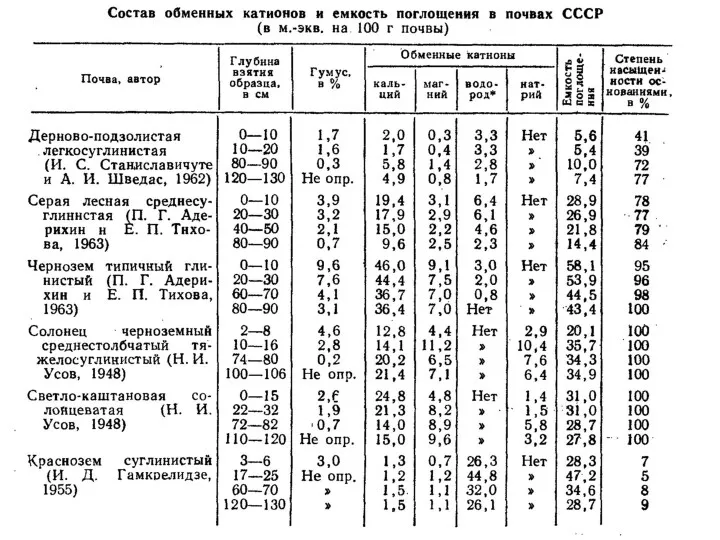
- 40. Состав обменных катионов в различных почвах
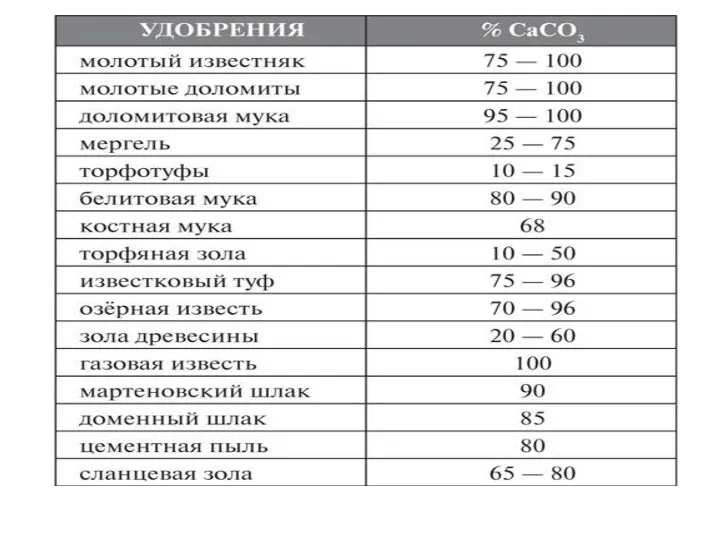
- 42. Расчет дозы извести рассчитывается по следующей формуле: PCaCO3 т/га = Hz *5 *h *d, где P
- 43. Если степень насыщенности: 50-70%, то почва средне нуждается в известковании; 70-80%, то почва слабо нуждается в
- 45. Гипсование почв Для мелиорации щелочных солонцовых и засоленных почв используют прием – гипсование почв Солонцы: ППК)2Na
- 48. Расчет дозы гипса, необходимой для мелиорации солонцов, проводится по следующей формуле: Р т/га = 0,086*(Na –
- 49. Необменное поглощение катионов Необменное поглощение катионов – фиксация - обусловлена неосинтезом глинных минералов за счет вхождения
- 50. Почему в почве ацидоидов больше? За счет разорванных связей на сколах минералов За счет изоморфных замещений
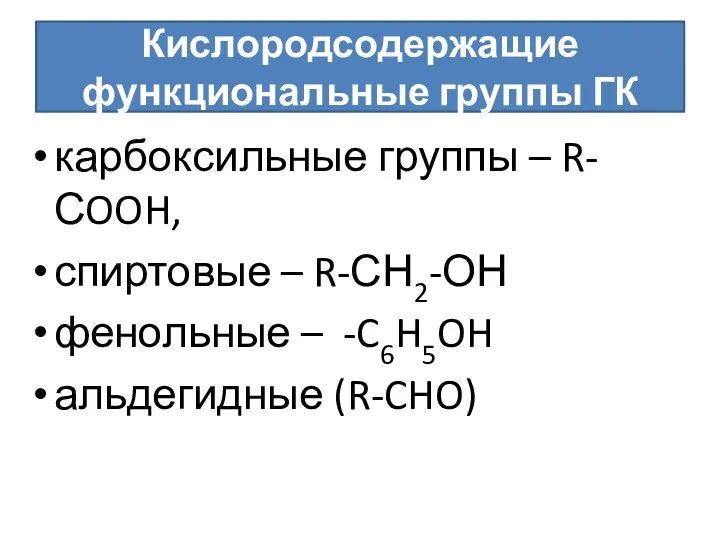
- 51. Кислородсодержащие функциональные группы ГК карбоксильные группы – R-СOOH, спиртовые – R-СН2-ОН фенольные – -C6H5OH альдегидные (R-CHO)
- 52. Поглощение анионов Поглощение анионов обусловлено: 1. наличием положительного заряда коллоидных частиц гидрооксидов алюминия и железа, 2.
- 53. Адсорбция анионов в почве зависит: От особенностей самих анионов. Ряд по возрастающей способности анионов к поглощению:
- 55. Скачать презентацию







































 Размножение организмов
Размножение организмов Царство Бактерии
Царство Бактерии Цветок – орган генеративного размножения
Цветок – орган генеративного размножения Опорно-двигательная система человека. Тема 20
Опорно-двигательная система человека. Тема 20 Розовый слон
Розовый слон Вид, его критерии и структура
Вид, его критерии и структура Сердечно-сосудистая и лимфотическая системы
Сердечно-сосудистая и лимфотическая системы Скелет туловища. Позвоночный столб. Лекция № 9
Скелет туловища. Позвоночный столб. Лекция № 9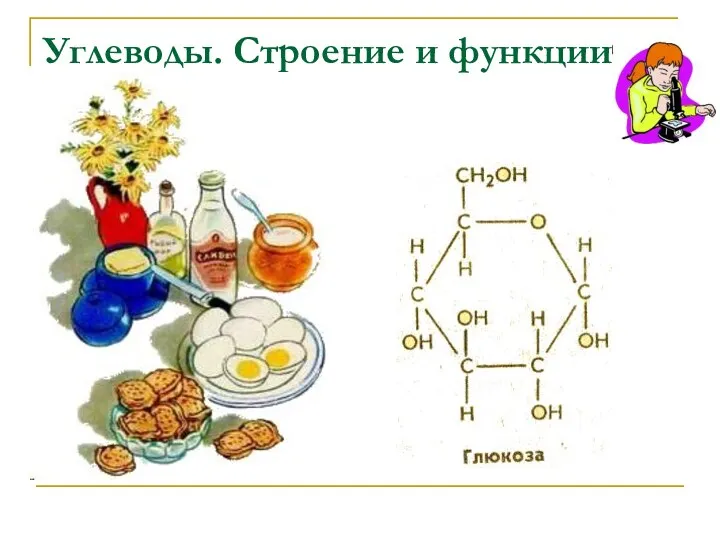 Углеводы: строение и функции.
Углеводы: строение и функции. Разнообразие живой природы. Царства живых организмов. Отличительные признаки живого и неживого
Разнообразие живой природы. Царства живых организмов. Отличительные признаки живого и неживого Основные этапы эволюции человека
Основные этапы эволюции человека Цветы нашей Родины
Цветы нашей Родины Проведение ботанических наблюдений за растениями учебно-опытного участка
Проведение ботанических наблюдений за растениями учебно-опытного участка Генетика человека и медицинская генетика
Генетика человека и медицинская генетика Отдел Rhodophyta. Красные водоросли
Отдел Rhodophyta. Красные водоросли Как растет вермишелька
Как растет вермишелька Солёность среды как экологический фактор
Солёность среды как экологический фактор Практична робота. Умови розвитку квасолі
Практична робота. Умови розвитку квасолі Общая биология
Общая биология Физиология центральной нервной системы (ЦНС). Торможение
Физиология центральной нервной системы (ЦНС). Торможение Презентация к уроку 10 класс. Онтогенез. Постэмбриональное развитие
Презентация к уроку 10 класс. Онтогенез. Постэмбриональное развитие Мышцы грудной конечности
Мышцы грудной конечности Микроорганизмы-азотфиксаторы
Микроорганизмы-азотфиксаторы Исчезающие виды животных
Исчезающие виды животных Экология вашего дома. Влияние комнатных и растущих рядом растений на организм
Экология вашего дома. Влияние комнатных и растущих рядом растений на организм Как разные животные готовятся к зиме
Как разные животные готовятся к зиме Роль жирів в організмі людини
Роль жирів в організмі людини Червона книга України
Червона книга України