Содержание
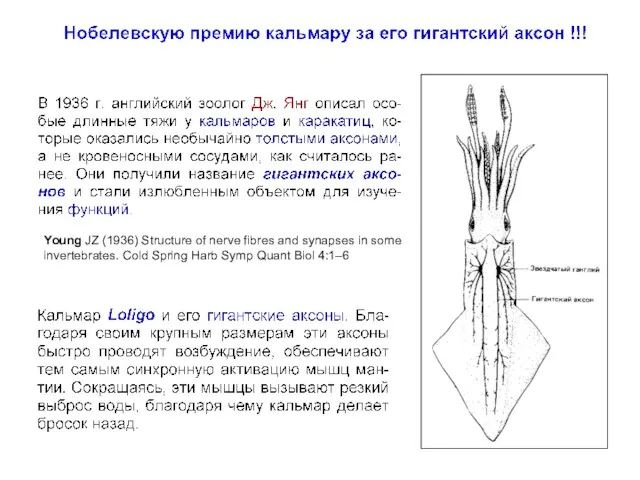
- 2. Young JZ (1936) Structure of nerve fibres and synapses in some invertebrates. Cold Spring Harb Symp
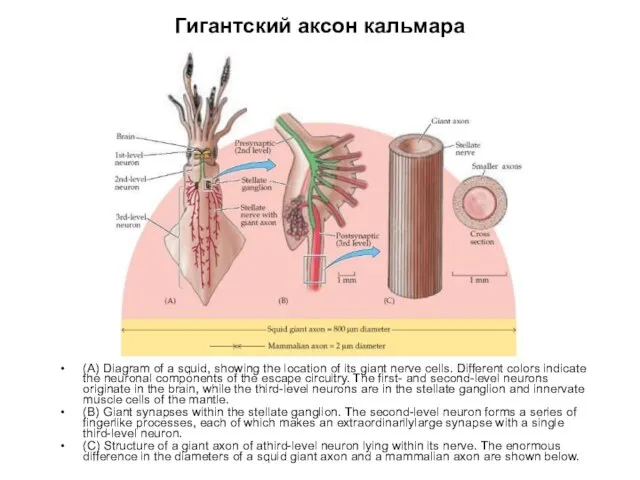
- 3. Гигантский аксон кальмара (A) Diagram of a squid, showing the location of its giant nerve cells.
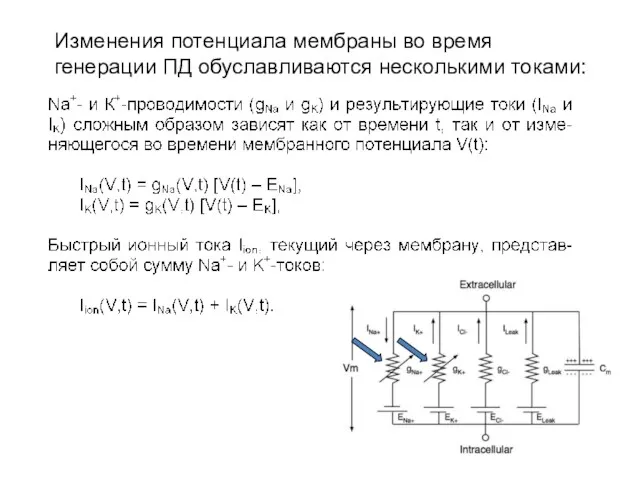
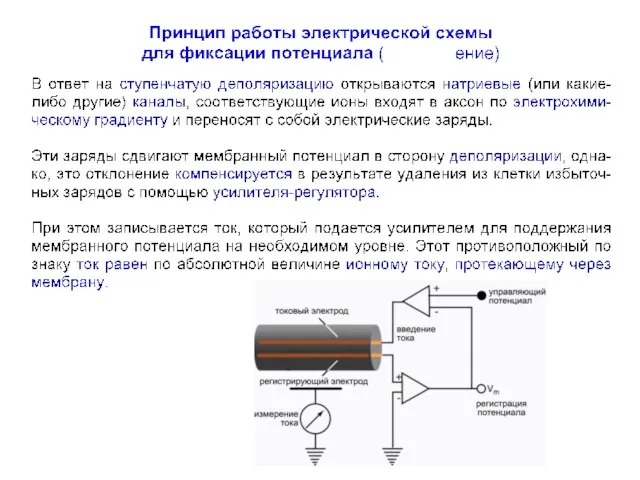
- 9. Изменения потенциала мембраны во время генерации ПД обуславливаются несколькими токами:
- 10. Изменения потенциала мембраны во время генерации ПД обуславливаются несколькими токами:
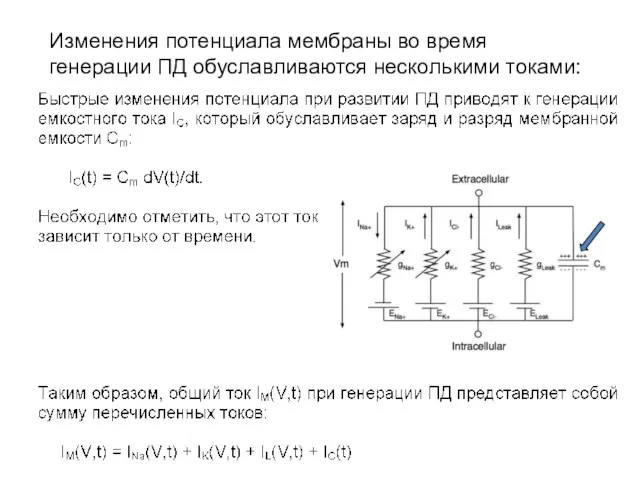
- 11. Изменения потенциала мембраны во время генерации ПД обуславливаются несколькими токами:
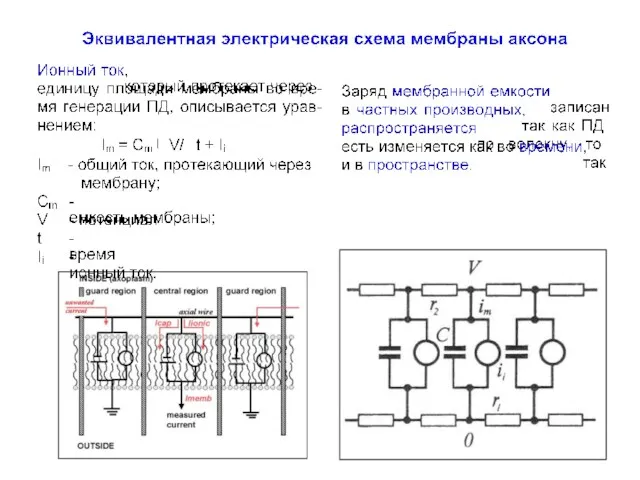
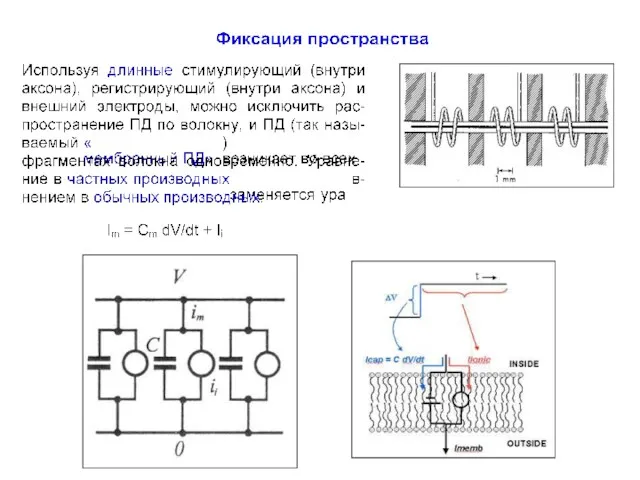
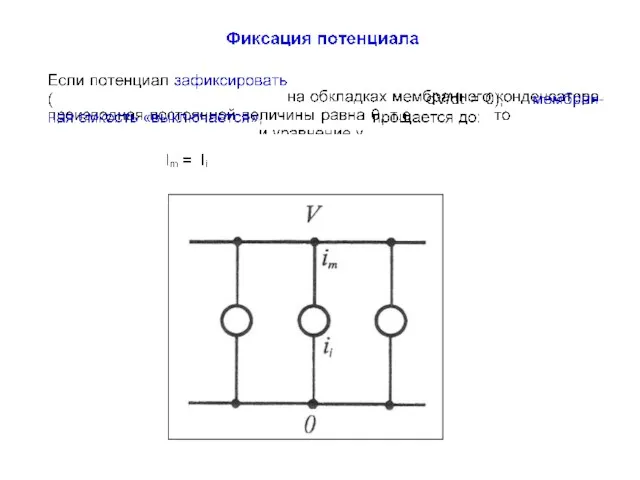
- 12. Проблема измерения токов Разделение перечисленных токов, зависимых как от времени, так и самого потенциала, представляет собой
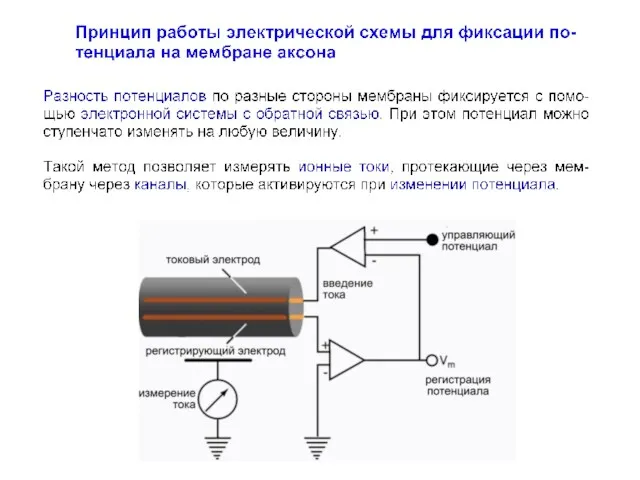
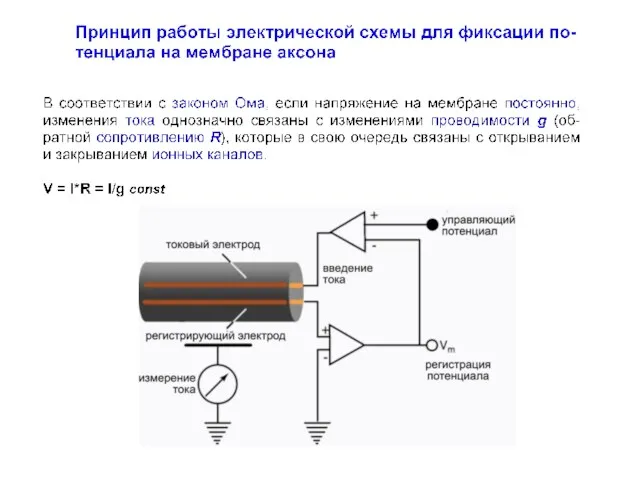
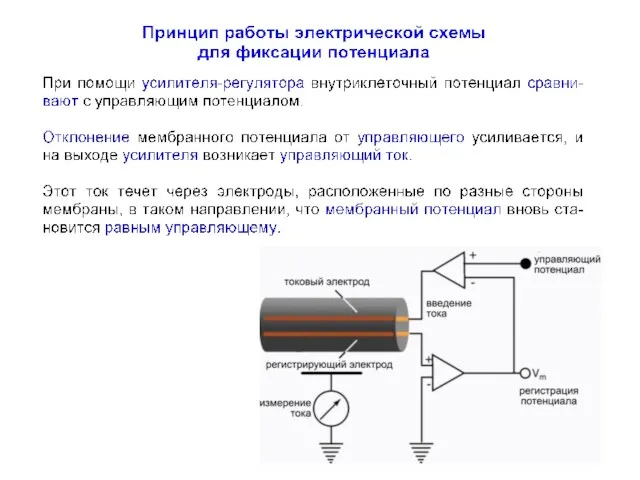
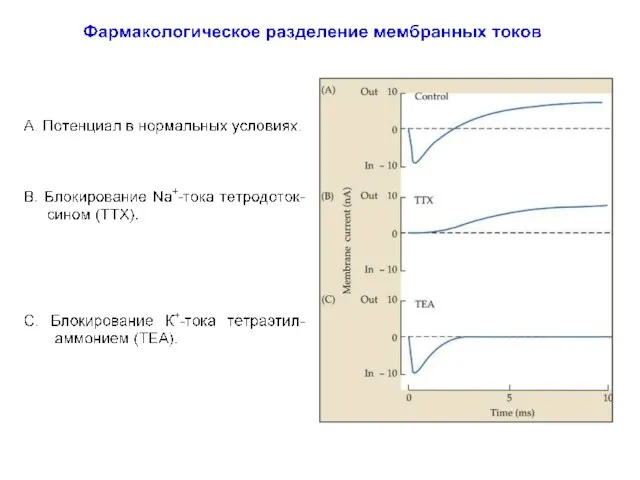
- 20. Этот метод оказался революционным для своего времени, поскольку предоставил ряд принципиальных возможностей для исследования возбудимости клеточных
- 21. Этот метод оказался революционным для своего времени, поскольку предоставил ряд принципиальных возможностей для исследования возбудимости клеточных
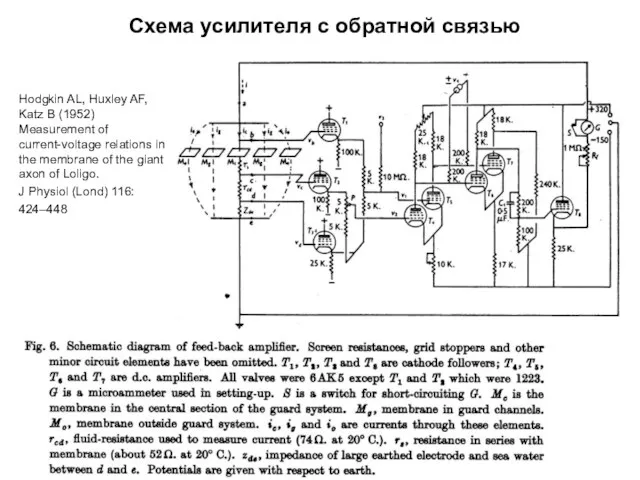
- 22. Схема усилителя с обратной связью Hodgkin AL, Huxley AF, Katz B (1952) Measurement of current-voltage relations
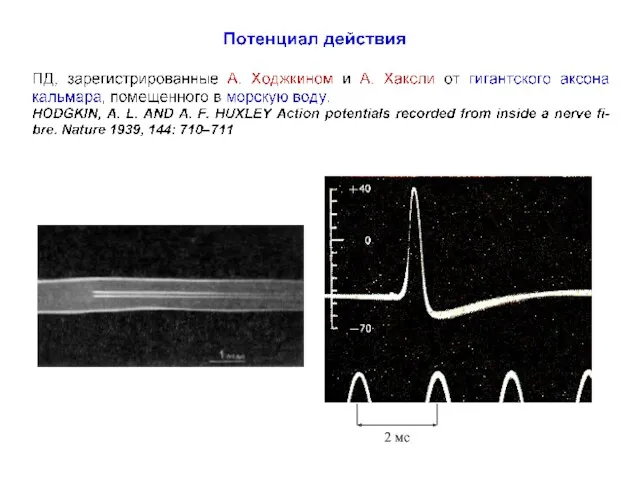
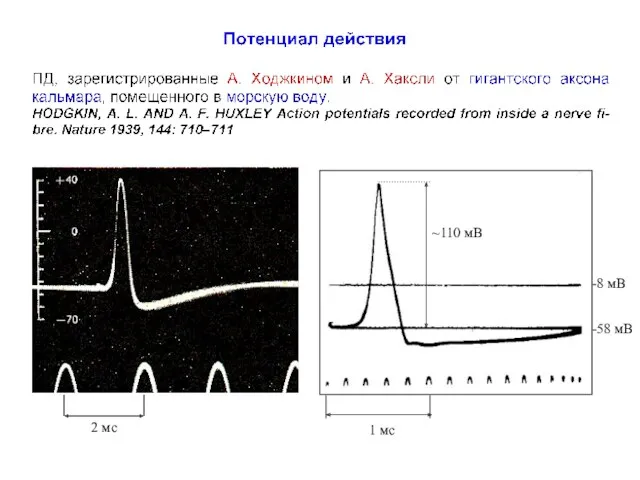
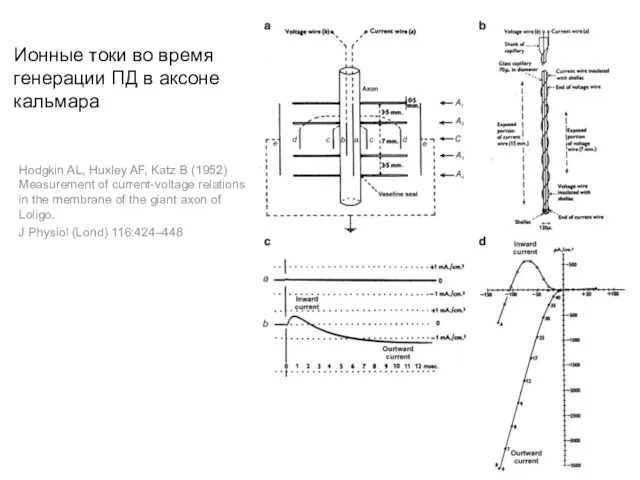
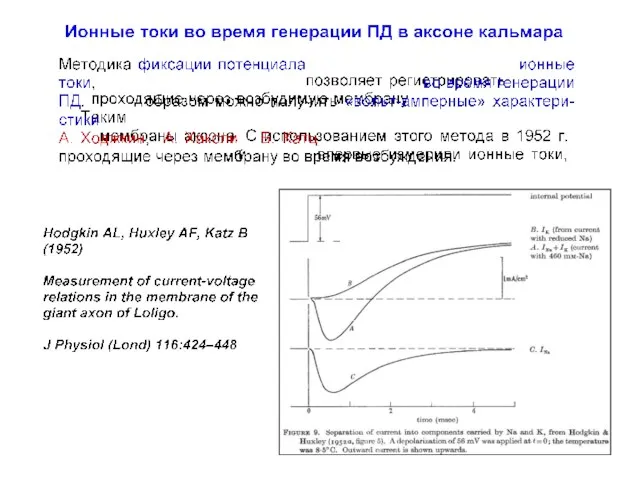
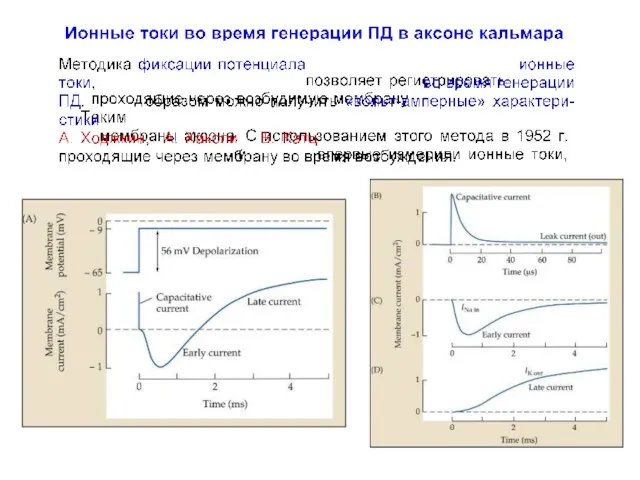
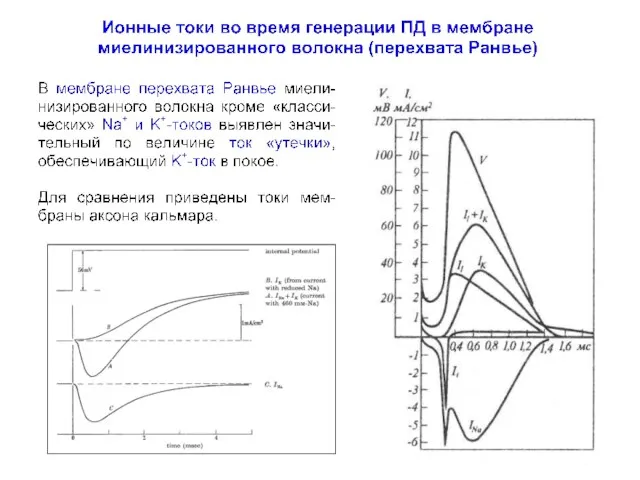
- 23. Ионные токи во время генерации ПД в аксоне кальмара Hodgkin AL, Huxley AF, Katz B (1952)
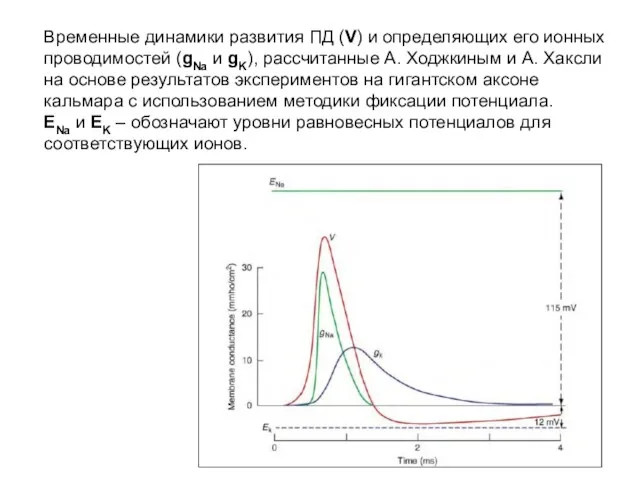
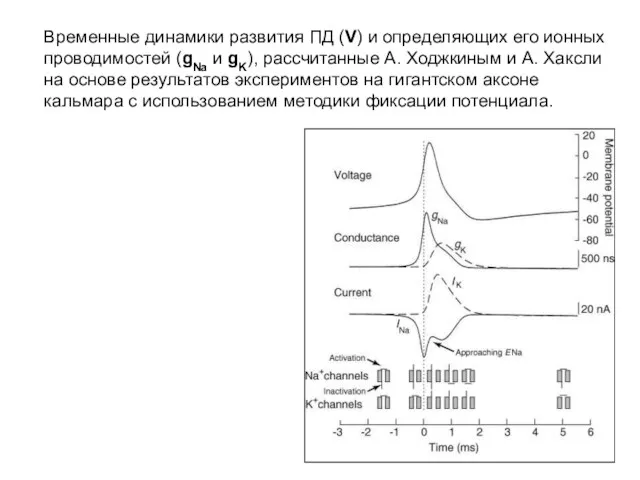
- 27. Временные динамики развития ПД (V) и определяющих его ионных проводимостей (gNa и gK), рассчитанные А. Ходжкиным
- 28. Временные динамики развития ПД (V) и определяющих его ионных проводимостей (gNa и gK), рассчитанные А. Ходжкиным
- 33. Активационные и инактивационные механизмы проводимости мембраны
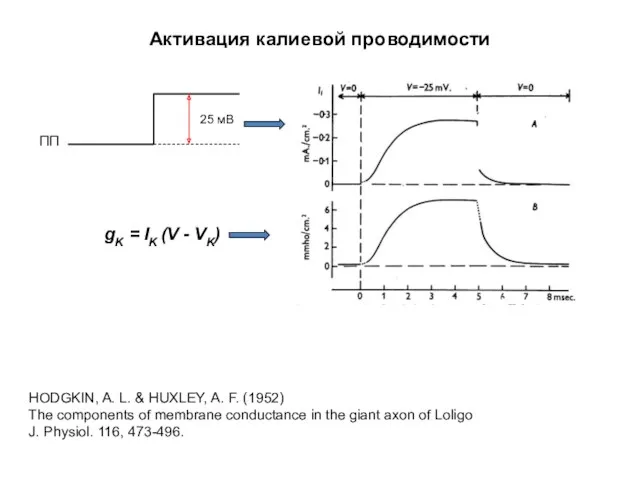
- 34. Активация калиевой проводимости ПП 25 мВ HODGKIN, A. L. & HUXLEY, A. F. (1952) The components
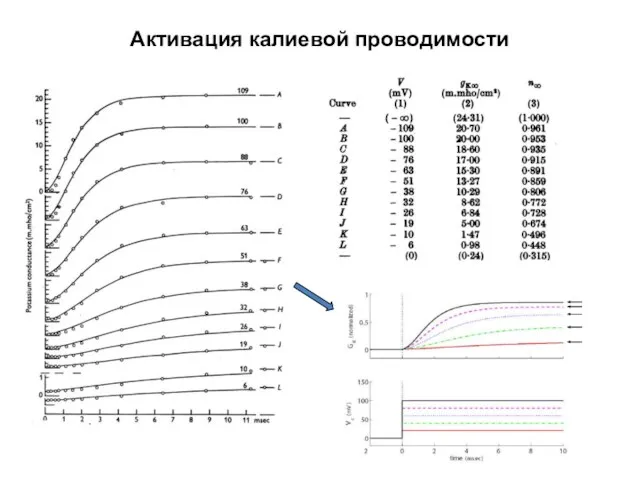
- 35. Активация калиевой проводимости
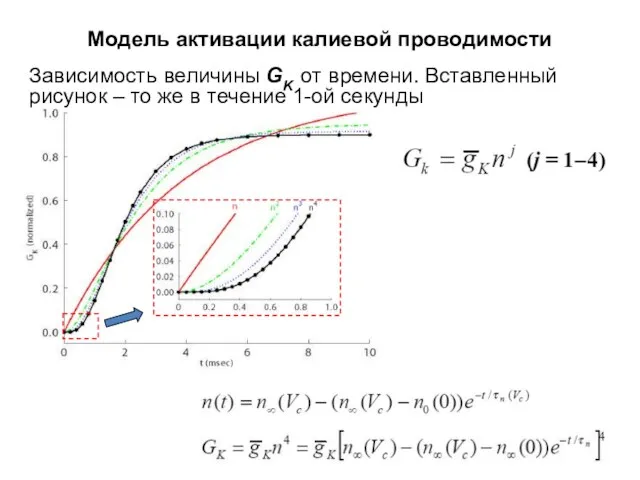
- 36. Модель активации калиевой проводимости Зависимость величины GK от времени. Вставленный рисунок – то же в течение
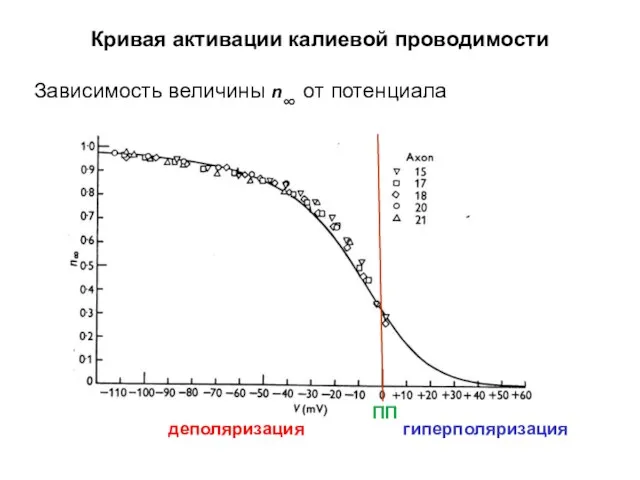
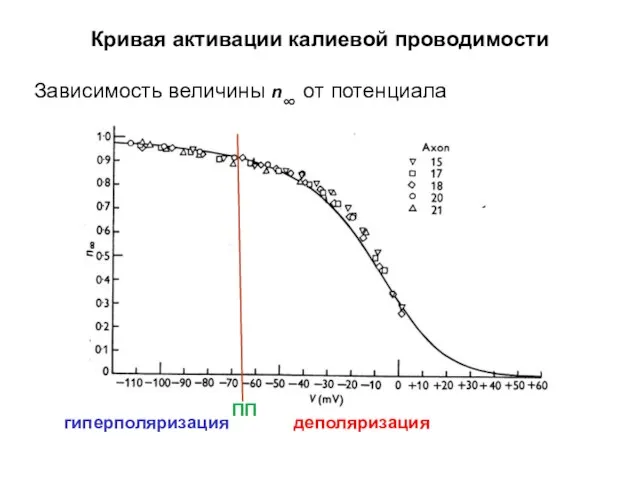
- 37. Кривая активации калиевой проводимости Зависимость величины n∞ от потенциала деполяризация гиперполяризация ПП
- 38. Кривая активации калиевой проводимости Зависимость величины n∞ от потенциала гиперполяризация деполяризация ПП
- 39. Активация калииевой проводимости мембраны Для K+-проводимости А. Ходжкин и А. Хаксли ввели переменную n, которая отражает
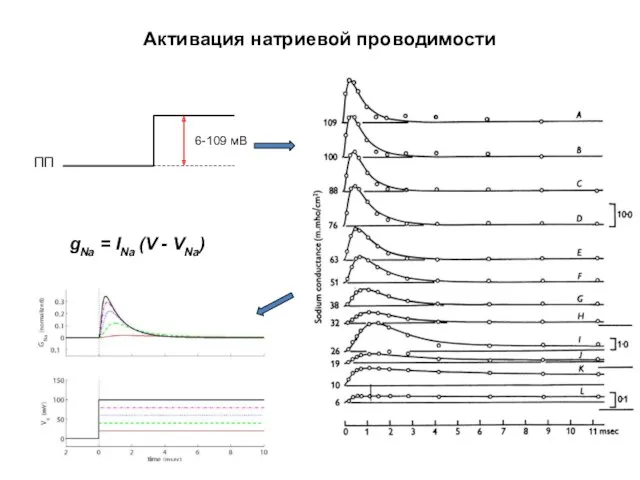
- 40. Активация натриевой проводимости gNa = INa (V - VNa)
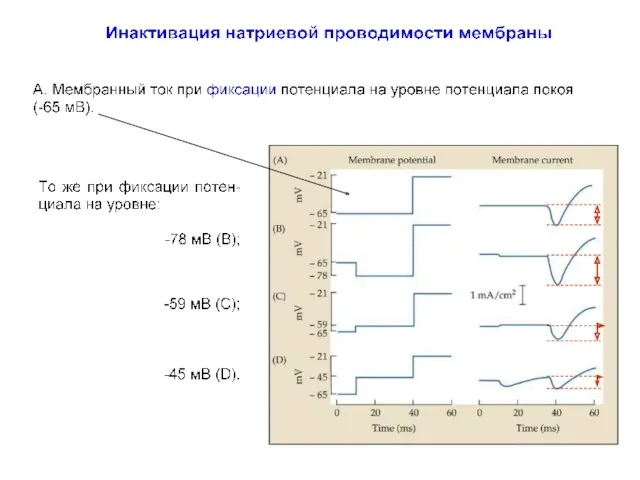
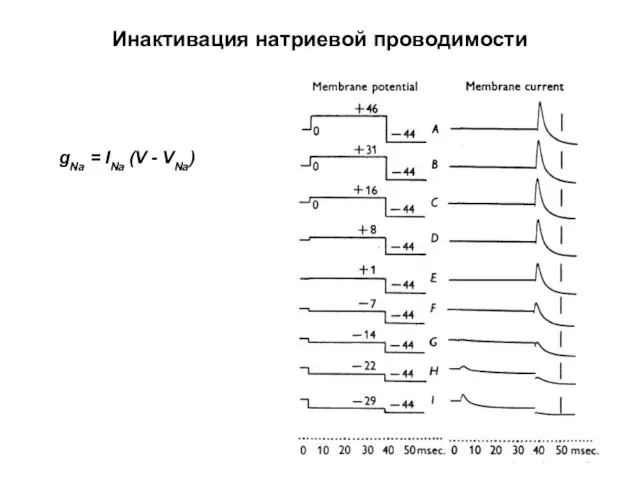
- 41. Инактивация натриевой проводимости gNa = INa (V - VNa)
- 42. Активация и инактивация натриевой проводимости
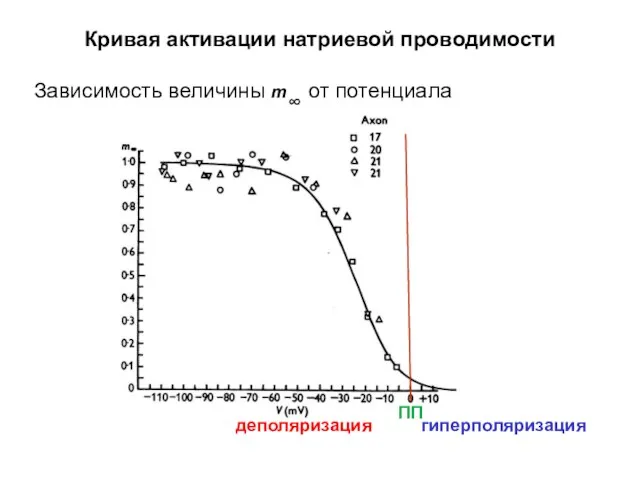
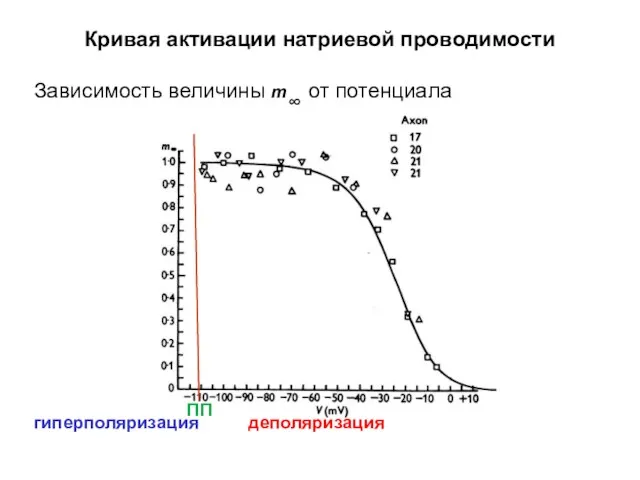
- 43. Кривая активации натриевой проводимости Зависимость величины m∞ от потенциала деполяризация гиперполяризация ПП
- 44. Кривая активации натриевой проводимости Зависимость величины m∞ от потенциала гиперполяризация деполяризация ПП
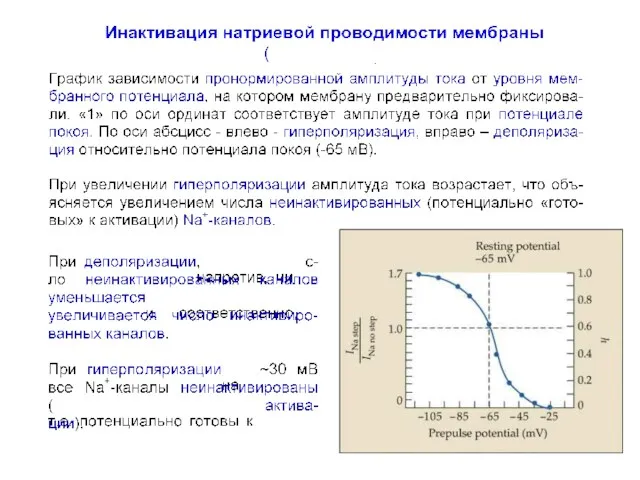
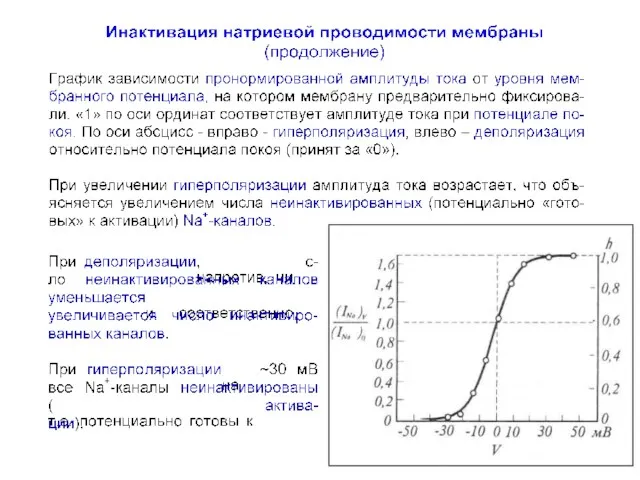
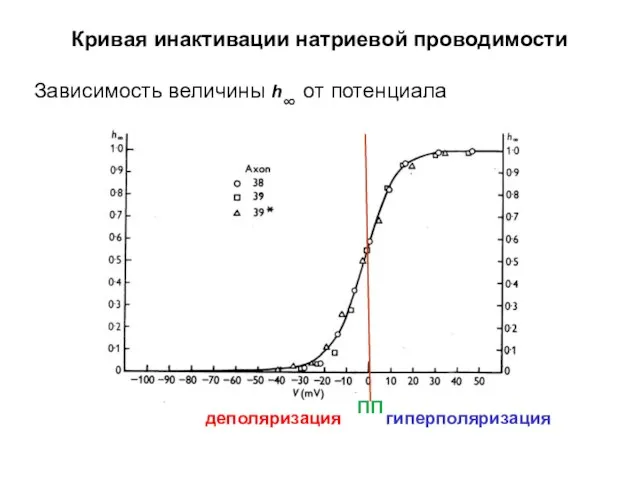
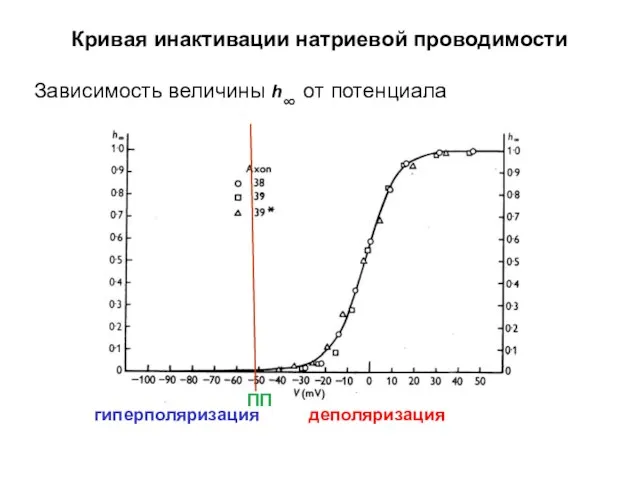
- 45. Кривая инактивации натриевой проводимости Зависимость величины h∞ от потенциала деполяризация гиперполяризация ПП
- 46. Кривая инактивации натриевой проводимости Зависимость величины h∞ от потенциала гиперполяризация деполяризация ПП
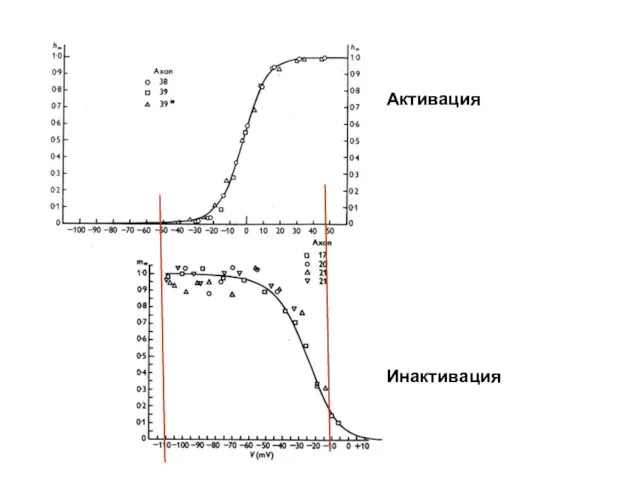
- 47. Активация Инактивация
- 48. Активация и инактивация натриевой проводимости мембраны Для Na+-проводимости А. Ходжкин и А. Хаксли ввели переменные m
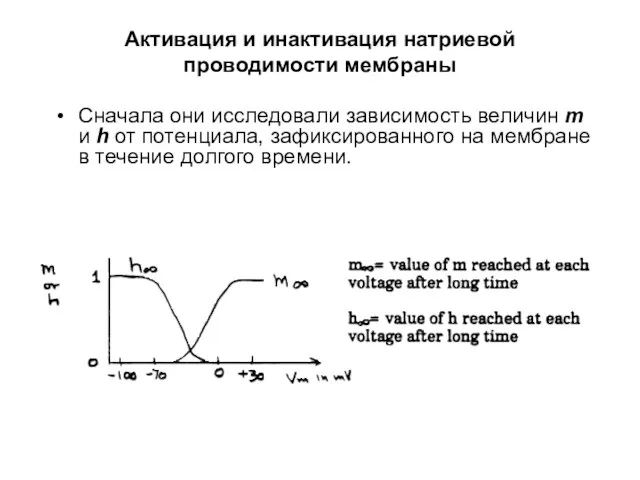
- 49. Сначала они исследовали зависимость величин m и h от потенциала, зафиксированного на мембране в течение долгого
- 50. Затем они описали зависимость величин m и h от времени. В клетке в течение долгого времени
- 51. Инактивация натриевой проводимости мембраны (продолжение) А. Ходжкин и А. Хаксли предложили простую умозрительную физическую модель, которая
- 52. Инактивация натриевой проводимости мембраны (продолжение) Для отдельного канала переменная m отражает вероятность того, что одни m-ворота
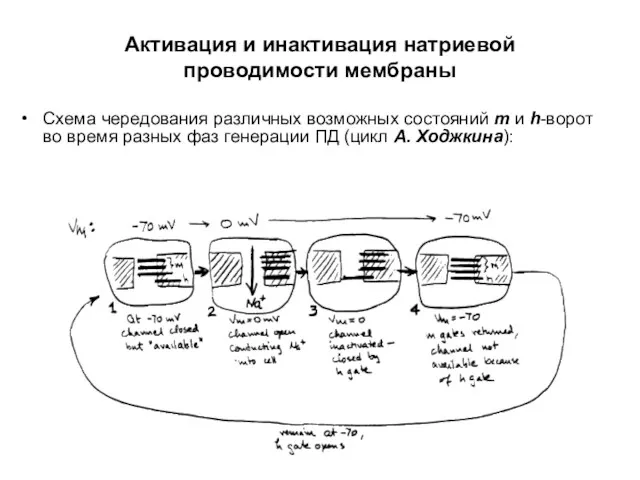
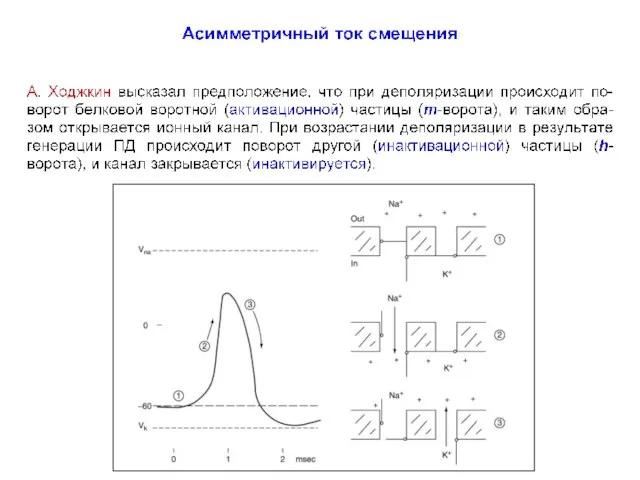
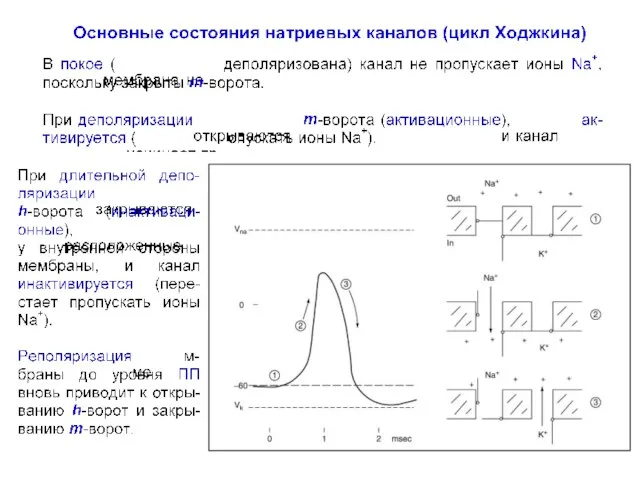
- 53. Схема чередования различных возможных состояний m и h-ворот во время разных фаз генерации ПД (цикл А.
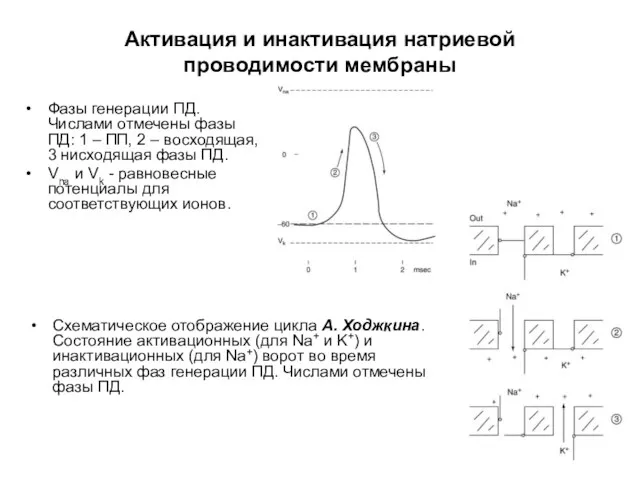
- 54. Фазы генерации ПД. Числами отмечены фазы ПД: 1 – ПП, 2 – восходящая, 3 нисходящая фазы
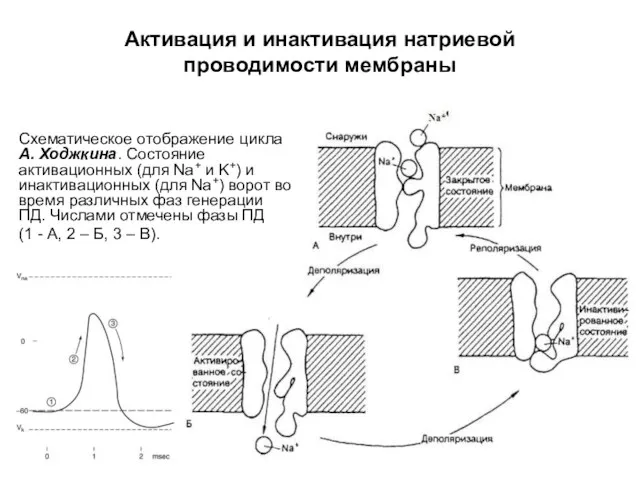
- 55. Схематическое отображение цикла А. Ходжкина. Состояние активационных (для Na+ и K+) и инактивационных (для Na+) ворот
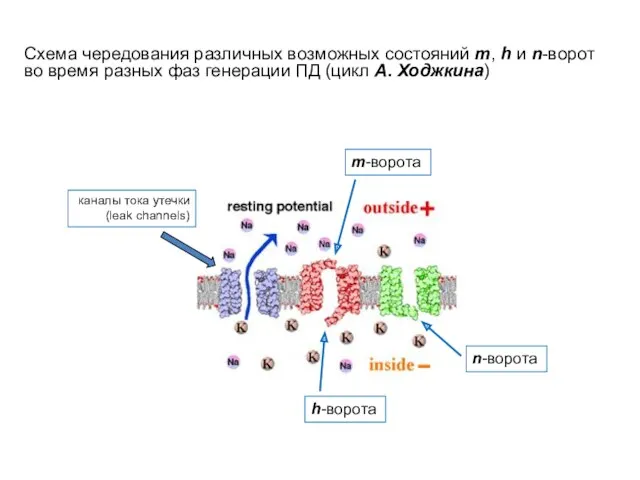
- 56. Схема чередования различных возможных состояний m, h и n-ворот во время разных фаз генерации ПД (цикл
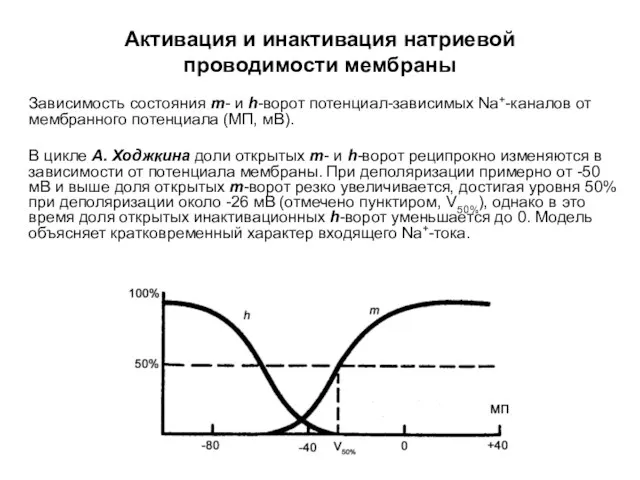
- 57. Зависимость состояния m- и h-ворот потенциал-зависимых Na+-каналов от мембранного потенциала (МП, мВ). В цикле А. Ходжкина
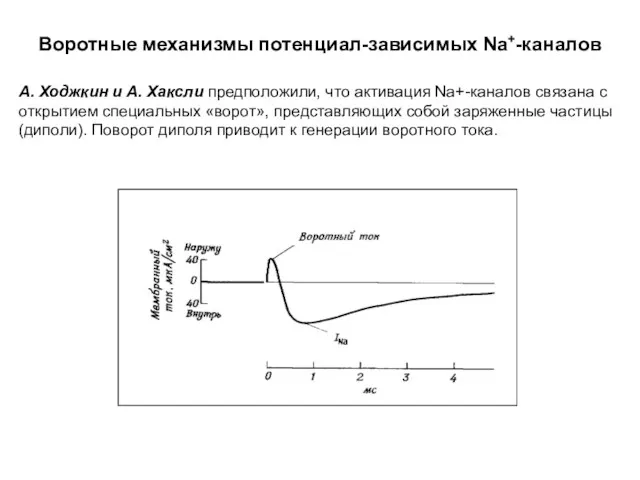
- 58. Воротные механизмы потенциал-зависимых Na+-каналов А. Ходжкин и А. Хаксли предположили, что активация Na+-каналов связана с открытием
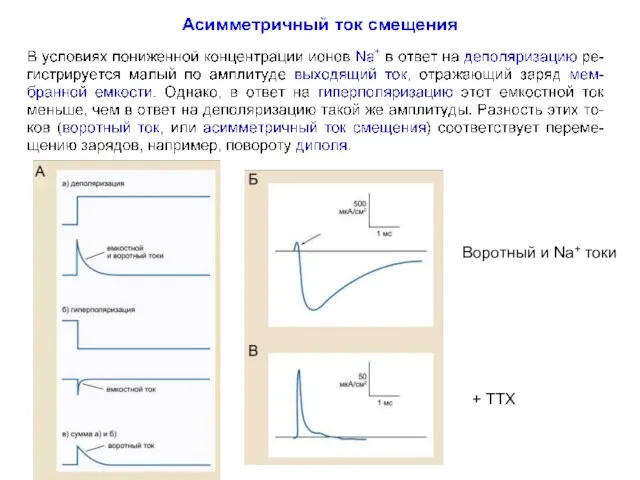
- 59. + TTX Воротный и Na+ токи
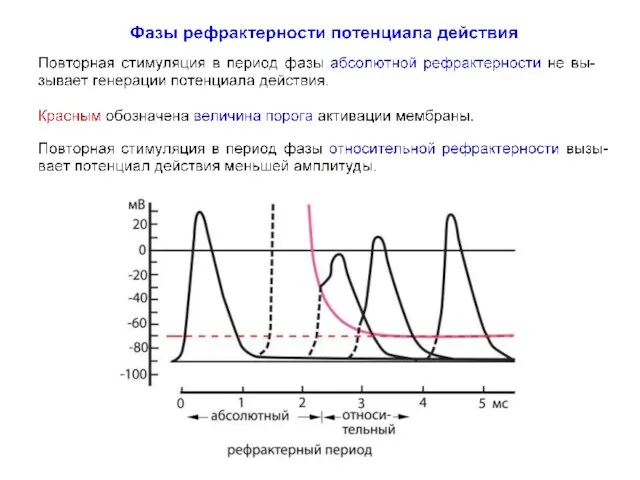
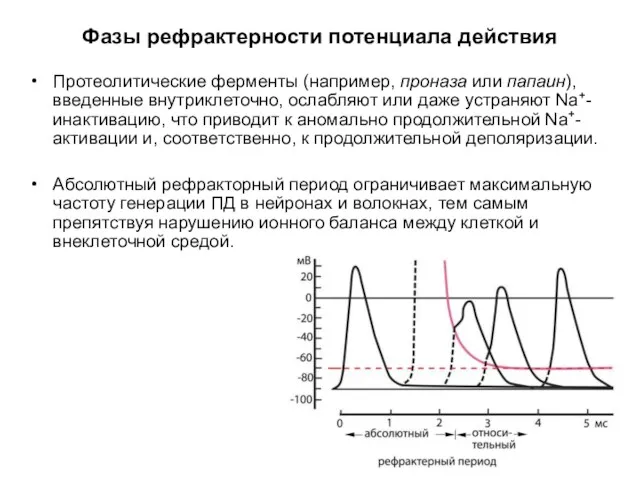
- 64. Фазы рефрактерности потенциала действия Протеолитические ферменты (например, проназа или папаин), введенные внутриклеточно, ослабляют или даже устраняют
- 65. Фазы рефрактерности потенциала действия Воздействие деполяризации мембраны на процессы активации и инактивации Na+-проводимости имеет важное физиологическое
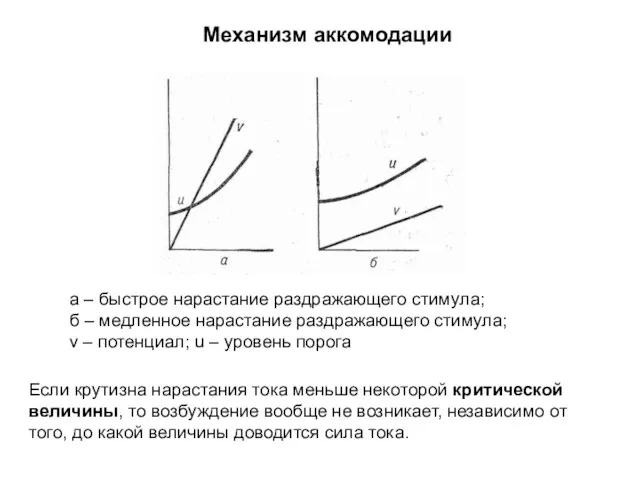
- 66. а – быстрое нарастание раздражающего стимула; б – медленное нарастание раздражающего стимула; v – потенциал; u
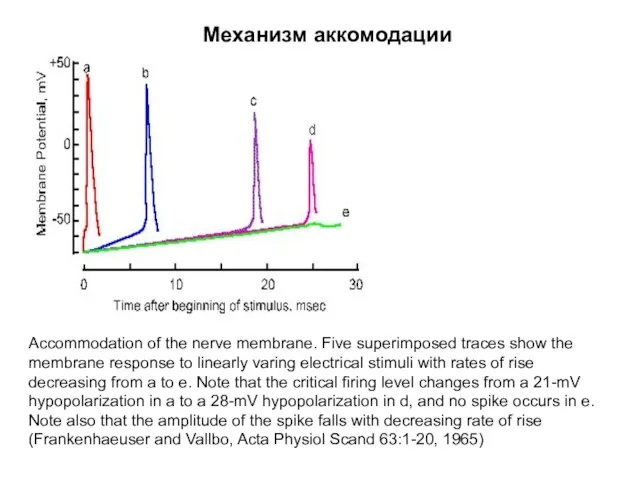
- 67. Механизм аккомодации Accommodation of the nerve membrane. Five superimposed traces show the membrane response to linearly
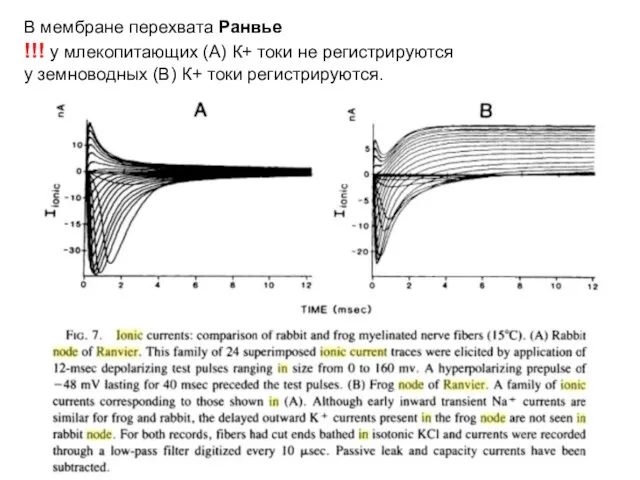
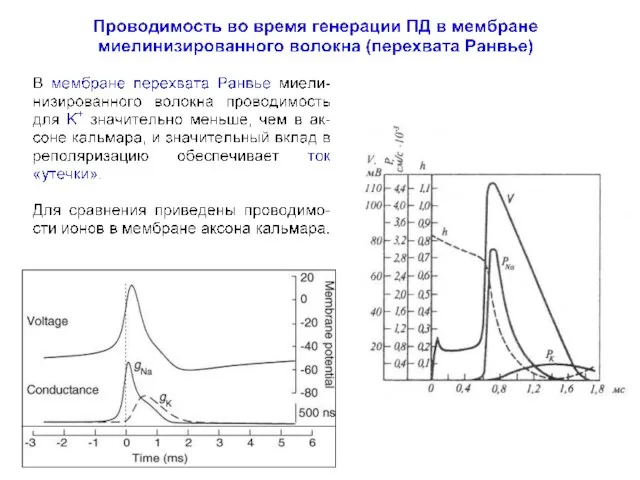
- 68. В мембране перехвата Ранвье !!! у млекопитающих (А) К+ токи не регистрируются у земноводных (В) К+
- 71. Генерация ПД в нейронах Аксоны представляют собой относительно простое мембранное образование, обеспечивающее проведение ПД по нервному
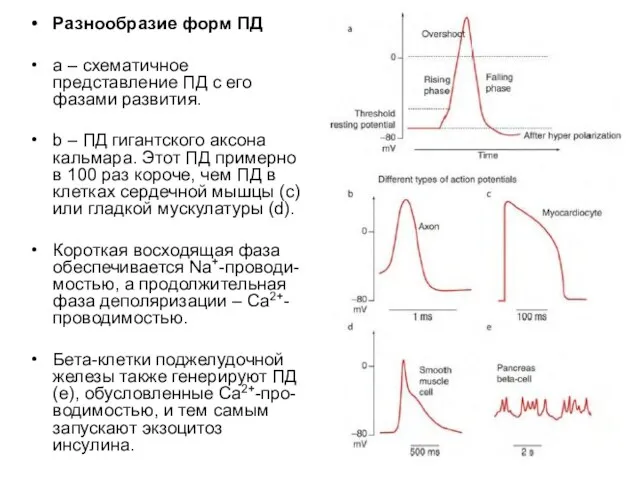
- 72. Разнообразие форм ПД a – схематичное представление ПД с его фазами развития. b – ПД гигантского
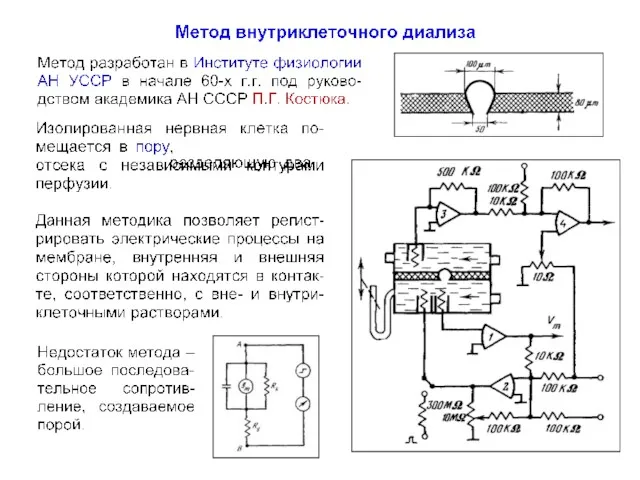
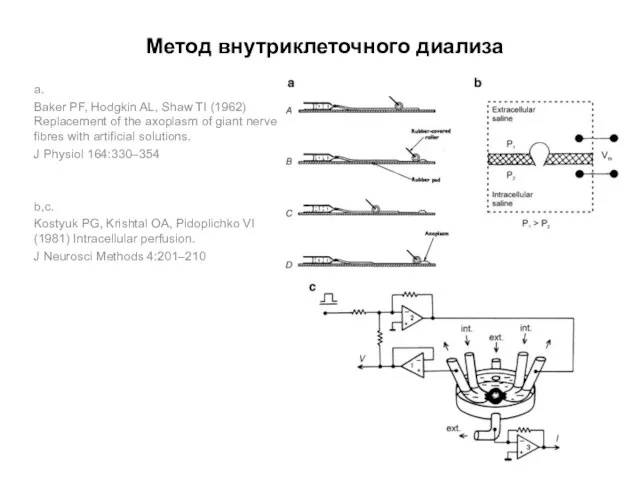
- 73. Метод внутриклеточного диализа Метод разработан в Институте физиологии АН УССР (г. Киев) в начале 1960-х г.г.
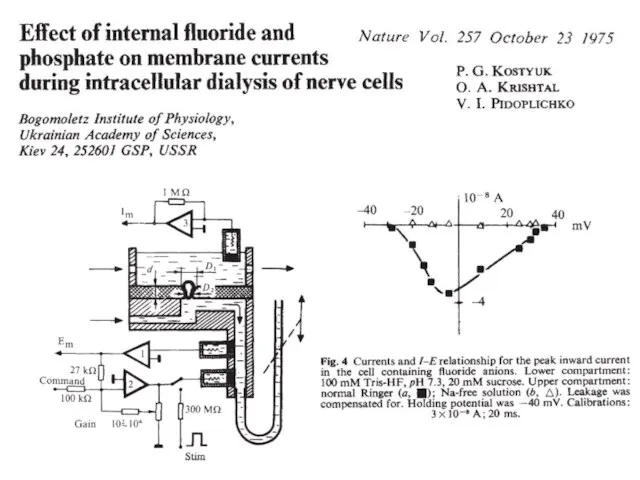
- 76. Метод внутриклеточного диализа a. Baker PF, Hodgkin AL, Shaw TI (1962) Replacement of the axoplasm of
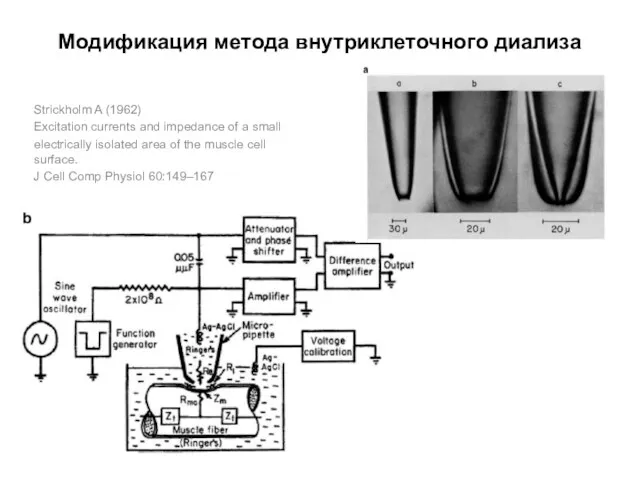
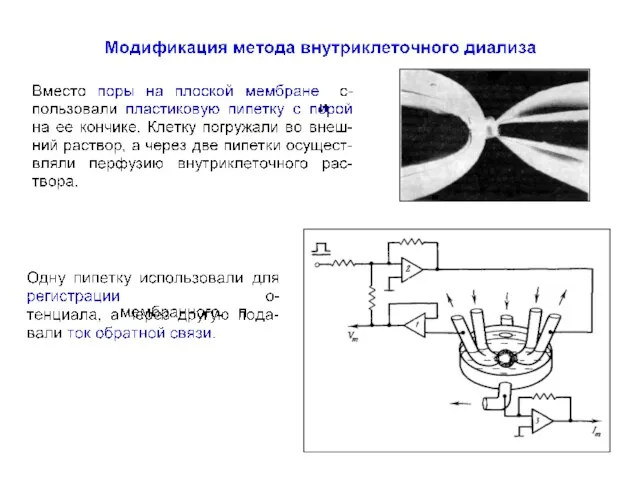
- 77. Модификация метода внутриклеточного диализа Strickholm A (1962) Excitation currents and impedance of a small electrically isolated
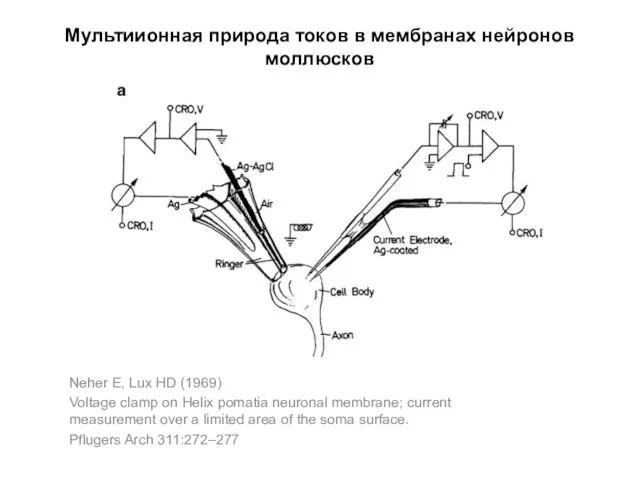
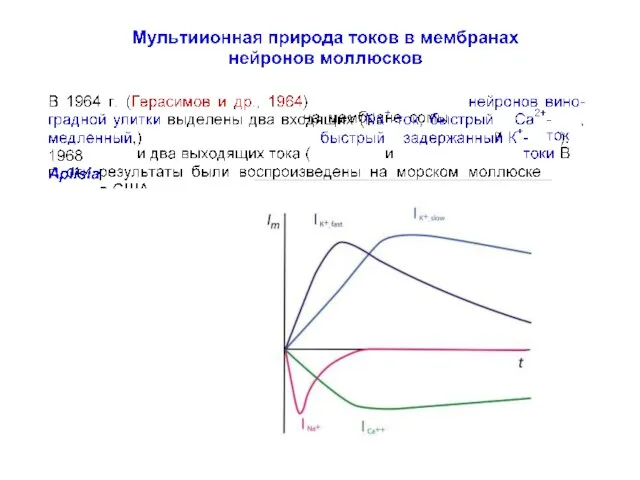
- 79. Мультиионная природа токов в мембранах нейронов моллюсков Neher E, Lux HD (1969) Voltage clamp on Helix
- 80. Мультиионная природа токов в мембранах нейронов моллюсков Neher E, Lux HD (1969) Voltage clamp on Helix
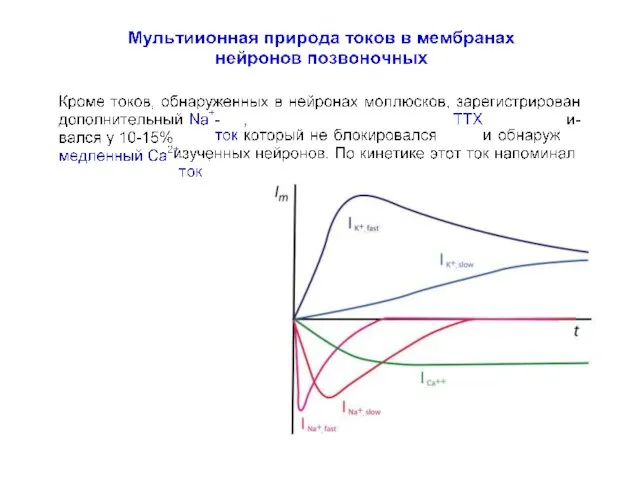
- 81. Герасимов В.Д., Костюк П.Г., Майский В.А. Возбудимость гигантских нервных клеток различных представителей легочных моллюсков в растворах,
- 85. Скачать презентацию




















 Презентации к урокам 9 - 11 класс
Презентации к урокам 9 - 11 класс Значение дыхания. Органы дыхания
Значение дыхания. Органы дыхания Дополнительная презентация Что такое фитодизайн?к элективному курсу Основы фитодизайна, 9 класс
Дополнительная презентация Что такое фитодизайн?к элективному курсу Основы фитодизайна, 9 класс Проводящие ткани. Проводящие пучки
Проводящие ткани. Проводящие пучки Система кровообращения. Большой и малый круги кровообращения. Физиология и основы анатомии сердца
Система кровообращения. Большой и малый круги кровообращения. Физиология и основы анатомии сердца Белки. Качественный состав белков
Белки. Качественный состав белков Видоизменения побегов растения
Видоизменения побегов растения Селекция растений
Селекция растений презентация о результатах педагогической деятельности учителя биологии Анохиной Е.И.
презентация о результатах педагогической деятельности учителя биологии Анохиной Е.И. Вид. Структура и критерии вида
Вид. Структура и критерии вида Роль лишайников в почвообразовании
Роль лишайников в почвообразовании Тип плоские черви
Тип плоские черви Видообразование
Видообразование Морфология бактерий
Морфология бактерий Высшие психические функции. Память
Высшие психические функции. Память Лекарственные растения Воронежской области
Лекарственные растения Воронежской области Вода и ее свойства
Вода и ее свойства Хвостатые земноводные
Хвостатые земноводные Комнатные растения в интерьере
Комнатные растения в интерьере Экология. Экосистемы
Экология. Экосистемы Рост и развитие растений
Рост и развитие растений Введение (Биология – Медицина – Человек). Молекулярно- клеточный уровень организации живого. Лекция №1
Введение (Биология – Медицина – Человек). Молекулярно- клеточный уровень организации живого. Лекция №1 Удивительное существо кошка
Удивительное существо кошка Строение и функции кожи человека
Строение и функции кожи человека Собственно- соединительные ткани
Собственно- соединительные ткани Анатомия вегетативных органов
Анатомия вегетативных органов Сердечно – сосудистая система
Сердечно – сосудистая система African - plains
African - plains