Содержание
- 2. Качественный и количественный состав растворов определяется следующими параметрами: Температура кипения Тк Концентрация С Давление насыщенного пара
- 3. идеальные разбавленные концентрированные Растворы в зависимости от свойств р.в. неэлектролиты Растворы высокомолекулярных соединений электролиты Процесс образования
- 4. Давление насыщенного пара над раствором. Закон Рауля. РА0 ≠ PА РА0 - давление насыщенного пара над
- 5. Рассмотрим бинарный идеальный раствор, состоящий из летучих компонентов А и В и находящийся в равновесии со
- 6. Общее давление насыщенного пара над раствором равно: Р = РАо NАж + PВо NВж; P =
- 7. Зависимости парциальных и общего давления от состава раствора (подчинение закону Рауля) 1 - PА ; 2
- 8. Для неидеальных летучих смесей закон Рауля выполняется только для растворителя и только в области предельно-разбавленных растворов
- 9. PB=PB0 NB; PB0 = КГ; В идеальном растворе Закон Генри совладает с Законом Рауля – для
- 10. Испарение неидеальных летучих смесей Положительные (а) и отрицательные (б) отклонения от закона Рауля, касательные к кривым
- 11. Отклонения от закона Рауля FА-В = FА-А = FВ-В ΔH = 0 ΔV = 0 FА-В
- 12. Состав жидкости обычно отличается от состава равновесного с ней пара
- 13. Соотношение между составом пара и составом жидкости В общем случае состав пара отличается от состава идеального
- 14. Новый тип диаграмм Пар по сравнению с равновесной жидкостью богаче чем компонентом, добавлением которого в систему
- 15. Перегонка смесей, компоненты которой не образуют азеотроп Смесь разделяется на исходные компоненты
- 16. Системы с отклонениями от закона Рауля Точки max и mix на кривых общего давления пара отвечают
- 17. Перегонка смесей, компоненты которой образуют азеотроп Смесь разделяется на азеотроп и один из чистых компонентов
- 18. Перегонка – разделение смесей (или их обогащение) 1) Перегонка в равновесии (простая) пар находится в равновесии
- 19. Схема фракционной перегонки жидких летучих смесей с азеотропом
- 20. Второй Закон Рауля
- 21. Понижение температуры замерзания растворов. Криоскопия. Зависимости давления насыщенного пара от температуры над твердой и жидкой фазами:
- 22. Для разбавленных растворов электролитов в уравнение криоскопии (3) вводят изотонический коэффициент Вант - Гоффа i: который
- 23. Криометрия – метод исследования, основанный на измерении температур кристаллизации растворов исследуемого вещества в подходящих растворителях Рис
- 24. Условие кипения Жидкость закипит, если давление пара в пузырьке станет равным внешнему давлению
- 25. Зависимости давления насыщенного пара от температуры для растворителя и растворов: ОА – для чистого растворителя; О'А'
- 26. где М2 – молекулярная масса растворенного вещества. где i – изотонический коэффициент Вант - Гоффа. Физико-химический
- 27. Эбулиоскопия – метод исследования, основанный на измерениях температур кипения растворов
- 28. Растворы в биологии и биотехнологии Растворами являются все биожидкости организма (кровь, лимфа, моча, желчь, слюна). Законы
- 29. Законы для растворов Закон Генри Описывает влияние внешнего давления на растворимость газа (при снижение внешнего давления
- 31. Скачать презентацию




























 Клиническая биохимия азотистого обмена. (Лекция 7)
Клиническая биохимия азотистого обмена. (Лекция 7) Органы растений. Цветок
Органы растений. Цветок Членистоногие
Членистоногие 5.02- 7кл внутреннее строение листа_
5.02- 7кл внутреннее строение листа_ Мутационная и комбинативная изменчивость
Мутационная и комбинативная изменчивость Мейоз. Типы мейоза
Мейоз. Типы мейоза Общая характеристика отдела моховидные
Общая характеристика отдела моховидные Structura celulei bacteriene
Structura celulei bacteriene Задание № 27 (ОГЭ)
Задание № 27 (ОГЭ) Дикорастущие растения и цветы
Дикорастущие растения и цветы Биологические ритмы
Биологические ритмы Исследовательская деятельность на уроках биологии и во внеурочное время как средство развития творческих способностей
Исследовательская деятельность на уроках биологии и во внеурочное время как средство развития творческих способностей Витамины
Витамины Protein synthesis
Protein synthesis Химический состав растений
Химический состав растений Нуклеиновые кислоты и их роль в жизнедеятельности клетки
Нуклеиновые кислоты и их роль в жизнедеятельности клетки 5 весняних квіток
5 весняних квіток Строение клетки
Строение клетки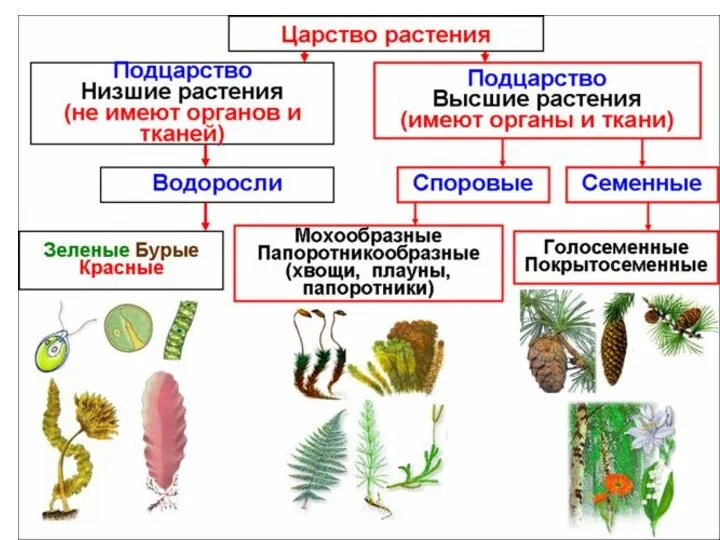 Царство растения
Царство растения Тип Моллюски
Тип Моллюски Опасные животные России
Опасные животные России Вирусы – неклеточные формы жизни
Вирусы – неклеточные формы жизни Содержание углекислого газа в школьных помещениях
Содержание углекислого газа в школьных помещениях Грибы, травы, цветы
Грибы, травы, цветы Нервная система человека
Нервная система человека УРОК Образ мира
УРОК Образ мира Зоология позвоночных. Строение основных типов беспозвоночных
Зоология позвоночных. Строение основных типов беспозвоночных Бізон європейський, або зубр
Бізон європейський, або зубр