Содержание
- 2. Кислород в атмосфере Земли появился около 600 млн. лет назад, что потребовало перестройки механизмов функционирования живых
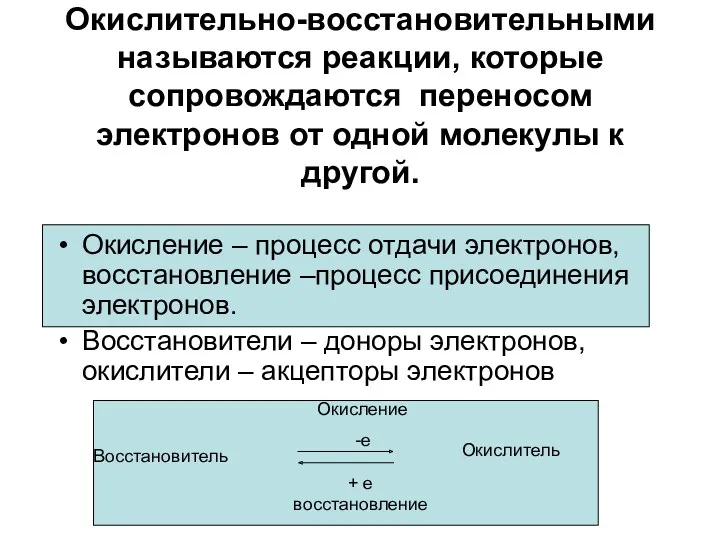
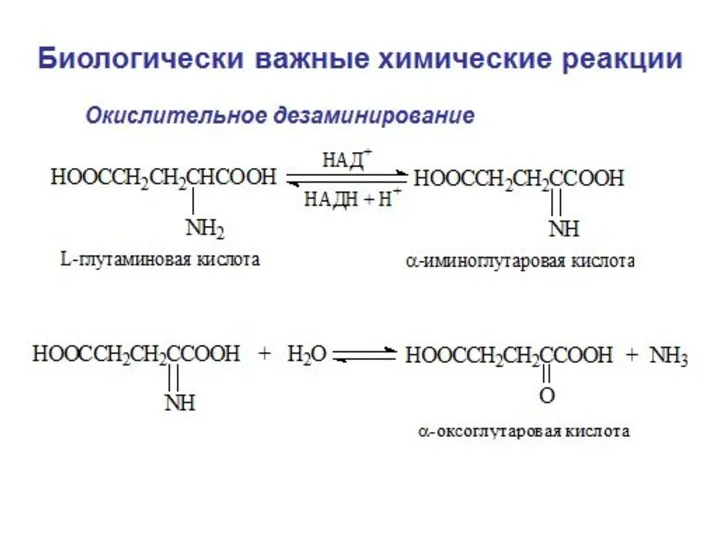
- 3. Окислительно-восстановительными называются реакции, которые сопровождаются переносом электронов от одной молекулы к другой. Окисление – процесс отдачи
- 4. Значение реакций окисления-восстановления в организме 1. Окисление питательных веществ (процессы катаболизма), при которых выделяется энергия, запасаемая
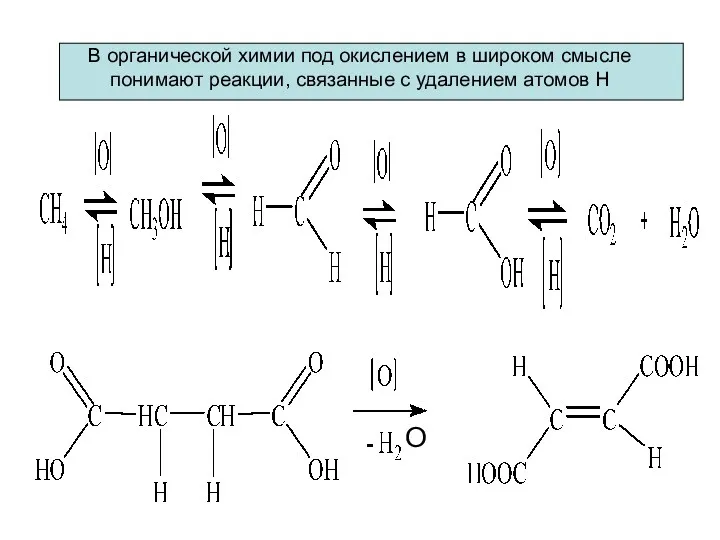
- 5. В органической химии под окислением в широком смысле понимают реакции, связанные с удалением атомов Н О
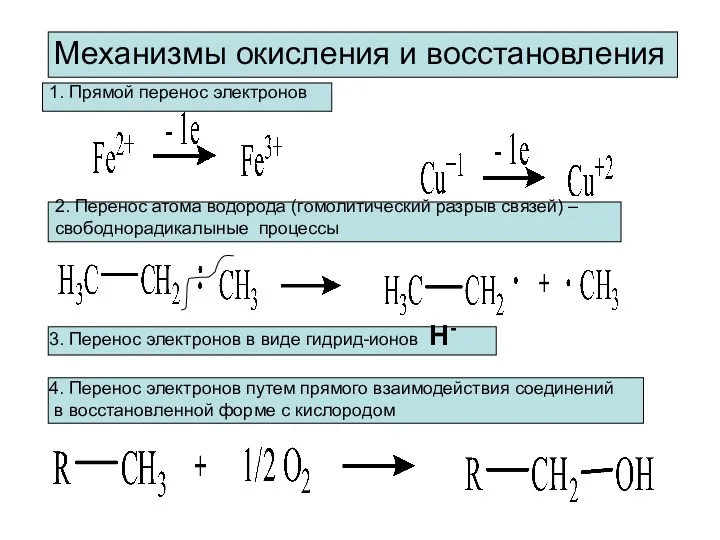
- 6. Механизмы окисления и восстановления 1. Прямой перенос электронов 2. Перенос атома водорода (гомолитический разрыв связей) –
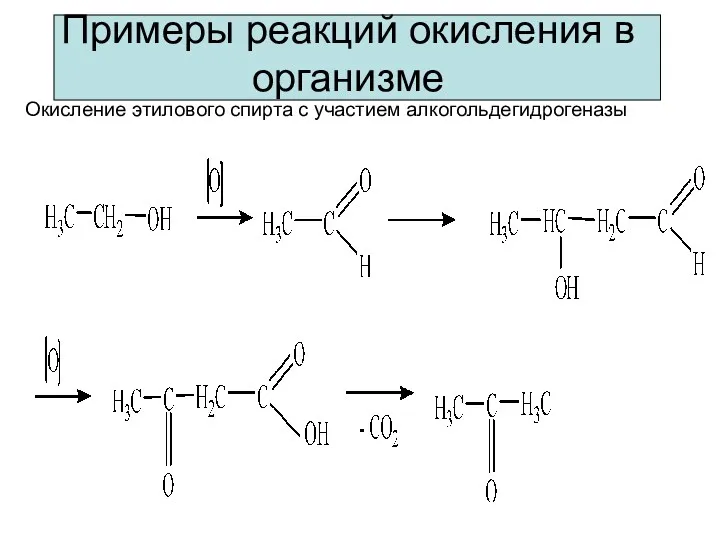
- 7. Примеры реакций окисления в организме Окисление этилового спирта с участием алкогольдегидрогеназы
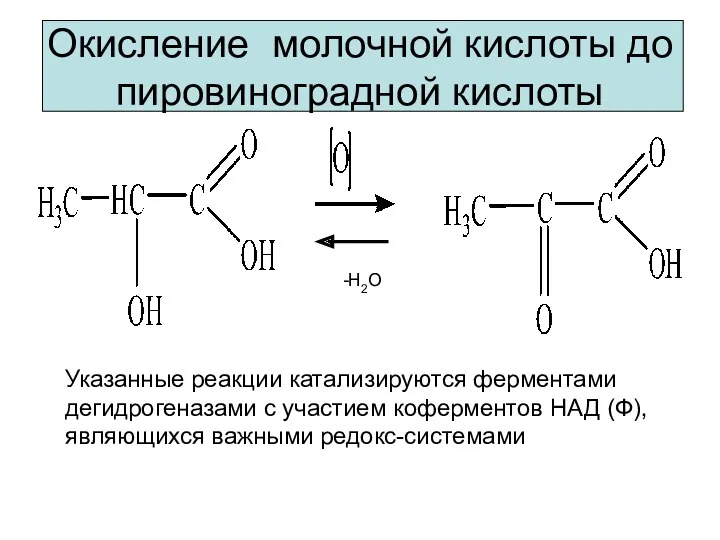
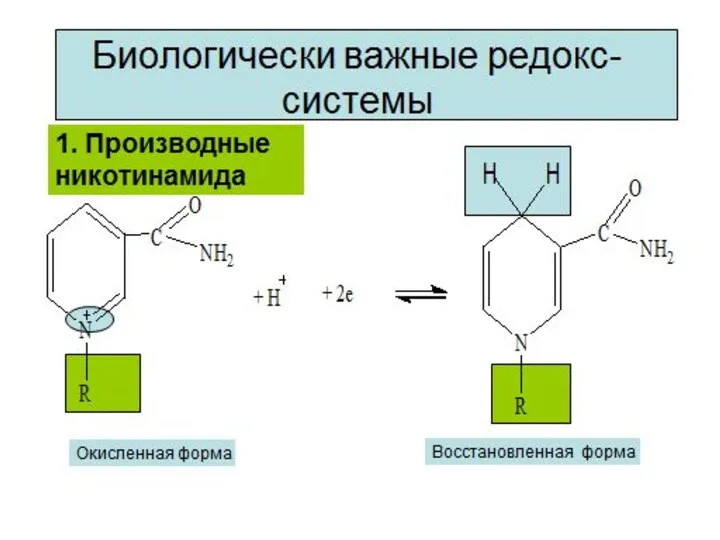
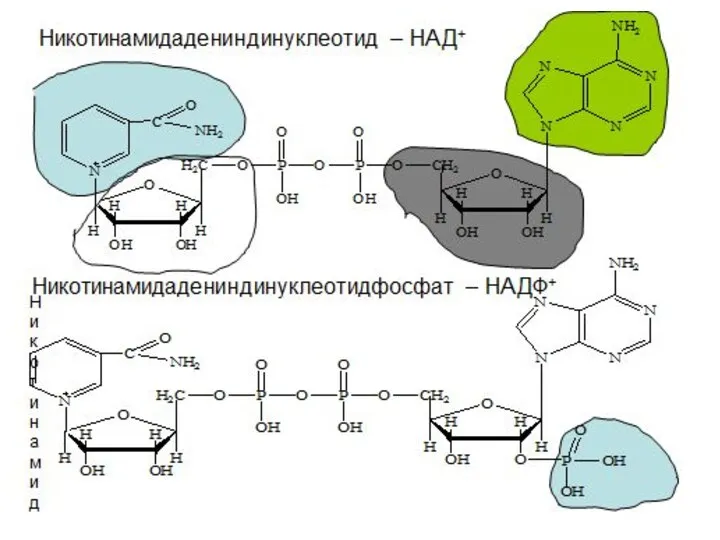
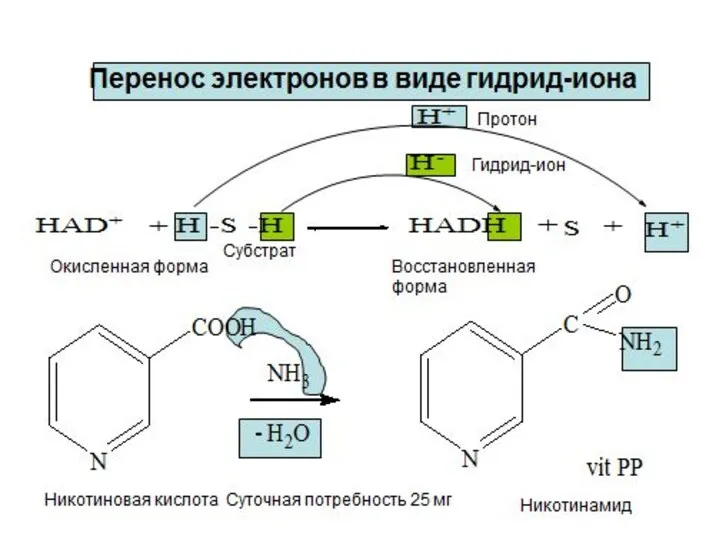
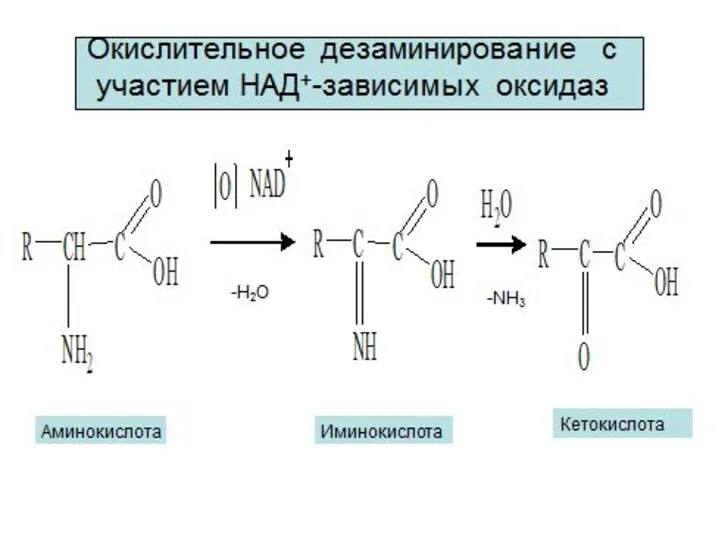
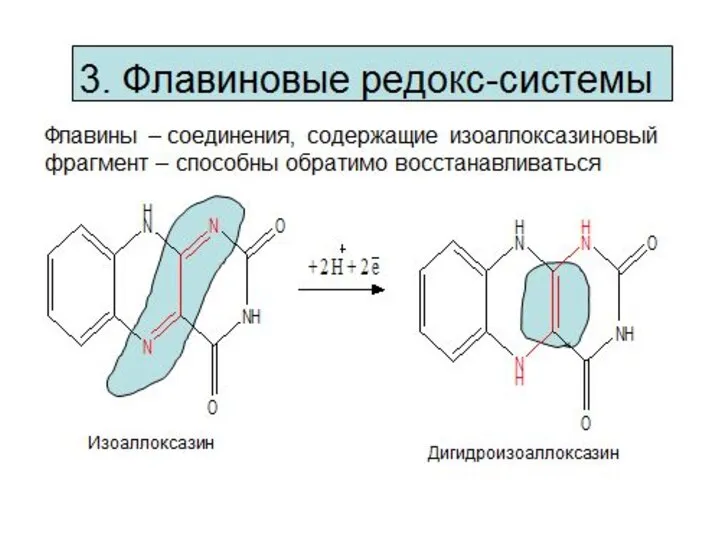
- 8. Окисление молочной кислоты до пировиноградной кислоты Указанные реакции катализируются ферментами дегидрогеназами с участием коферментов НАД (Ф),
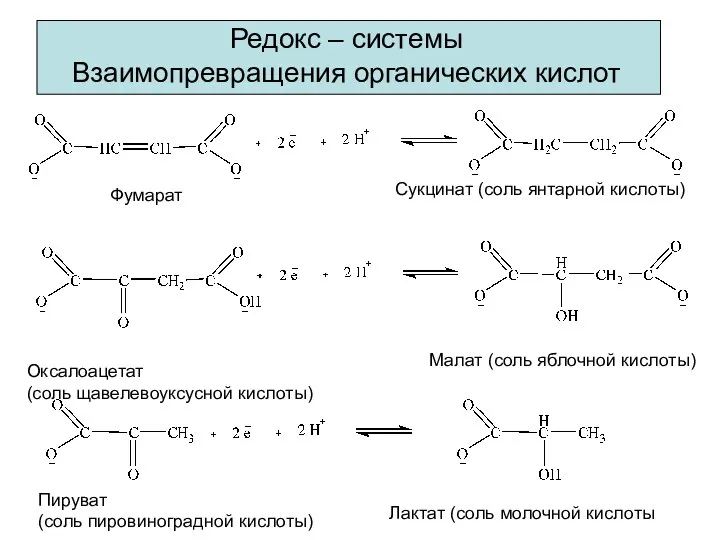
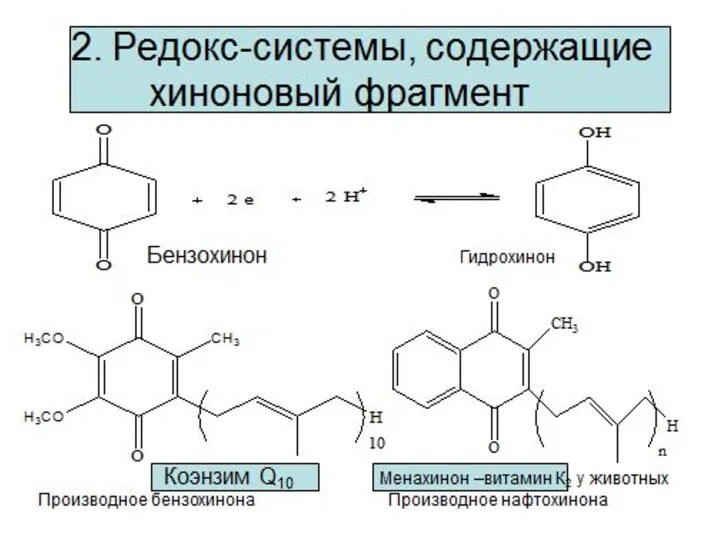
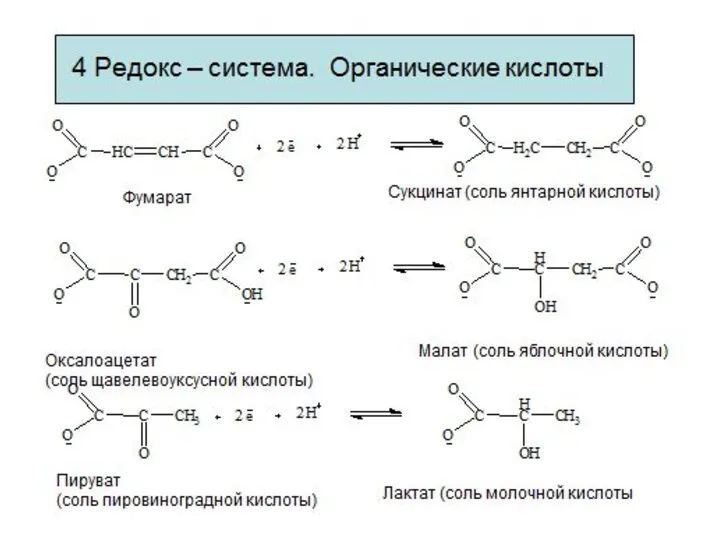
- 9. Редокс – системы Взаимопревращения органических кислот Фумарат Сукцинат (соль янтарной кислоты) Оксалоацетат (соль щавелевоуксусной кислоты) Малат
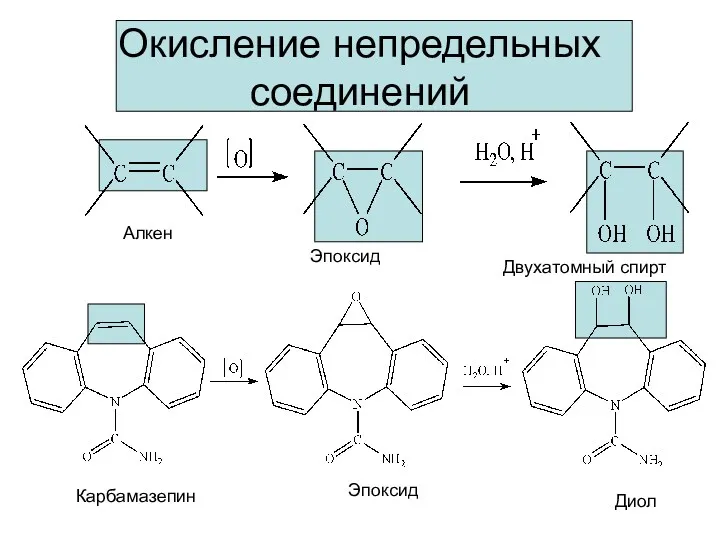
- 11. Окисление непредельных соединений Алкен Эпоксид Двухатомный спирт Карбамазепин Эпоксид Диол
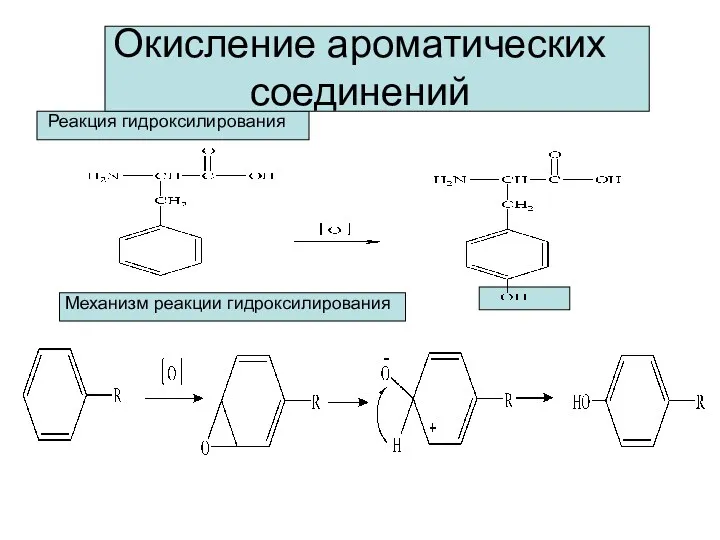
- 12. Окисление ароматических соединений Реакция гидроксилирования Механизм реакции гидроксилирования
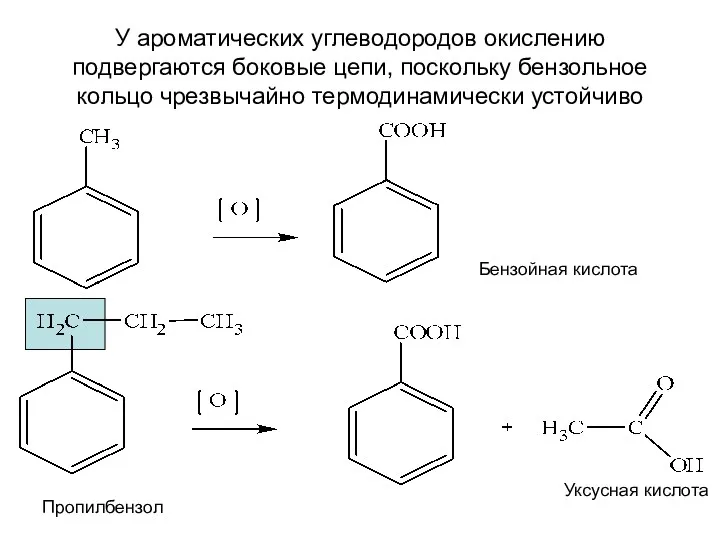
- 13. У ароматических углеводородов окислению подвергаются боковые цепи, поскольку бензольное кольцо чрезвычайно термодинамически устойчиво Бензойная кислота Пропилбензол
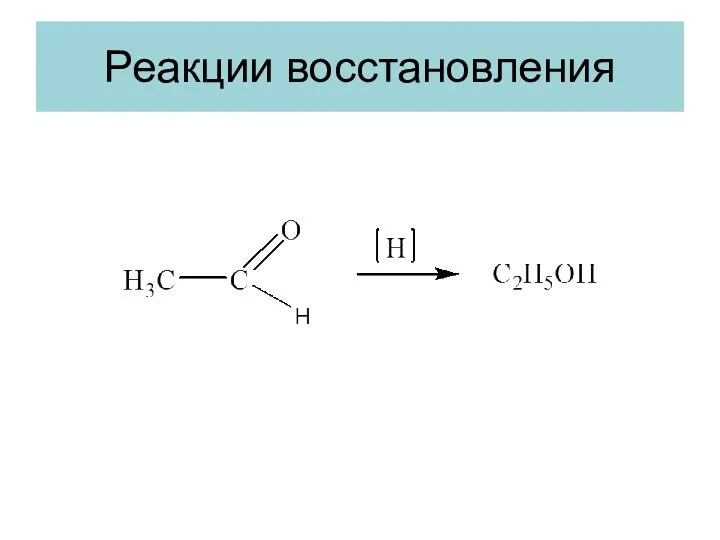
- 14. Реакции восстановления
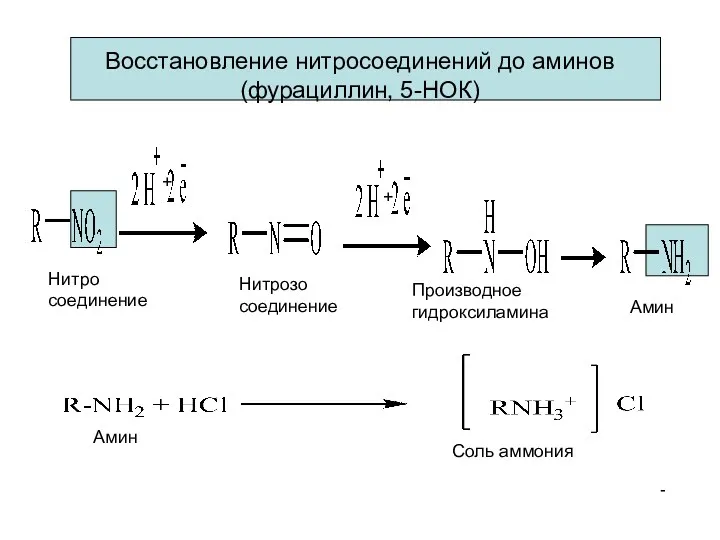
- 15. Нитро соединение Нитрозо соединение Производное гидроксиламина Амин Восстановление нитросоединений до аминов (фурациллин, 5-НОК) - Амин Соль
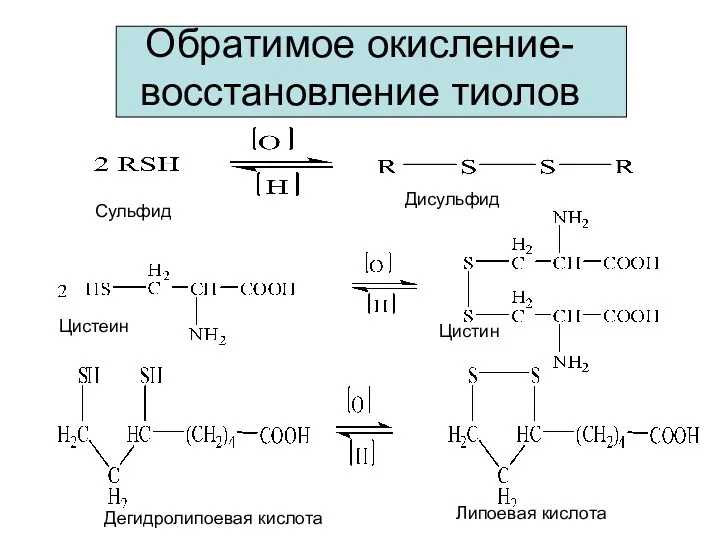
- 16. Обратимое окисление-восстановление тиолов Сульфид Дисульфид Цистеин Цистин Дегидролипоевая кислота Липоевая кислота
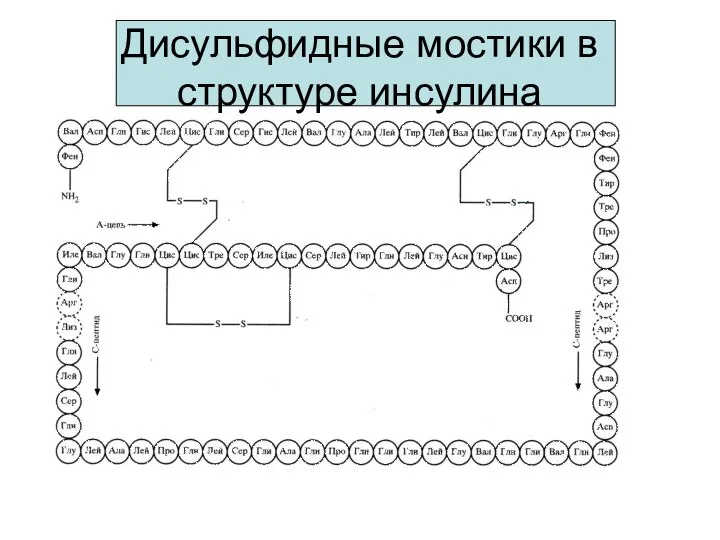
- 17. Дисульфидные мостики в структуре инсулина
- 29. Скачать презентацию



 Органоиды клетки
Органоиды клетки Урок биологии в 6 классе. Презентация к уроку ЦВЕТОК
Урок биологии в 6 классе. Презентация к уроку ЦВЕТОК Развитие растений и способы деления клеток
Развитие растений и способы деления клеток Дрохва. Тварина з Червоної Книги України
Дрохва. Тварина з Червоної Книги України Доклад-презентация Формирование экологических компетентностей обучаемых, через содержание естественно - научного образования
Доклад-презентация Формирование экологических компетентностей обучаемых, через содержание естественно - научного образования Грибы. Тест на пять вопросов
Грибы. Тест на пять вопросов Жизненный цикл клетки. Митоз
Жизненный цикл клетки. Митоз Урок по теме Предмет, задачи и методы экологии
Урок по теме Предмет, задачи и методы экологии Тип: хордовые. Подтипы: бесчерепные и черепные, позвоночные
Тип: хордовые. Подтипы: бесчерепные и черепные, позвоночные Генетический код
Генетический код Зәр шығару жүйесі
Зәр шығару жүйесі Комнатные растения
Комнатные растения Насекомые
Насекомые Отруйні та їстівні гриби
Отруйні та їстівні гриби Виртуальная экскурсия в Московский зоопарк
Виртуальная экскурсия в Московский зоопарк Эти загадочные динозавры
Эти загадочные динозавры Биология как наука. Экосистемы. Факультатив по биологии 10 -11 классы
Биология как наука. Экосистемы. Факультатив по биологии 10 -11 классы Зоология – наука о животных
Зоология – наука о животных Движение в организме. Органы кровообращения
Движение в организме. Органы кровообращения Корень. Значение корня. Виды корней. Корневые системы. Микроскопическое строение корня. Зоны корня. Корневой волосок
Корень. Значение корня. Виды корней. Корневые системы. Микроскопическое строение корня. Зоны корня. Корневой волосок Чихуахуа
Чихуахуа Петуния. Выращивание и уход за петунией
Петуния. Выращивание и уход за петунией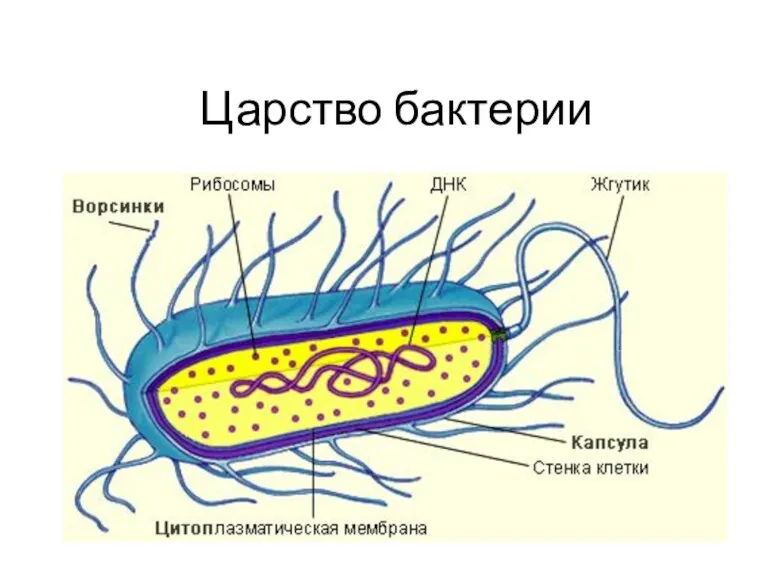 Царство Бактерии. 6 класс
Царство Бактерии. 6 класс Модификационная изменчивость
Модификационная изменчивость Класс Земноводные
Класс Земноводные Тип Хордовые.Ланцетник. 7 кл.
Тип Хордовые.Ланцетник. 7 кл. Травы и цветы полей и лугов
Травы и цветы полей и лугов газообмен в легких
газообмен в легких