Содержание
- 2. Редактирование генома – это внесение направленных изменений в геном непосредственно в живой клетке. Такой биоинженерный подход
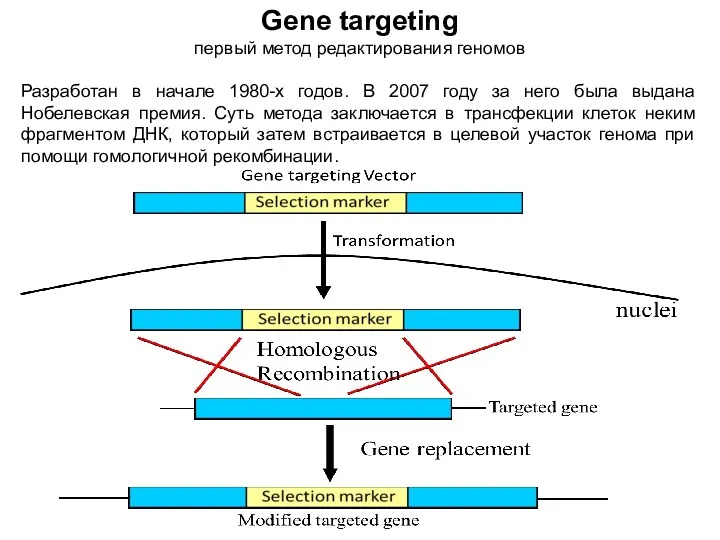
- 3. Gene targeting первый метод редактирования геномов Разработан в начале 1980-х годов. В 2007 году за него
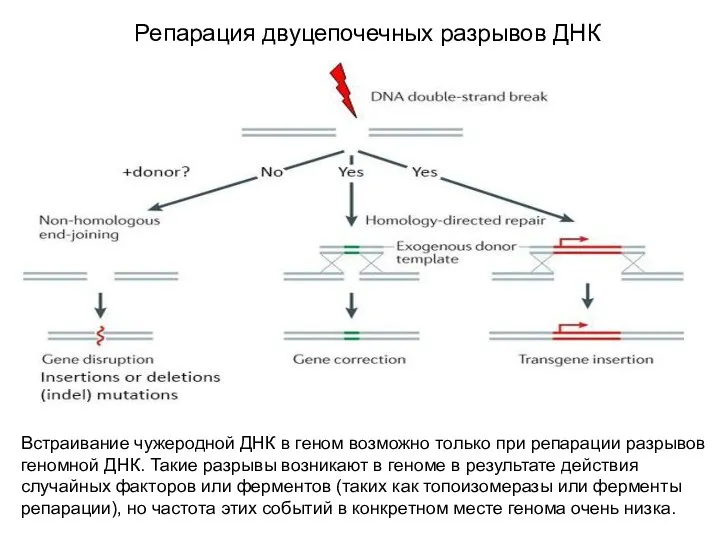
- 4. Репарация двуцепочечных разрывов ДНК Встраивание чужеродной ДНК в геном возможно только при репарации разрывов геномной ДНК.
- 5. Gene targeting Как и любой пионерский метод, он поначалу был не очень удачен. Две его основные
- 6. Gene targeting Дрожжи – организм, которому плевать на проблемы жалких высших эукариот! Эффективность гомологичной рекомбинации у
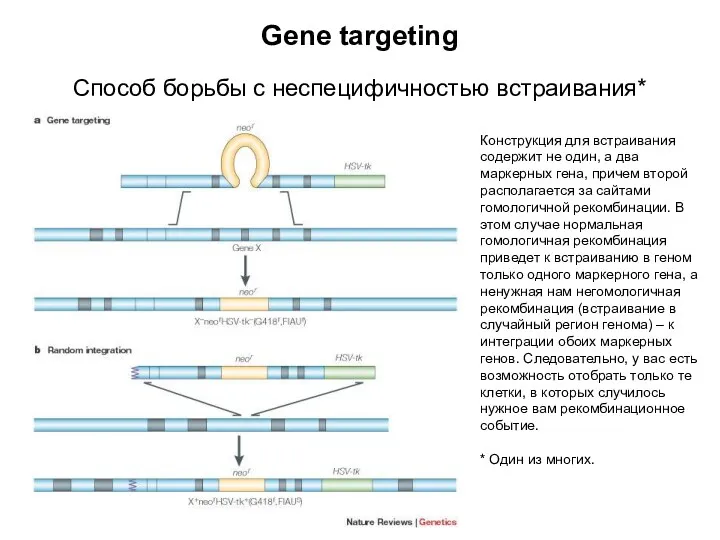
- 7. Gene targeting Способ борьбы с неспецифичностью встраивания* Конструкция для встраивания содержит не один, а два маркерных
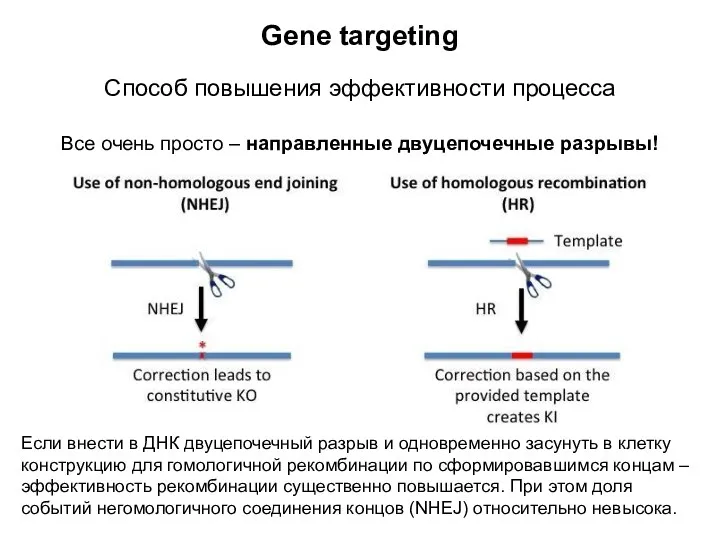
- 8. Gene targeting Способ повышения эффективности процесса Все очень просто – направленные двуцепочечные разрывы! Если внести в
- 9. Это всё просто великолепно, но есть одна проблема: Как внести двуцепочечный разрыв ровно в то место
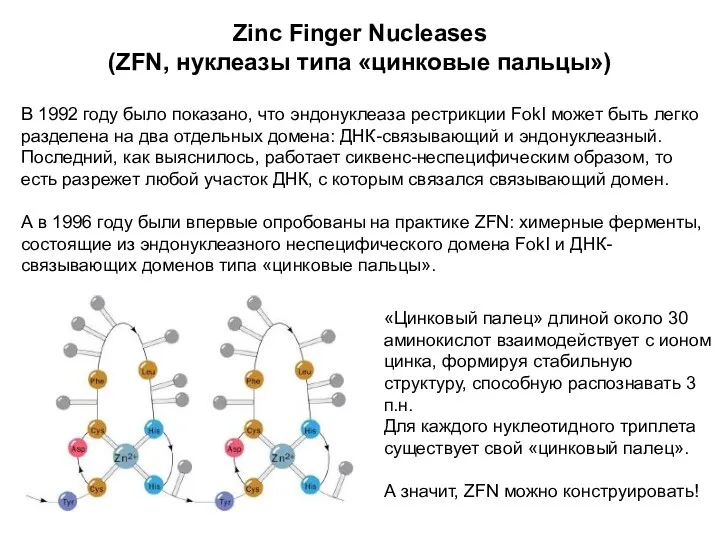
- 10. Zinc Finger Nucleases (ZFN, нуклеазы типа «цинковые пальцы») В 1992 году было показано, что эндонуклеаза рестрикции
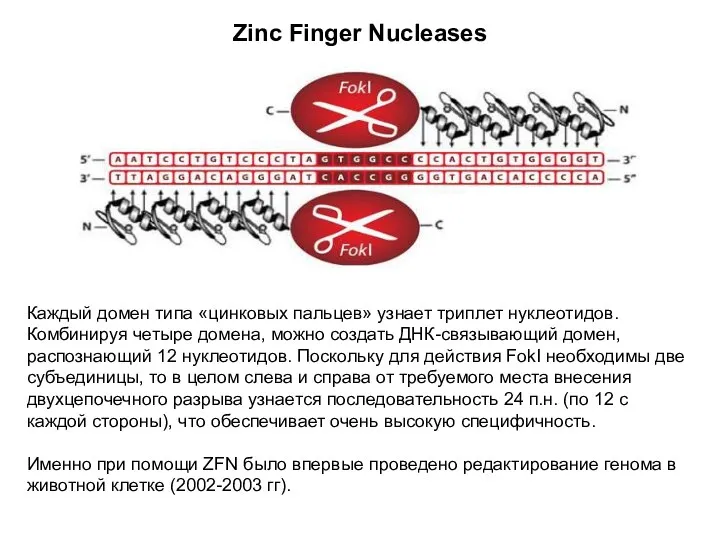
- 11. Zinc Finger Nucleases Каждый домен типа «цинковых пальцев» узнает триплет нуклеотидов. Комбинируя четыре домена, можно создать
- 12. Zinc Finger Nucleases В ноябре 2017 года в США впервые в мире отредактировали геном живого взрослого
- 13. Zinc Finger Nucleases Недостатки: Относительная дороговизна и сложность процесса конструирования. Неидеальная специфичность. Некоторые ZFN способны связываться
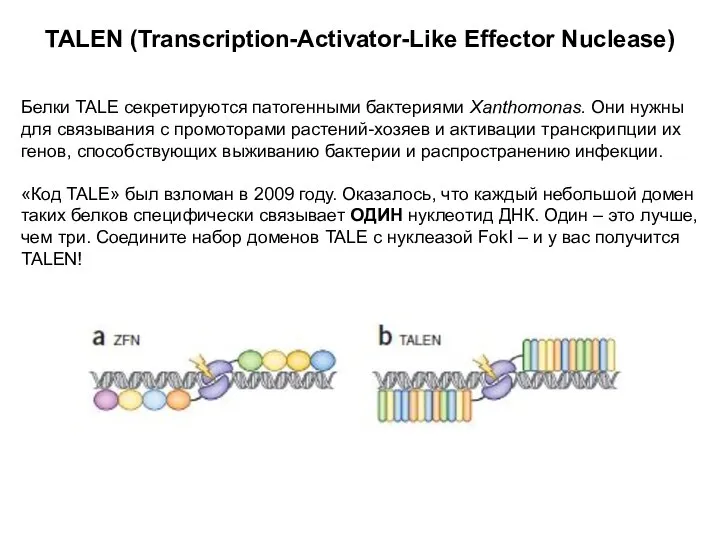
- 14. TALEN (Transcription-Activator-Like Effector Nuclease) Белки TALE секретируются патогенными бактериями Xanthomonas. Они нужны для связывания с промоторами
- 15. Можно сконструировать практически на любую последовательность в геноме Более эффективны, выше уровень трансгенеза Уровень неспецифической активности
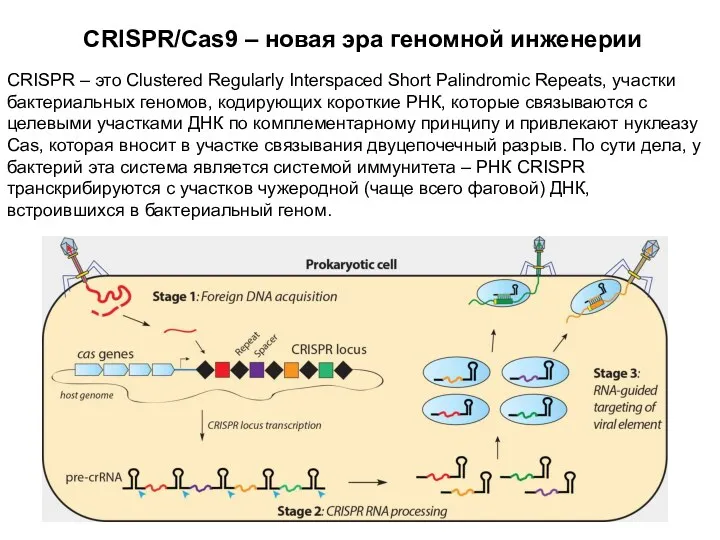
- 16. CRISPR/Cas9 – новая эра геномной инженерии CRISPR – это Clustered Regularly Interspaced Short Palindromic Repeats, участки
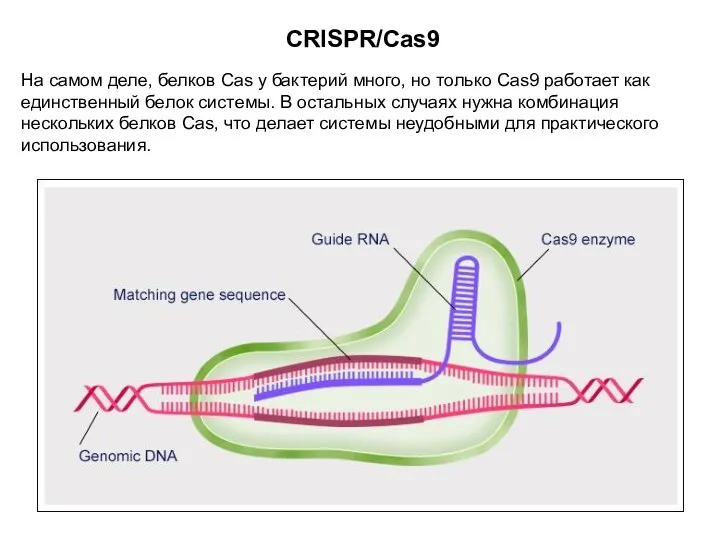
- 17. CRISPR/Cas9 На самом деле, белков Cas у бактерий много, но только Cas9 работает как единственный белок
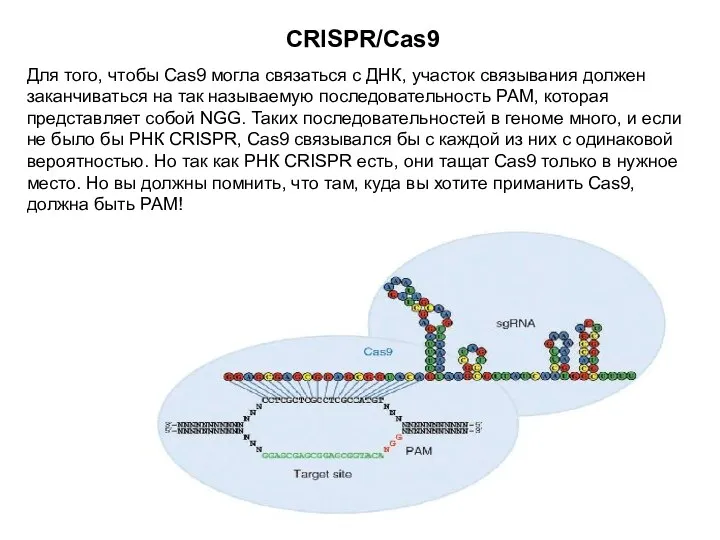
- 18. CRISPR/Cas9 Для того, чтобы Cas9 могла связаться с ДНК, участок связывания должен заканчиваться на так называемую
- 19. CRISPR/Cas9 Главное преимущество метода: В качестве ДНК-узнающих элементов используются не белки, как в ZFN и TALEN,
- 20. CRISPR/Cas9 И все считают, что за этой системой будущее биоинженерии и науки вообще. И я тоже
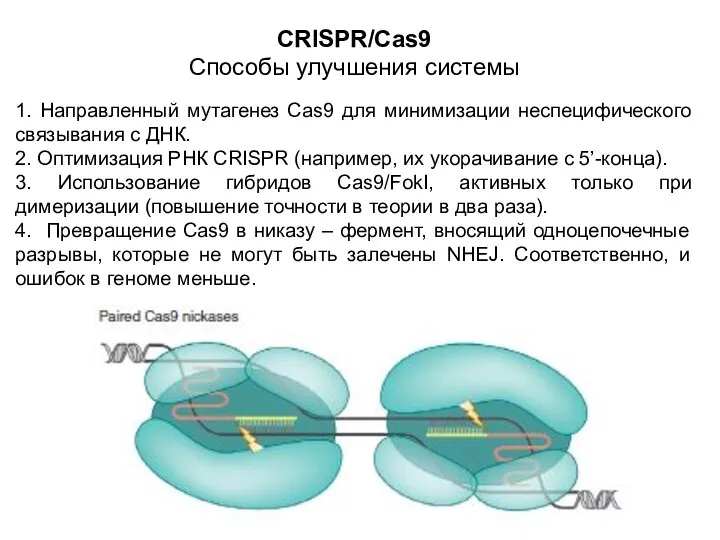
- 21. CRISPR/Cas9 Способы улучшения системы 1. Направленный мутагенез Cas9 для минимизации неспецифического связывания с ДНК. 2. Оптимизация
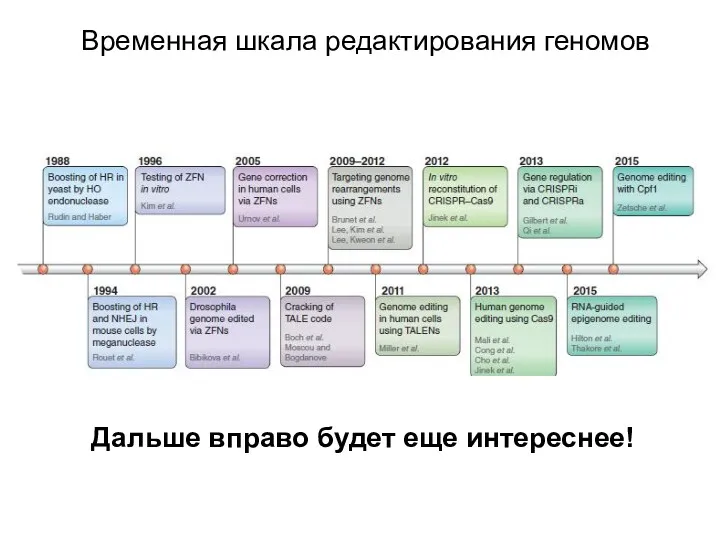
- 22. Временная шкала редактирования геномов Дальше вправо будет еще интереснее!
- 24. Скачать презентацию









 Презентация по теме Витамины
Презентация по теме Витамины Протеиновое питание
Протеиновое питание Слух. Среднее и внутреннее ухо. Функции среднего уха. Строение улитки
Слух. Среднее и внутреннее ухо. Функции среднего уха. Строение улитки Молекулярная биология
Молекулярная биология Презентация Выделение у растений
Презентация Выделение у растений История эволюционных идей
История эволюционных идей Законы раздражения. Нервно-мышечный синапс. Парабиоз, его фазы
Законы раздражения. Нервно-мышечный синапс. Парабиоз, его фазы урок презентация Многообразие покрытосеменных растений
урок презентация Многообразие покрытосеменных растений ЕГЭ по биологии. Работа с рисунками
ЕГЭ по биологии. Работа с рисунками Представители парнокопытных
Представители парнокопытных Тип хордовые
Тип хордовые Опасные животные
Опасные животные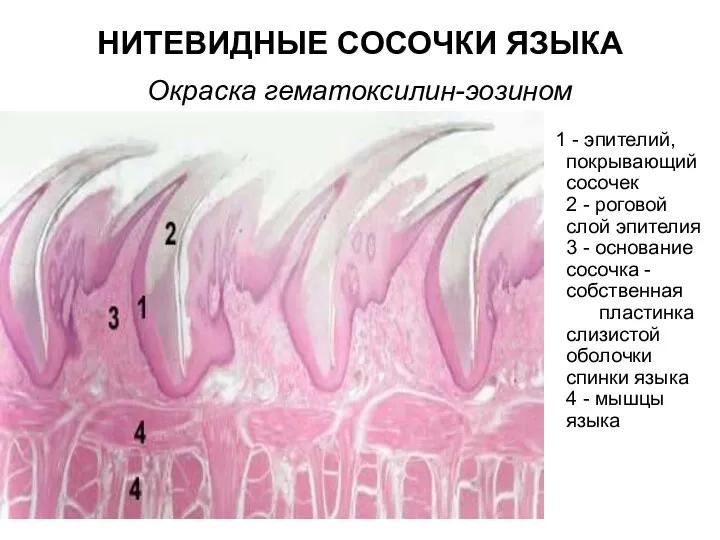 Нитевидные сосочки языка. Окраска гематоксилин-эозином
Нитевидные сосочки языка. Окраска гематоксилин-эозином ОПРЕДЕЛЕНИЕ ХРОНОБИОТИПА УЧАЩИХСЯ
ОПРЕДЕЛЕНИЕ ХРОНОБИОТИПА УЧАЩИХСЯ Общая характеристика и многообразие моллюсков
Общая характеристика и многообразие моллюсков Ч. Дарвин эволюциялық теорияның негізін салушы
Ч. Дарвин эволюциялық теорияның негізін салушы Мутационная изменчивость
Мутационная изменчивость Diencephalon. Структуры промежуточного мозга
Diencephalon. Структуры промежуточного мозга Физиология высшей нервной деятельности. Формирование поведения в онтогенезе
Физиология высшей нервной деятельности. Формирование поведения в онтогенезе Презентация к уроку биологии 8 класс на тему: Общая характеристика млекопитающих
Презентация к уроку биологии 8 класс на тему: Общая характеристика млекопитающих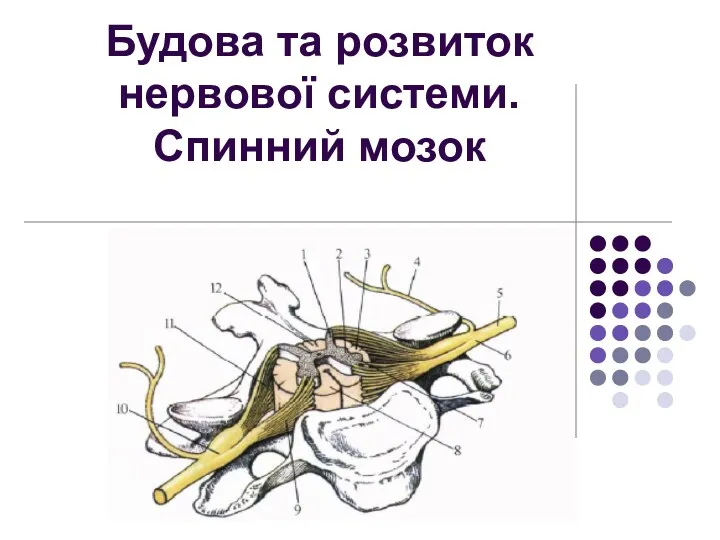 Будова та розвиток нервової системи. Спинний мозок
Будова та розвиток нервової системи. Спинний мозок Ядовитые и опасные растения
Ядовитые и опасные растения Микробы в доме
Микробы в доме Физиология микроорганизмов. (Лекция 3)
Физиология микроорганизмов. (Лекция 3) Особенности метаболизма микроорганизмов, используемые при биодеградации
Особенности метаболизма микроорганизмов, используемые при биодеградации Строение центральной нервной системы человека
Строение центральной нервной системы человека Тестирование по теме Цветок. Соцветие
Тестирование по теме Цветок. Соцветие Бионика. Виды бионики
Бионика. Виды бионики