Содержание
- 2. Содержание ВЕДЕНИЕ. РЕДОКС-СТАТУС КЛЕТКИ. АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК) Синглетный кислород Пероксид водорода Супероксид-анион радикал Гидроксил-радикал ОКИСЛИТЕЛЬНЫЙ
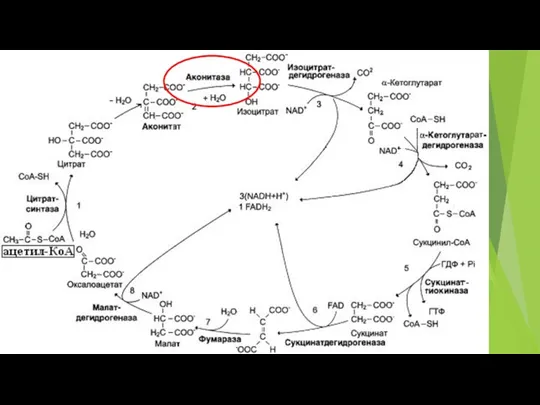
- 3. МИТОХОНДРИИ, ИХ СТРОЕНИЕ И ФУНКЦИИ. ЦИКЛ КРЕБСА, ЭТЦ И АФК. НАНАDНАD(Р)Н-ОКСИДАЗА (NOX4) Моноаминооксидаза Ацил-СоА дегидрогеназа Дыхательный
- 4. Аэробная энергетика: Реакция между восстановителем и окислителем – кислородом редокс- потенциал кислорода при нейтральных значениях рН
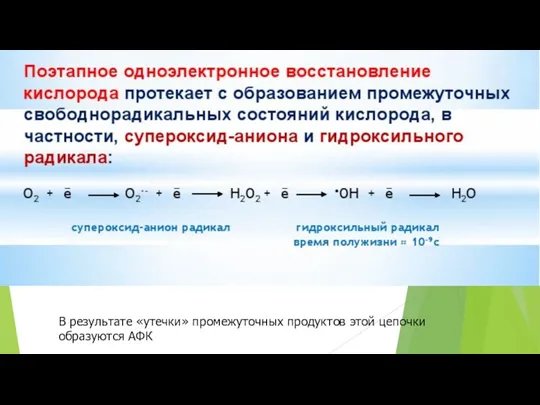
- 5. Молекулярный кислород имеет спиновый запрет, поэтому Он относительно инертен Гланый биологический окислитель Одноэлектронное поэтапное ферментативное восстановление
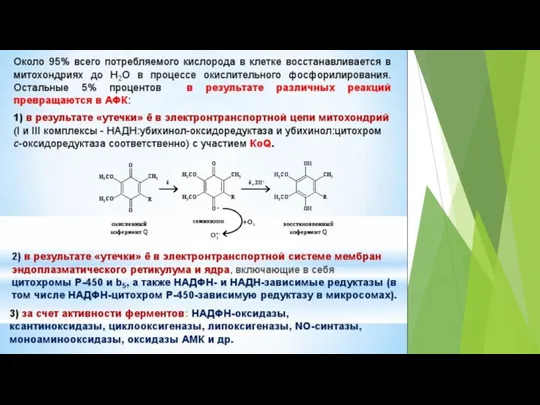
- 6. В результате «утечки» промежуточных продуктов этой цепочки образуются АФК
- 7. Рис. 1. Диаграмма основных реакций с участием кислорода. Правая и левая вертикальные линии - шкалы стандартных
- 8. Избыток АФК нарушают редокс-статус клетки, начинается окислительный стресс
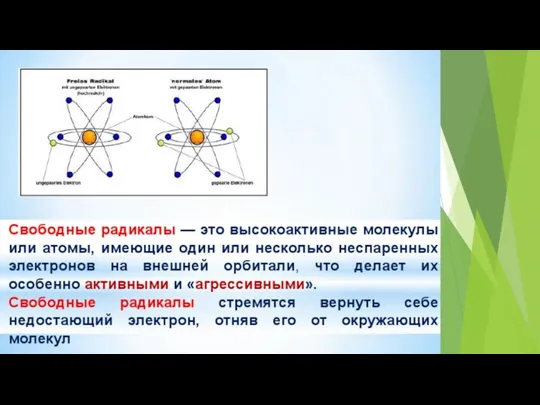
- 9. Активные формы кислорода (англ. ROS, Reactive Oxygen Species) – это высокореакционные, преимущественно радикальные кислородные соединения, образующиеся
- 12. Основные свойства АФК: высокая реакционная способность, короткое время жизни, малый или относительно малый радиус диффузии относительно
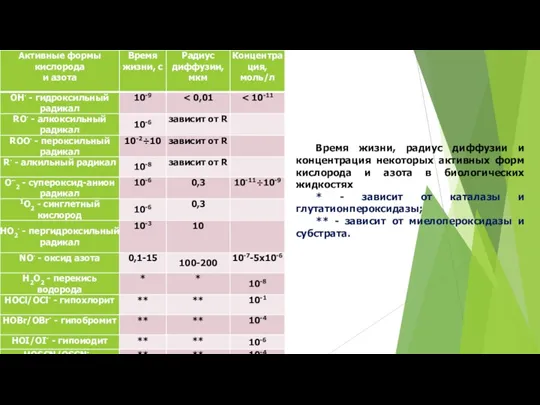
- 13. Время жизни, радиус диффузии и концентрация некоторых активных форм кислорода и азота в биологических жидкостях *
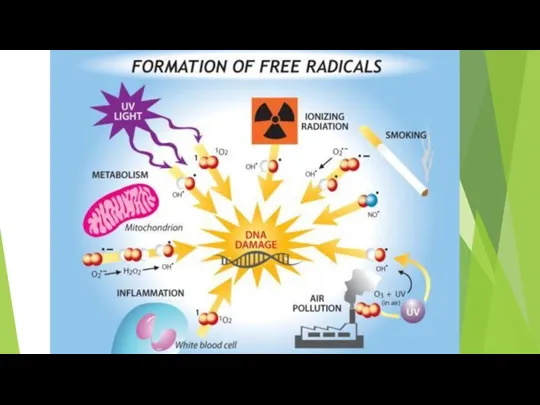
- 15. Источники АФК
- 16. Синглетный кислород 1O2 молекурный кислород в состоянии наименьшего электронного возбуждения (изменение спина одного из электронов, находящихся
- 17. Рис.1. Схема молекулярных орбиталей молекулы кислорода в основном (а) и двух возбужденных состояниях (б) и (в).
- 18. Пероксид водорода Н2О2 субстрат-окислитель для пероксидаз восстановитель и окислитель в реакции дисмутации (каталаза) взаимодействует с веществами
- 19. Супероксид-анион радикал О2-• Источник - ионы металлов переменной валентности и (или) органические соединений, способных к одноэлектронным
- 20. Гидроксил-радикал Результат одноэлектронного восстановления перекиси водорода супероксид-радикал в реакции, катализируемой металлами переменной валентности (Fe2+, Cu+, Co2+,
- 21. является наиболее реакционноспособным радикалом среди АФК Основные типы повреждений биомолекул гидроксильными радикалами - это отрыв атома
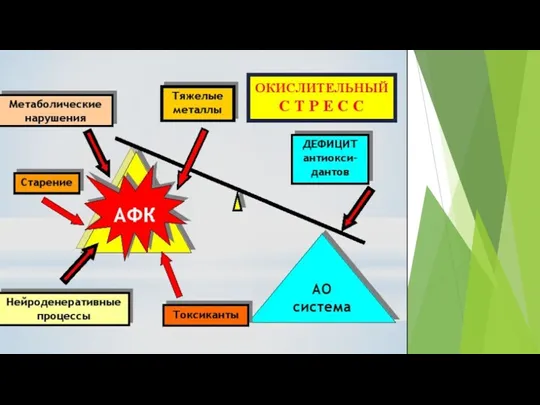
- 23. Избыточную генерацию АФК свыше уровня антиоксидантной защиты, сопровождающуюся повреждением клеточного содержимого, называют окислительным стрессом 1. Низкий
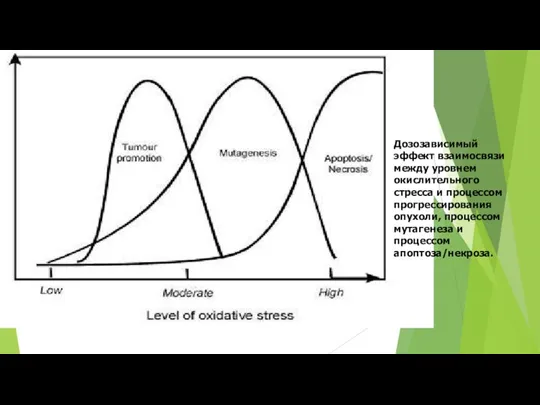
- 24. Дозозависимый эффект взаимосвязи между уровнем окислительного стресса и процессом прогрессирования опухоли, процессом мутагенеза и процессом апоптоза/некроза.
- 26. Избыточную генерацию АФК свыше уровня антиоксидантной защиты, сопровождающуюся повреждением клеточного содержимого, называют окислительным стрессом.
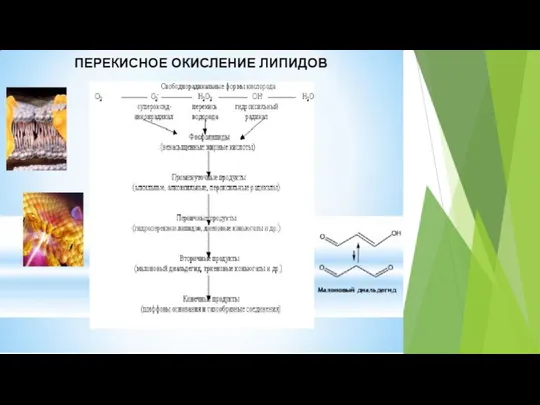
- 28. Окислительный стресс характеризуется тремя основными процессами: окислительная модификация липидов; окислительная модификация белков; окислительная модификация нуклеиновых кислот.
- 30. В процессе ПОЛ различают несколько этапов: 1. Атака сопряженных двойных связей ненасыщенных жирных кислот со стороны
- 33. Окислительная модификация белков Количественно, белки более повреждаемая мишень, чем ДНК и липиды, они являются главной мишенью
- 34. Взаимодействие пептидов и белков с АФК состоит из следующих ключевых реакций: RCHR1R2 + HO∙ → RC∙R1R2
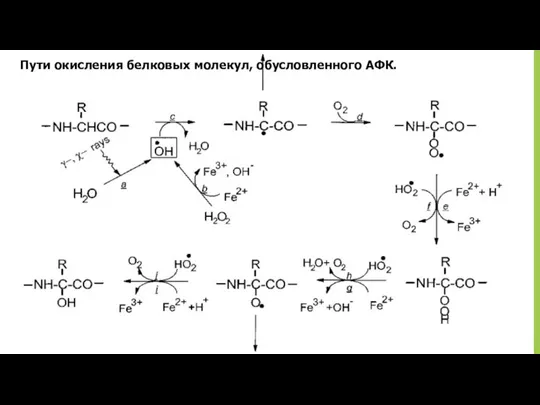
- 35. Пути окисления белковых молекул, обусловленного АФК.
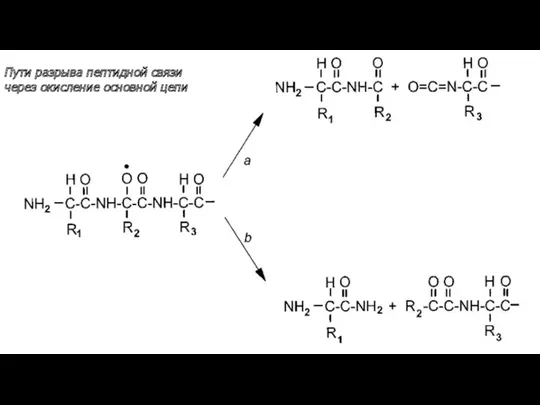
- 36. Пути разрыва пептидной связи через окисление основной цепи
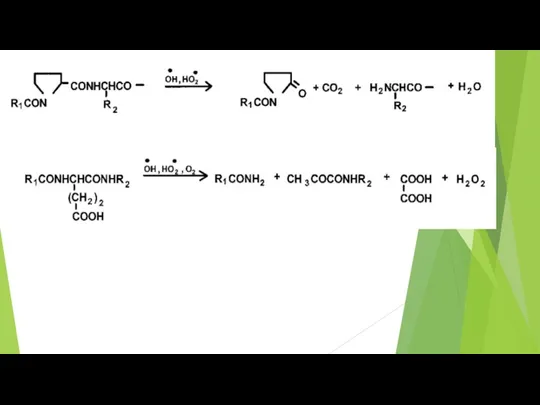
- 37. Продукты окислительной модификации остатков наиболее окисляемых аминокислот
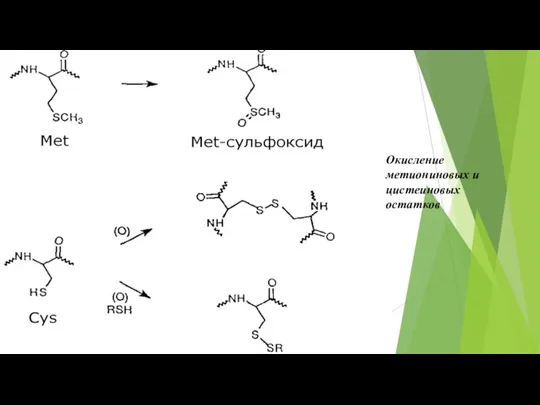
- 39. Окисление метиониновых и цистеиновых остатков
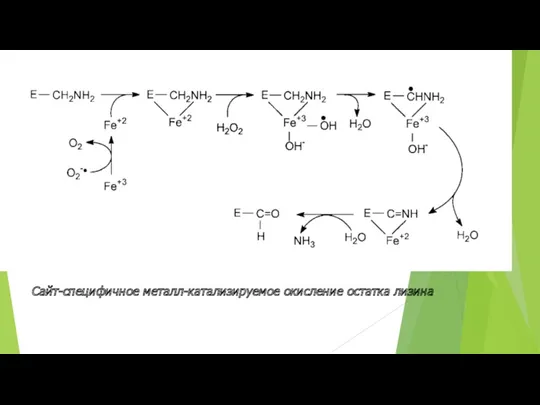
- 40. Сайт-специфичное металл-катализируемое окисление остатка лизина
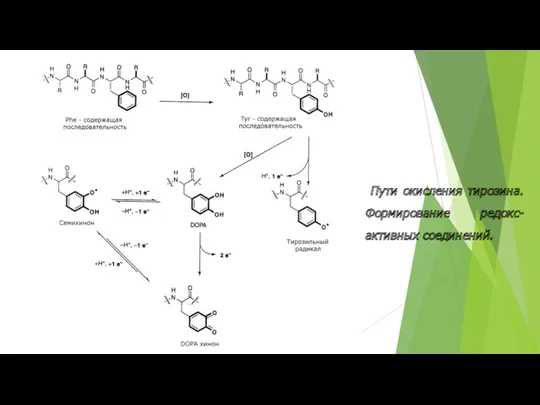
- 41. Пути окисления тирозина. Формирование редокс-активных соединений.
- 42. Образование карбонильных групп в реакциях гликирования и взаимодействия с продуктами ПОЛ. А- реакция соединения сахаров с
- 43. Долгоживущие радикалы белка ДЖРБ долгоживущие активные формы белков (ДАФБ) Времена полужизни ДЖРБ достигают свыше 20 ч.
- 44. Окислительная модификация нуклеиновых кислот. Повреждение ДНК. нарушения в хранении и реализации генетического материала связывают с развитием
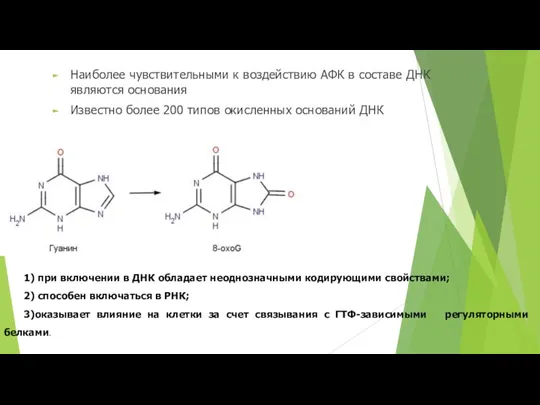
- 45. Наиболее чувствительными к воздействию АФК в составе ДНК являются основания Известно более 200 типов окисленных оснований
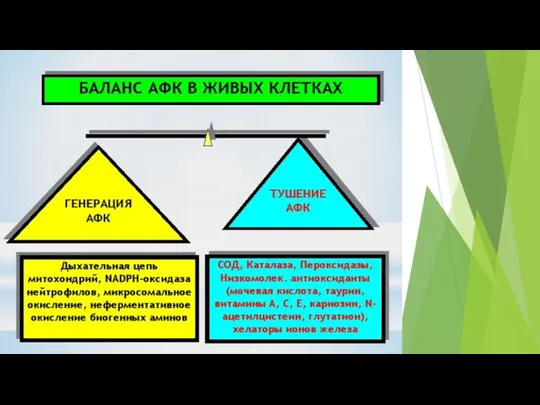
- 46. Окислительный стресс – это нарушение сбалансированности антиоксидантной и прооксидантной системы
- 48. Исторически термин редокс-состояние (redox-state) используется для описания соотношения взаимоконвертируемой окисленной и восстановленной формы специфической редокс-пары. Для
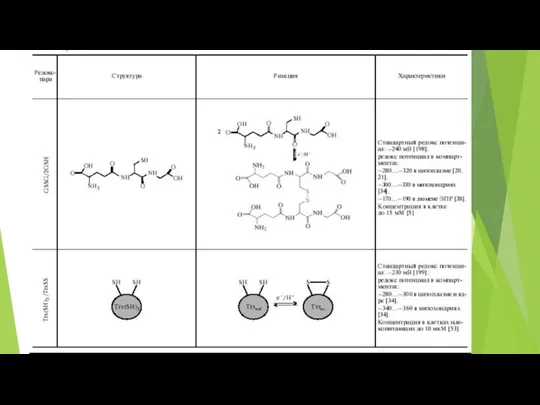
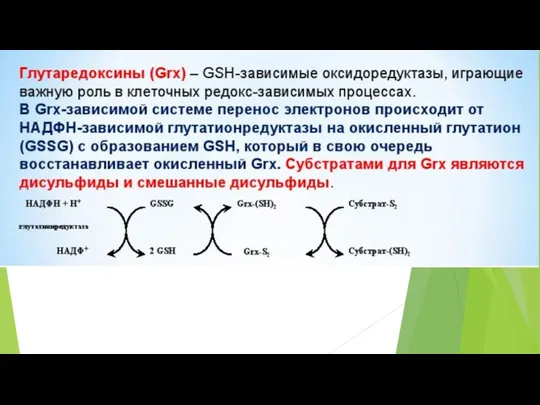
- 50. Основные редокс-пары клетки Соединения, существующие одновременно в окисленном и восстановленном состояниях, причем переход из одного состояния
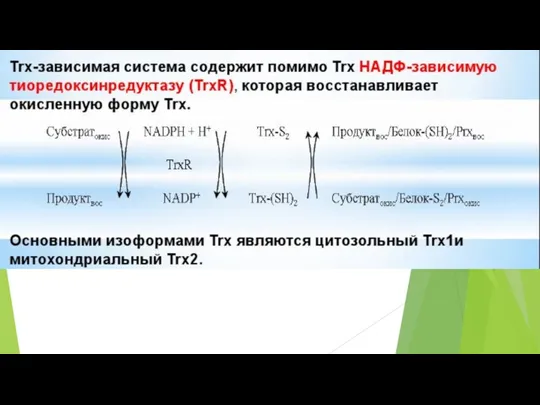
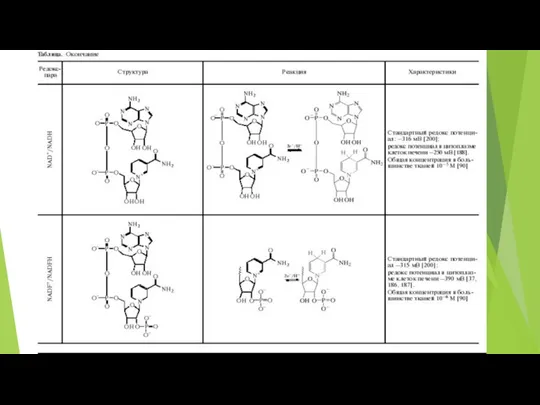
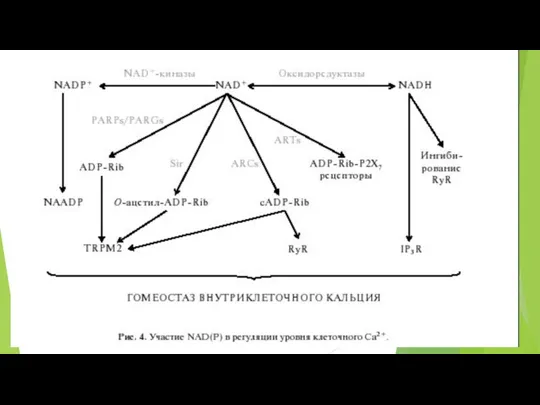
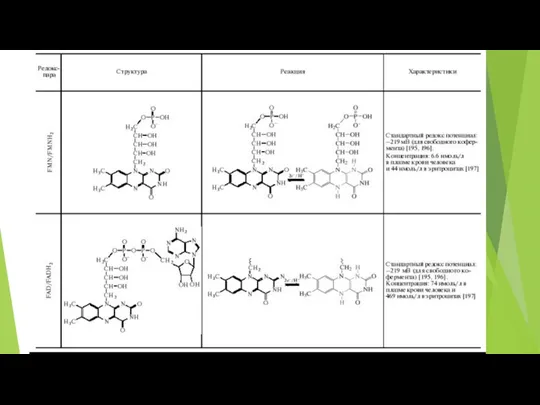
- 59. NAD+ и NADH Для большинства тканей общая концентрация NAD+ и NADH составляет примерно 10-5 М В
- 60. Ключевым ферментом синтеза NAD, независимо от того, по какому пути он протекает, является никотинамидмононуклеотид-аденилилтрансфераза (NMNAT). NMNAT
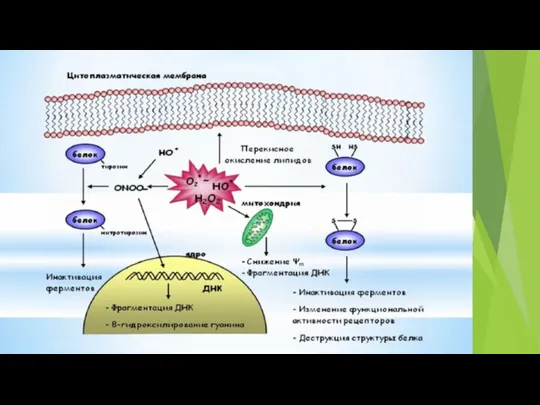
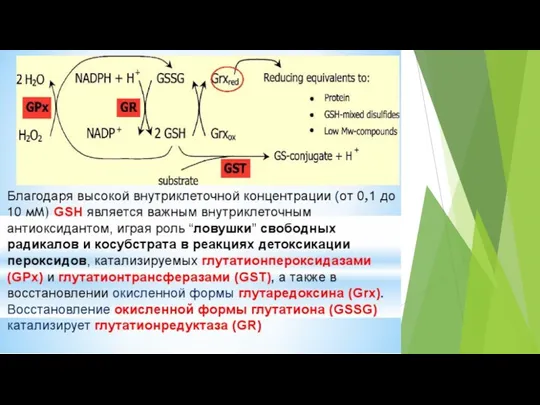
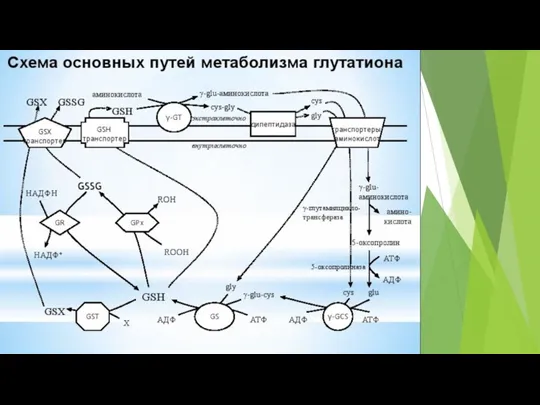
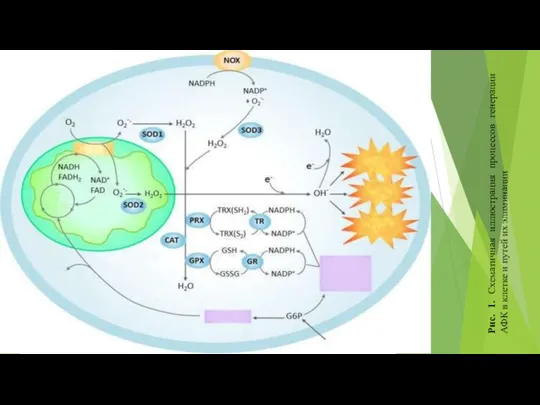
- 65. Рис. 1. Схематичная иллюстрация процессов генерации АФК в клетке и путей их элиминации
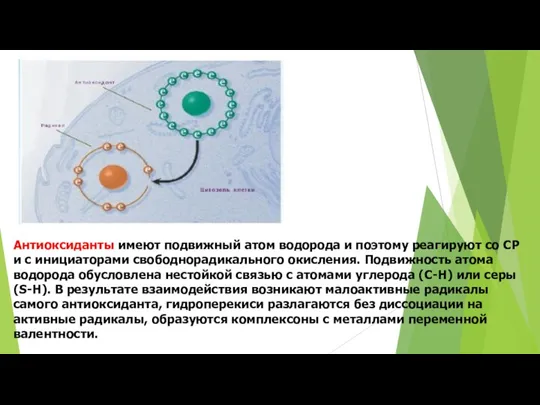
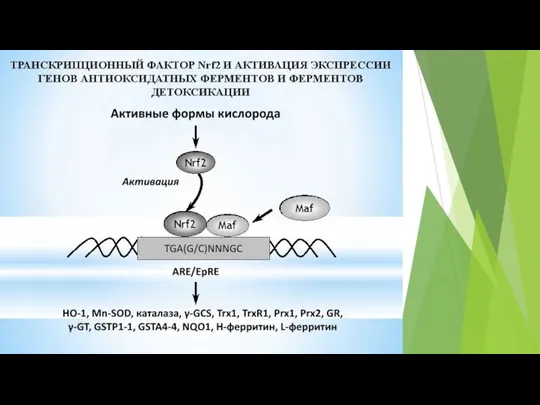
- 67. Антиоксиданты имеют подвижный атом водорода и поэтому реагируют со СР и с инициаторами свободнорадикального окисления. Подвижность
- 69. Низкомолекулярные антиоксиданты фенолы полифенолы (токоферолы, эвгенол, конидендрин, пирокатехин, производные галловой кислоты) флавоноиды (рутин, кверцетин) стероидные гормоны
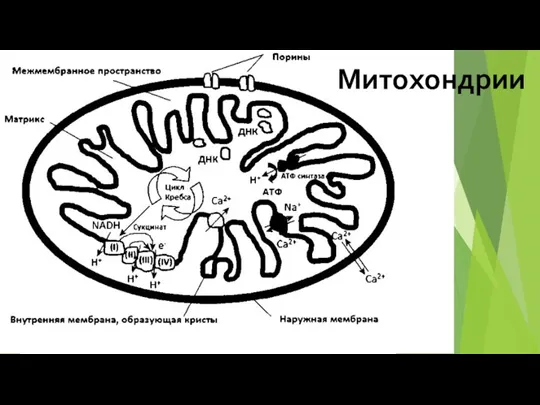
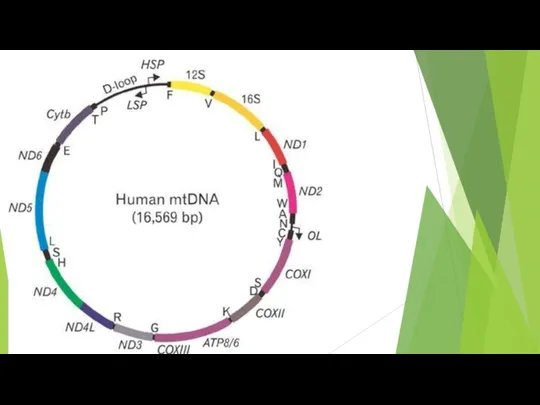
- 70. Митохондрии
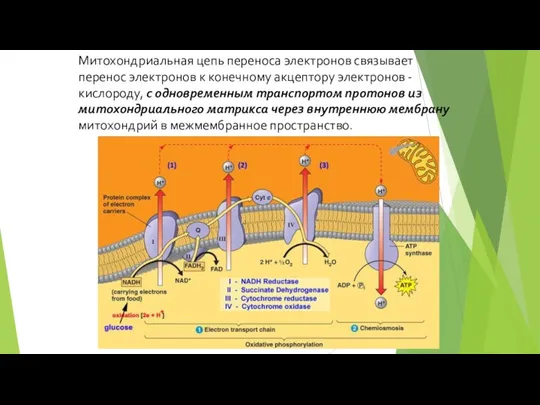
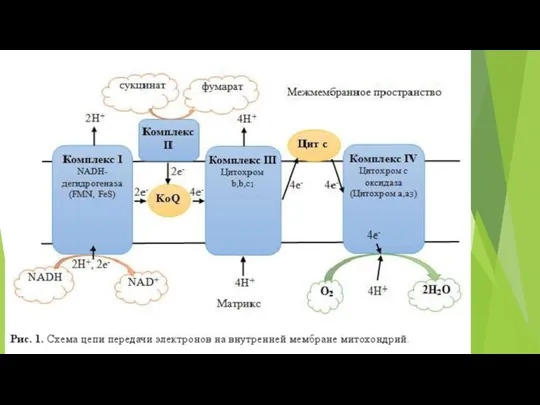
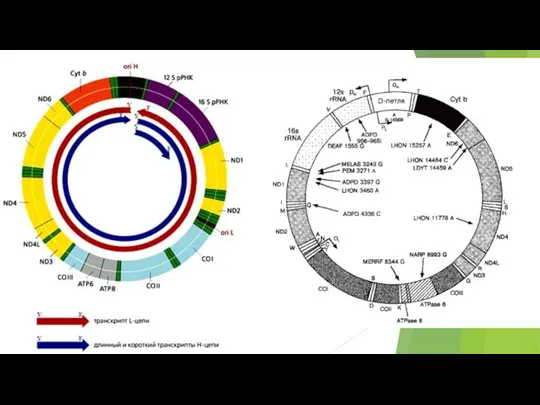
- 72. Митохондриальная цепь переноса электронов связывает перенос электронов к конечному акцептору электронов - кислороду, с одновременным транспортом
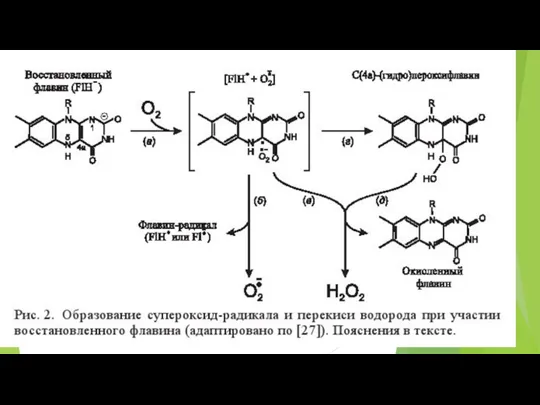
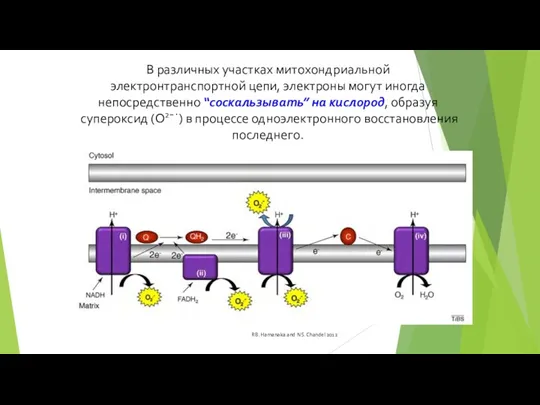
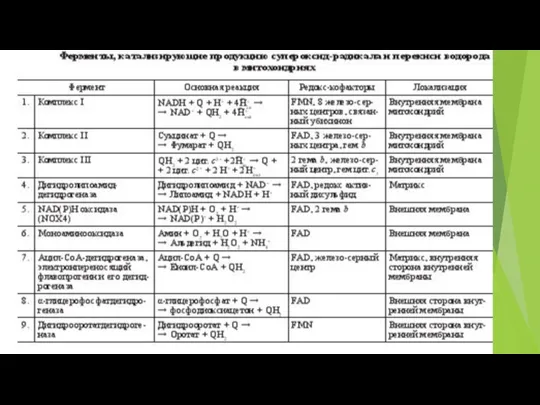
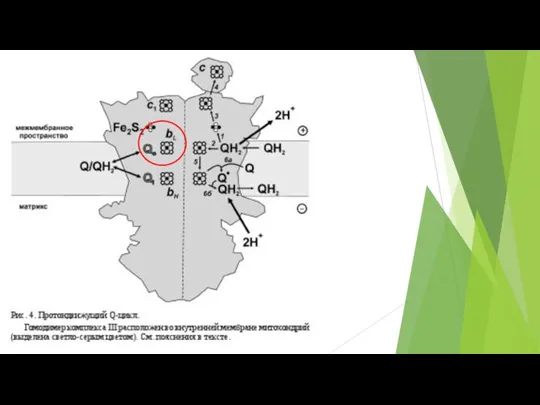
- 73. В различных участках митохондриальной электронтранспортной цепи, электроны могут иногда непосредственно “соскальзывать” на кислород, образуя супероксид (O2¯˙)
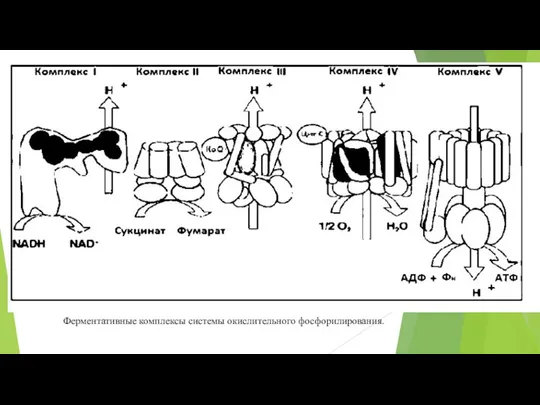
- 74. Ферментативные комплексы системы окислительного фосфорилирования.
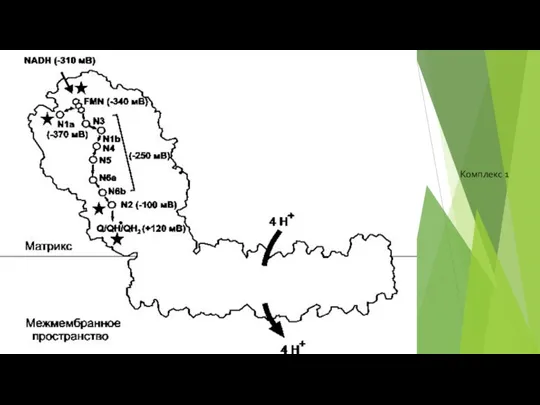
- 79. Комплекс 1
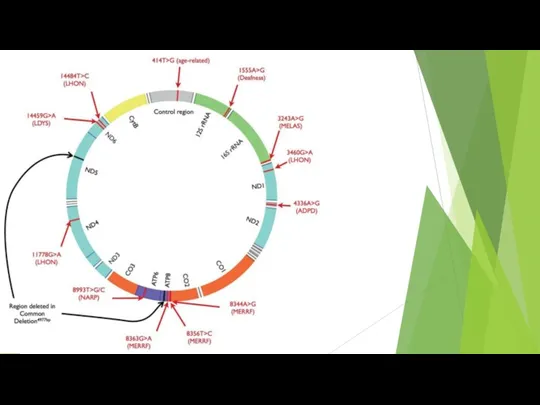
- 85. Митохондриальная свободнорадикальная теория старения Предполагается, что интенсификация утечки электронов из электрон-транспортной системы митохондрий с возрастом, способствует
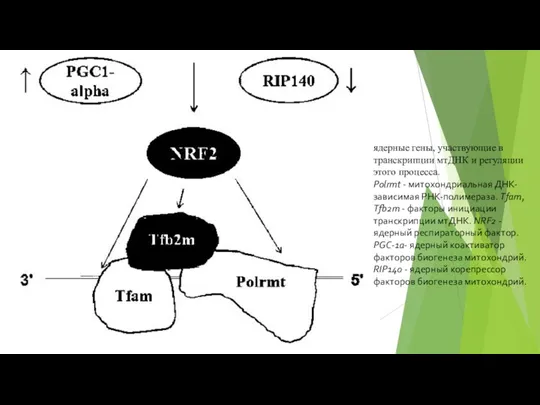
- 86. ядерные гены, участвующие в транскрипции мтДНК и регуляции этого процесса. Polrmt - митохондриальная ДНК-зависимая РНК-полимераза. Tfam,
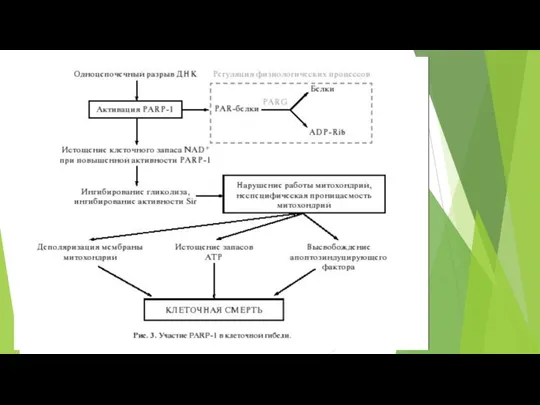
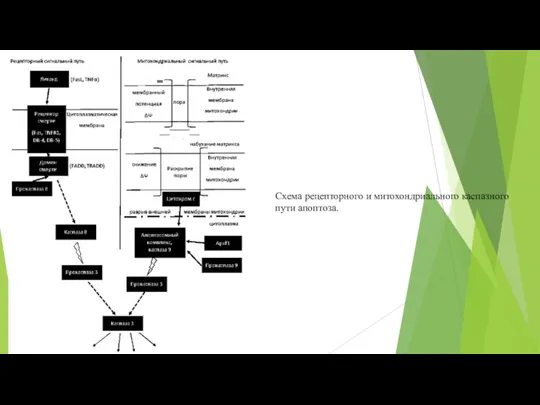
- 88. Схема рецепторного и митохондриального каспазного пути апоптоза.
- 91. Источники Гармаш С. А. Образование активных форм кислорода под влиянием ионов уранила и их токсическое действие:
- 95. Скачать презентацию
















































 Окраска плодов декоративных деревьев и кустарников
Окраска плодов декоративных деревьев и кустарников Презентация к уроку Круглые черви 7 класс
Презентация к уроку Круглые черви 7 класс Индивидуальное развитие. Биогенетический закон
Индивидуальное развитие. Биогенетический закон Урок по биологии в 5 классе Жизнь в мировом океане
Урок по биологии в 5 классе Жизнь в мировом океане Биология-наука о живой природе. Значение растений в природе, народном хозяйстве и жизни человека
Биология-наука о живой природе. Значение растений в природе, народном хозяйстве и жизни человека Пингвин – необычная птица
Пингвин – необычная птица Разработка урока для 8 класса Пищеварение в ротовой полости
Разработка урока для 8 класса Пищеварение в ротовой полости Викторина. Тема Птицы.
Викторина. Тема Птицы. Растительность Дальнего Востока
Растительность Дальнего Востока Обмен холестерина. Кетоновые тела. Нарушения липидного обмена. Биологические мембраны
Обмен холестерина. Кетоновые тела. Нарушения липидного обмена. Биологические мембраны Происхождение человека (теории происхождения человека)
Происхождение человека (теории происхождения человека) Как питаются разные животные?
Как питаются разные животные? Тип Членистоногие Класс Паукообразные
Тип Членистоногие Класс Паукообразные Интересное о растениях
Интересное о растениях Різноманітність Ссавців (звірів)
Різноманітність Ссавців (звірів) Углубленная биология
Углубленная биология Скелет верхних и нижних конечностей
Скелет верхних и нижних конечностей Организмы царства грибы и лишайники
Организмы царства грибы и лишайники Одноклеточные и многоклеточные организмы. Ткани и органы
Одноклеточные и многоклеточные организмы. Ткани и органы Мітоз та мейоз. Спільне та відмінне
Мітоз та мейоз. Спільне та відмінне Класс ракообразные
Класс ракообразные Экологическая характеристика организмов
Экологическая характеристика организмов Клеточный цикл. Митоз. Апоптоз и некроз клеток
Клеточный цикл. Митоз. Апоптоз и некроз клеток Органоиды клетки
Органоиды клетки Все о тюльпанах
Все о тюльпанах Растениеводство. Научные основы севооборотов и принципы их построения
Растениеводство. Научные основы севооборотов и принципы их построения Нуклеиновые кислоты
Нуклеиновые кислоты Химический состав клетки
Химический состав клетки