Содержание
- 2. С И Н Т Е З Б Е Л К А В К Л Е Т
- 3. Синтез белка в клетке состоит из трех этапов: рекогниция, трансляция - собственно синтеза полипептида на рибосоме,
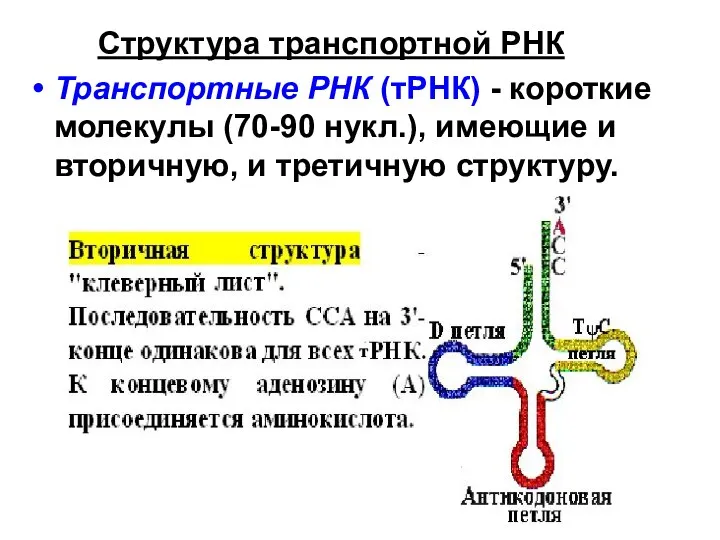
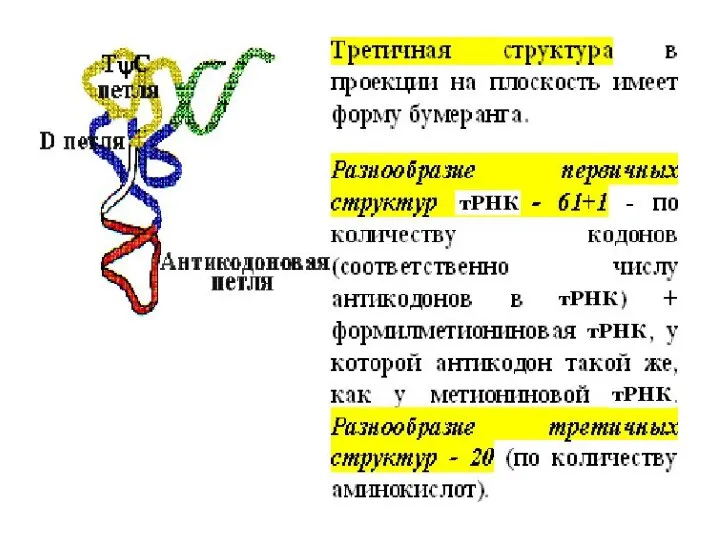
- 4. Структура транспортной РНК Транспортные РНК (тРНК) - короткие молекулы (70-90 нукл.), имеющие и вторичную, и третичную
- 6. Рекогниция Рекогниция - это подготовительный этап трансляции, суть которого в образовании ковалентной связи между тРНК и
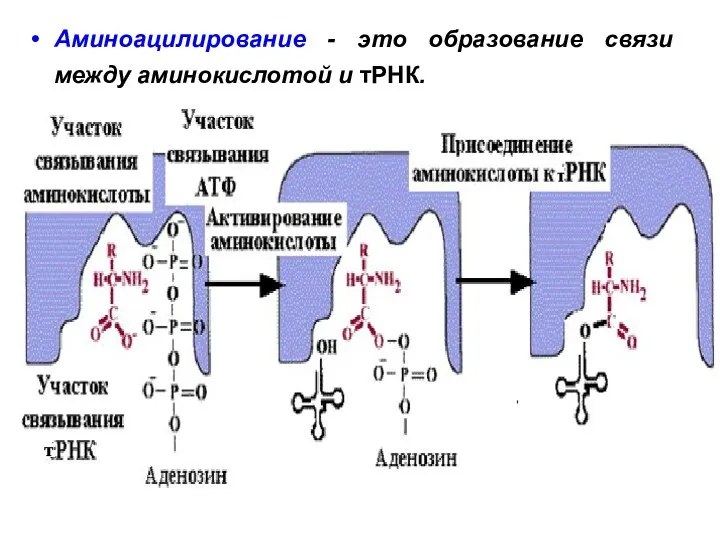
- 7. Аминоацилирование - это образование связи между аминокислотой и тPHК.
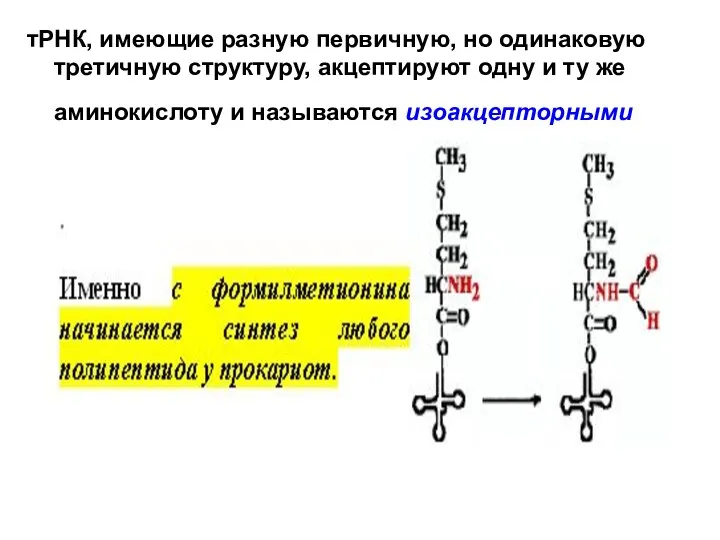
- 8. тРНК, имеющие разную первичную, но одинаковую третичную структуру, акцептируют одну и ту же аминокислоту и называются
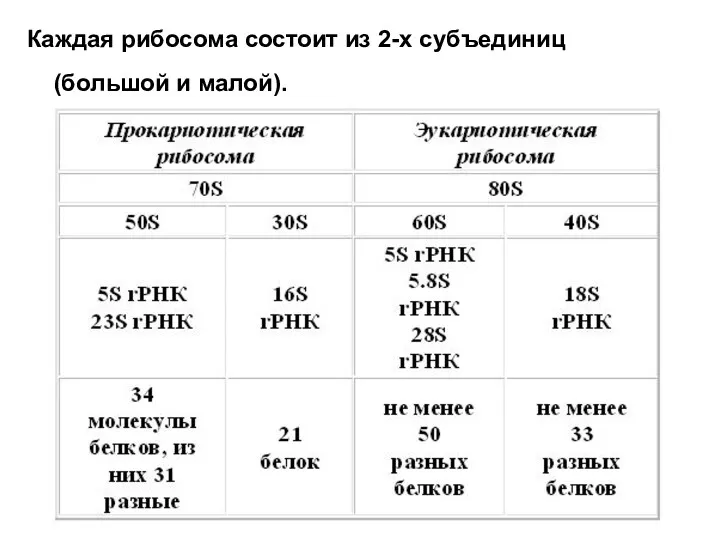
- 9. Структура рибосом Рибосомы - немембранные самые мелкие клеточные органеллы 1. Прокариотические 70S. 2. Эукариотические 80S. 3.
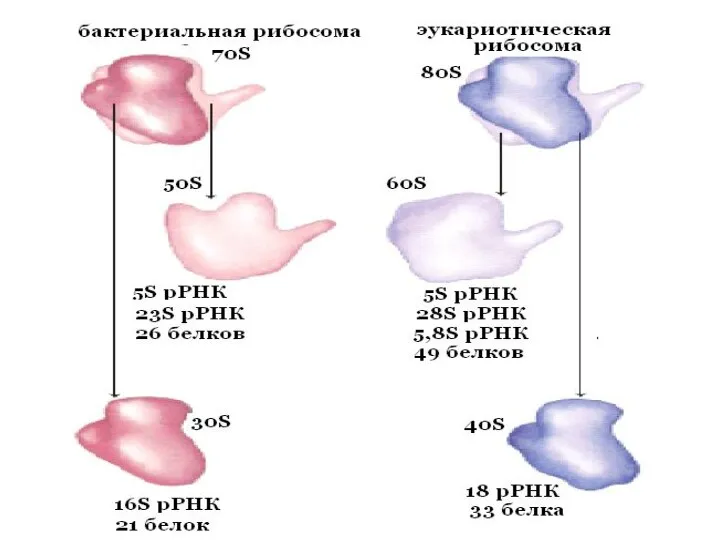
- 10. Каждая рибосома состоит из 2-х субъединиц (большой и малой).
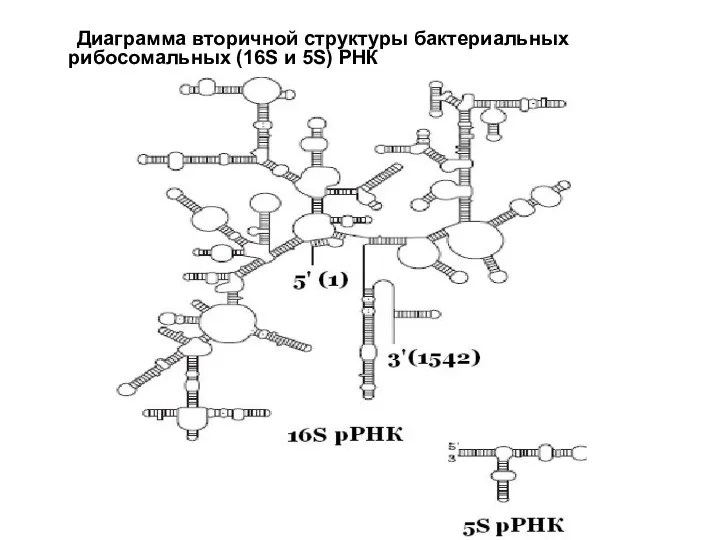
- 12. Диаграмма вторичной структуры бактериальных рибосомальных (16S и 5S) РНК
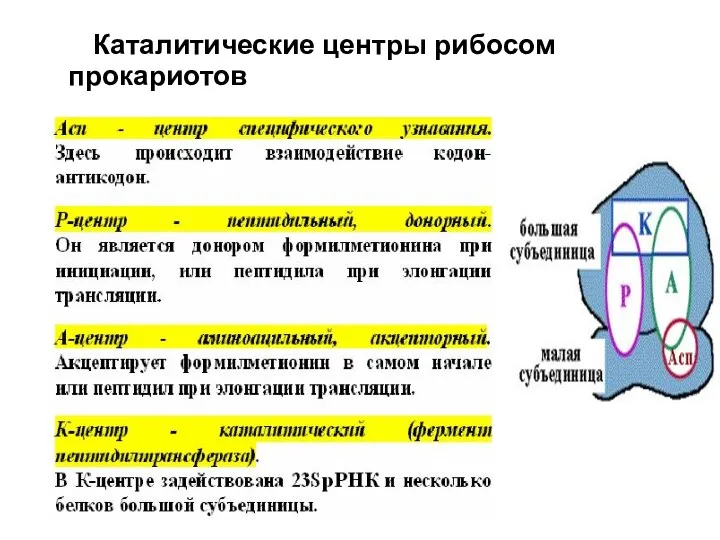
- 13. Каталитические центры рибосом прокариотов
- 14. Синтез полипептидов на рибосоме У прокариот перед каждым геном и соответственно в мРНК перед копией каждого
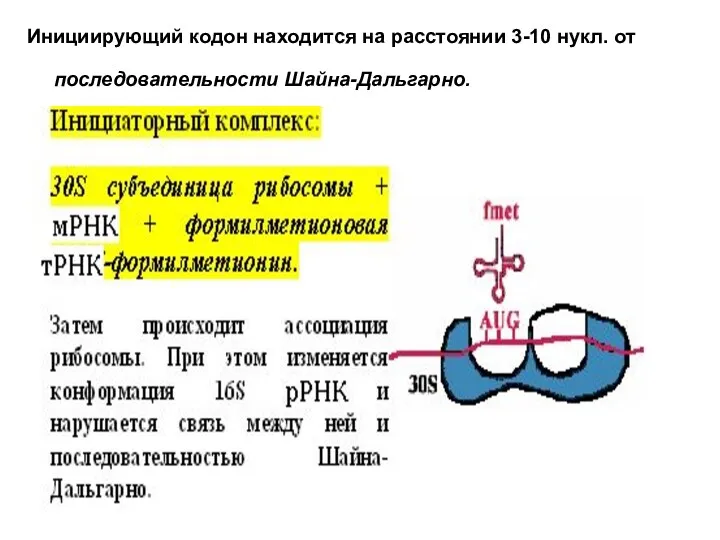
- 15. Инициирующий кодон находится на расстоянии 3-10 нукл. от последовательности Шайна-Дальгарно.
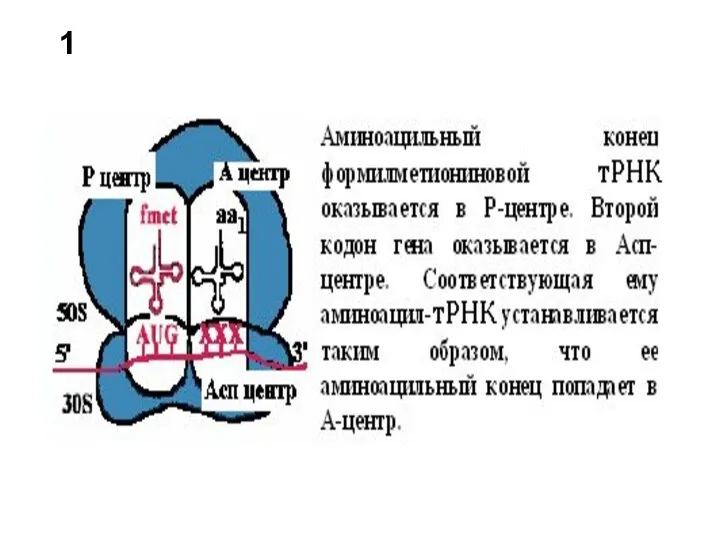
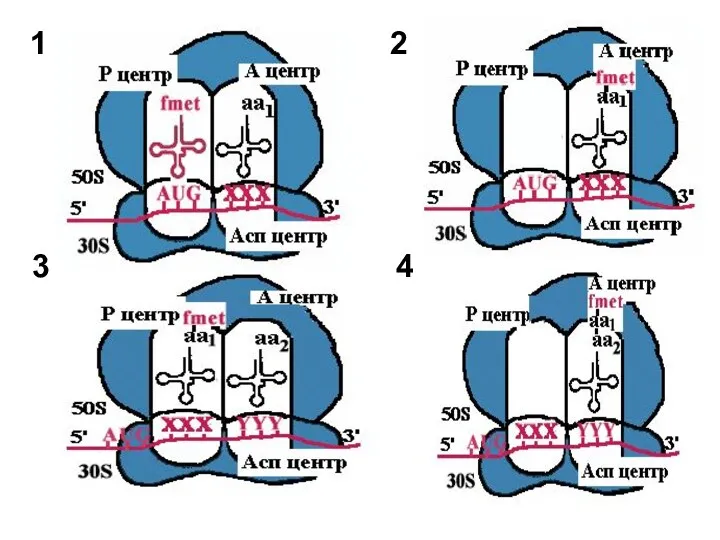
- 16. 1
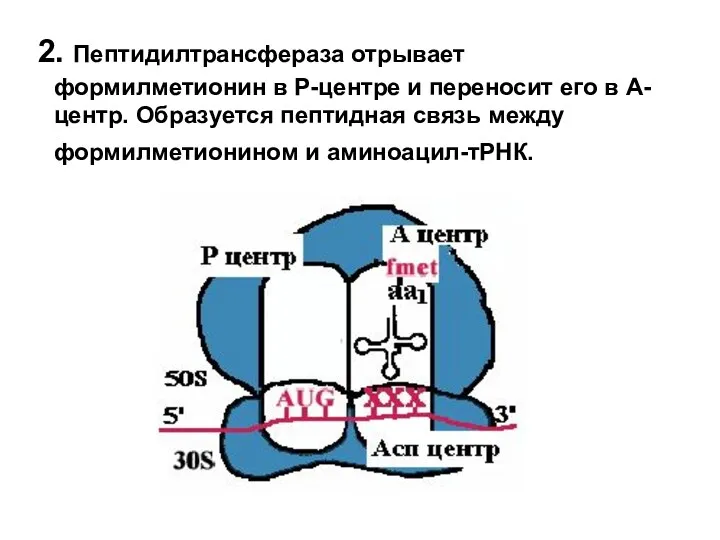
- 17. 2. Пептидилтрансфераза отрывает формилметионин в Р-центре и переносит его в А-центр. Образуется пептидная связь между формилметионином
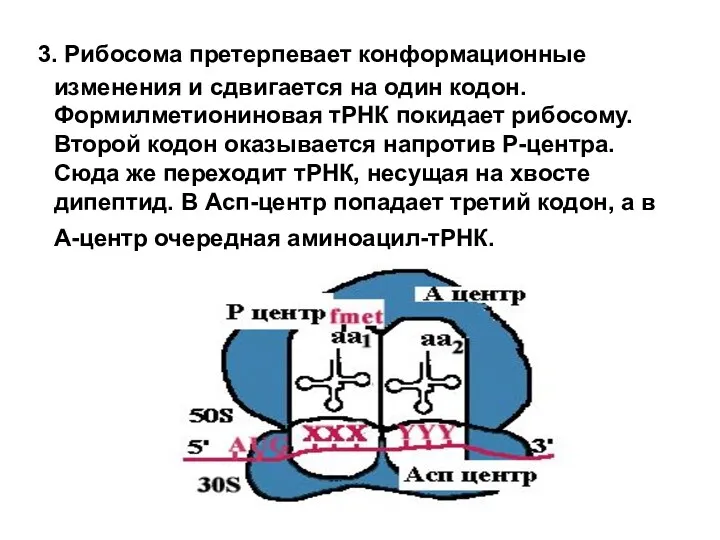
- 18. 3. Рибосома претерпевает конформационные изменения и сдвигается на один кодон. Формилметиониновая тРНК покидает рибосому. Второй кодон
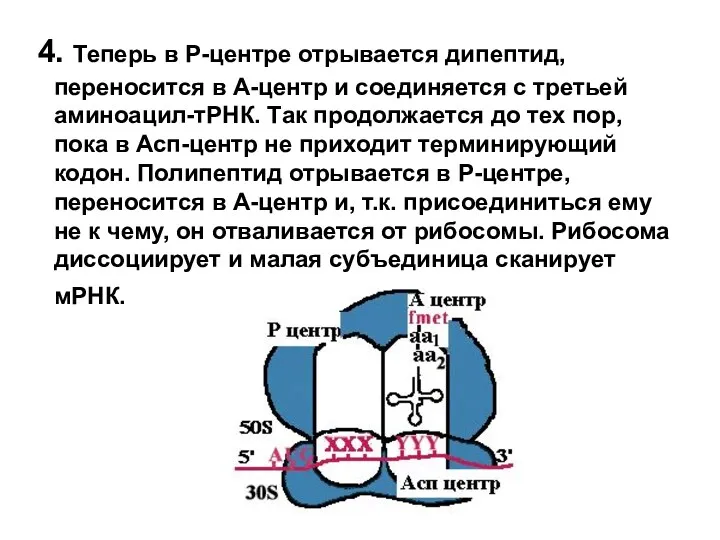
- 19. 4. Теперь в Р-центре отрывается дипептид, переносится в А-центр и соединяется с третьей аминоацил-тРНК. Так продолжается
- 20. 2 3 4
- 21. In vivo на каждой стадии (образования инициаторного комплекса, инициации, элонгации и терминации) участвуют различные белковые факторы,
- 22. Компоненты, необходимые для пяти основных стадий синтеза белка у E.coli
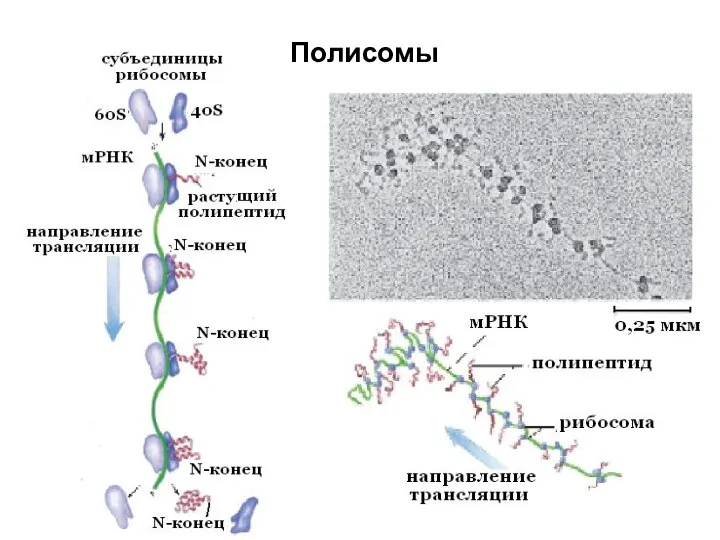
- 23. Полисомы
- 24. ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКОВ (фолдинг и процессинг) 1.Частичный протеолиз. 2. Модификация аминокислот (карбоксилирование, фосфорилирование, иодирование, гидроксилирование, ацилирование,
- 25. ИНГИБИТОРЫ СИНТЕЗА БЕЛКА Пуромицин – связывается с А центром рибосомы за счет сходства структуры с 3-концом
- 27. Скачать презентацию









 Гнилостные бактерии
Гнилостные бактерии Необычные приветствия. Сквернословие
Необычные приветствия. Сквернословие Ракообразные. Классификация, строение, функции, размножение
Ракообразные. Классификация, строение, функции, размножение Покрытосеменные, или Цветковые
Покрытосеменные, или Цветковые Игра. Угадай животное
Игра. Угадай животное Cattle breeds
Cattle breeds Биологические науки
Биологические науки Большой (конечный) мозг
Большой (конечный) мозг Створення зелених насаджень
Створення зелених насаджень Репликация и транскрипция
Репликация и транскрипция Надцарство доядерные
Надцарство доядерные Эндокринная система
Эндокринная система Видоизменения побегов
Видоизменения побегов Биология – наука о живом мире. Общие свойства живых организмов.
Биология – наука о живом мире. Общие свойства живых организмов. Цитоплазматическая наследственность
Цитоплазматическая наследственность Ботанический сад во время блокады Ленинграда
Ботанический сад во время блокады Ленинграда Презентация по теме Постэмбриональное развитие
Презентация по теме Постэмбриональное развитие Класс насекомые. Стрекозы
Класс насекомые. Стрекозы Пришкольный участок. Уход за растениями
Пришкольный участок. Уход за растениями Квезаль - священная птица индейцев майя
Квезаль - священная птица индейцев майя Основы здорового питания собак и кошек
Основы здорового питания собак и кошек Биогенетический закон
Биогенетический закон Отряд приматы
Отряд приматы Развитие жизни в протерозойской и палеозойской эрах
Развитие жизни в протерозойской и палеозойской эрах Разведение кроликов
Разведение кроликов Органы и системы органов животных
Органы и системы органов животных Наследственность и изменчивость организмов
Наследственность и изменчивость организмов Кабинет биологии, фото
Кабинет биологии, фото