Содержание
- 2. Среди органических веществ белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры.
- 3. Функции белков?
- 4. Функции белка в организме: Каталитическая(ферменты) Регуляторная (сигнальные молекулы и рецепторы) Транспортная Защитные (антитела, система комплемента, лизин,
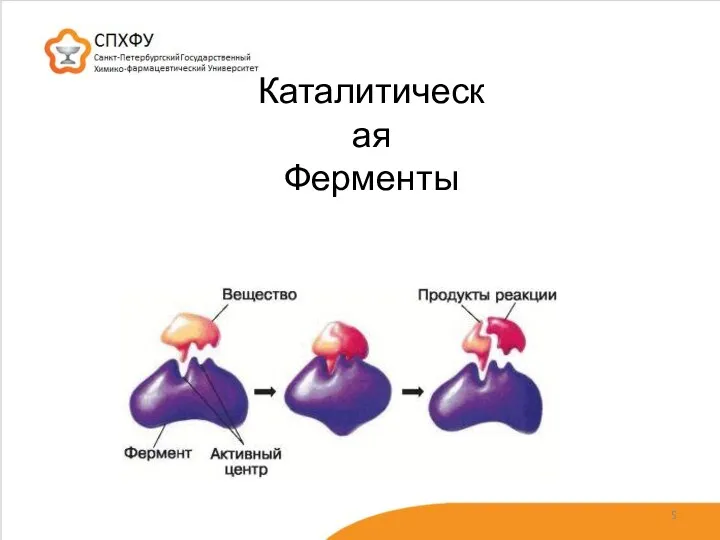
- 5. Каталитическая Ферменты
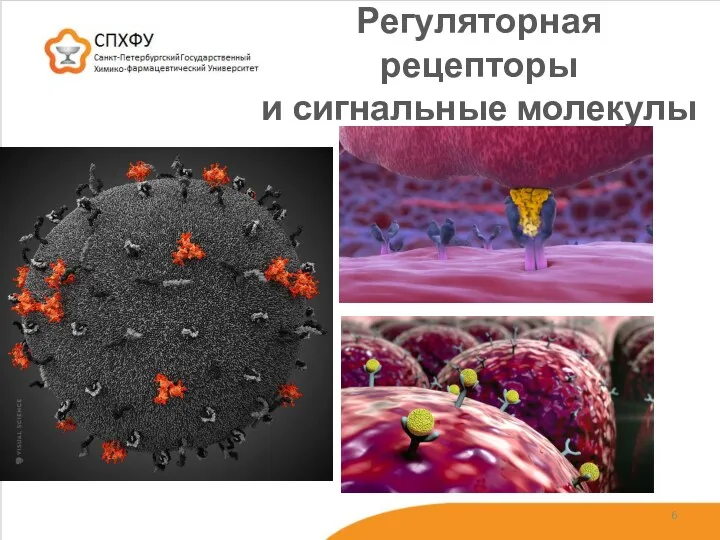
- 6. Регуляторная рецепторы и сигнальные молекулы
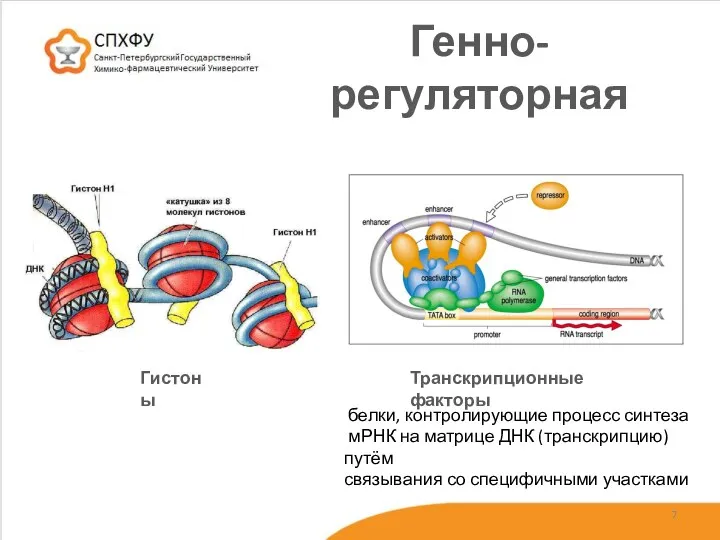
- 7. Генно-регуляторная белки, контролирующие процесс синтеза мРНК на матрице ДНК (транскрипцию) путём связывания со специфичными участками Гистоны
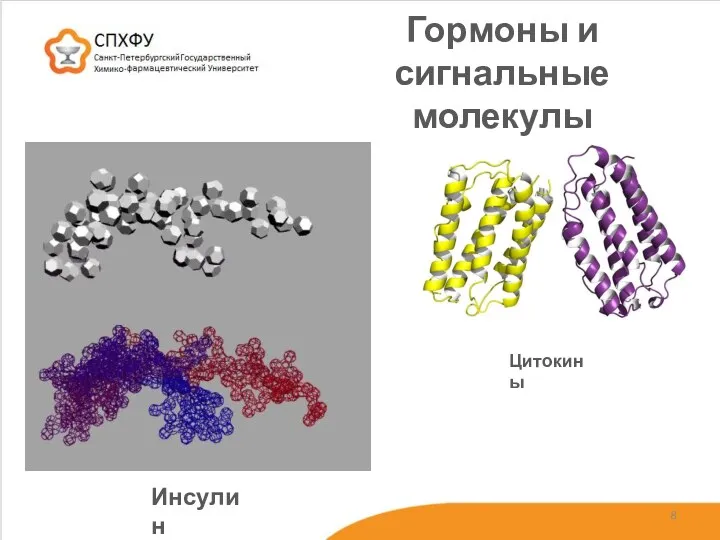
- 8. Гормоны и сигнальные молекулы Инсулин Цитокины
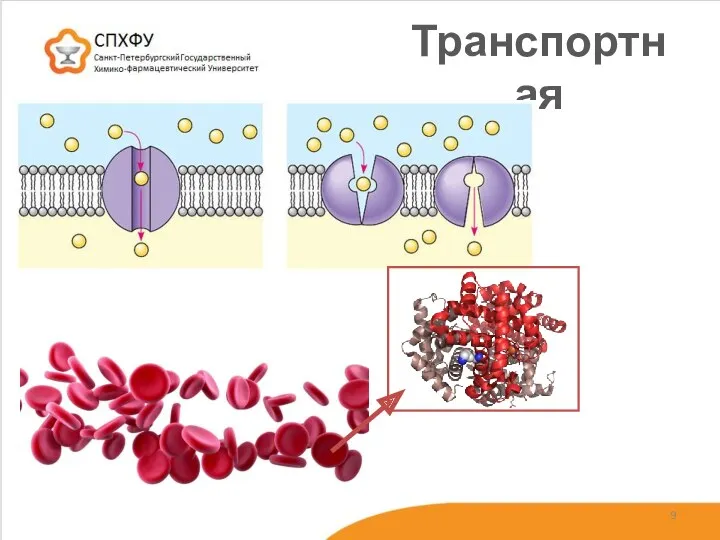
- 9. Транспортная
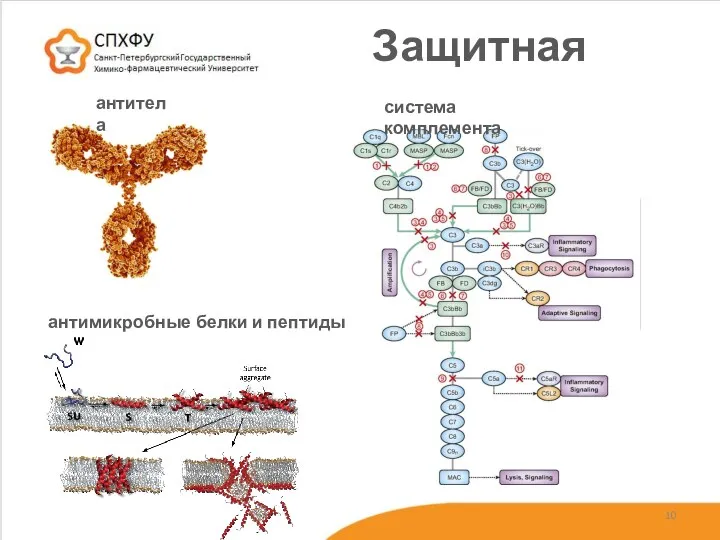
- 10. Защитная антитела система комплемента антимикробные белки и пептиды
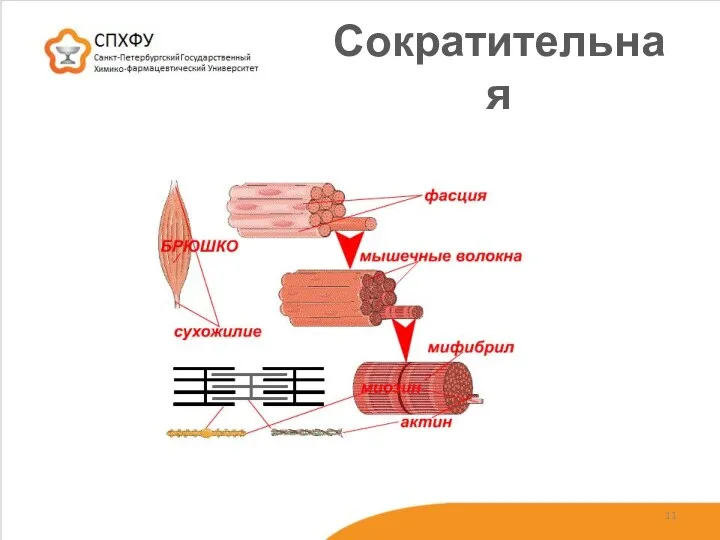
- 11. Сократительная
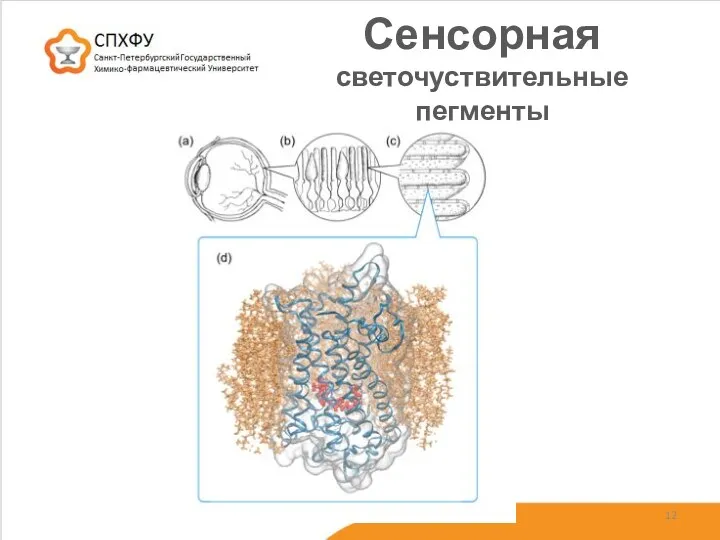
- 12. Сенсорная светочуствительные пегменты
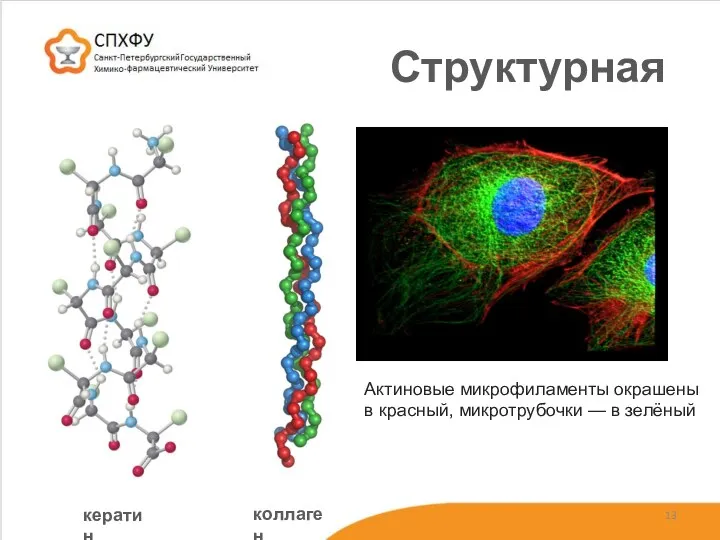
- 13. Структурная кератин коллаген Актиновые микрофиламенты окрашены в красный, микротрубочки — в зелёный
- 14. Запасная овальбумин
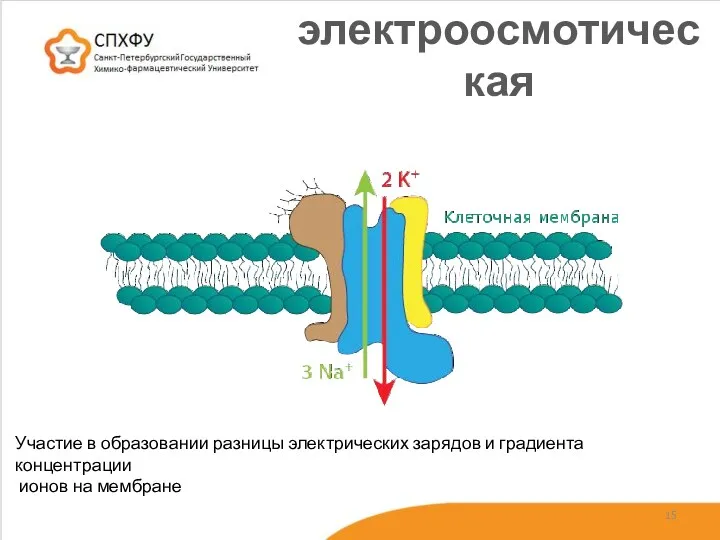
- 15. электроосмотическая Участие в образовании разницы электрических зарядов и градиента концентрации ионов на мембране
- 16. Токсикогенная ботулотоксин
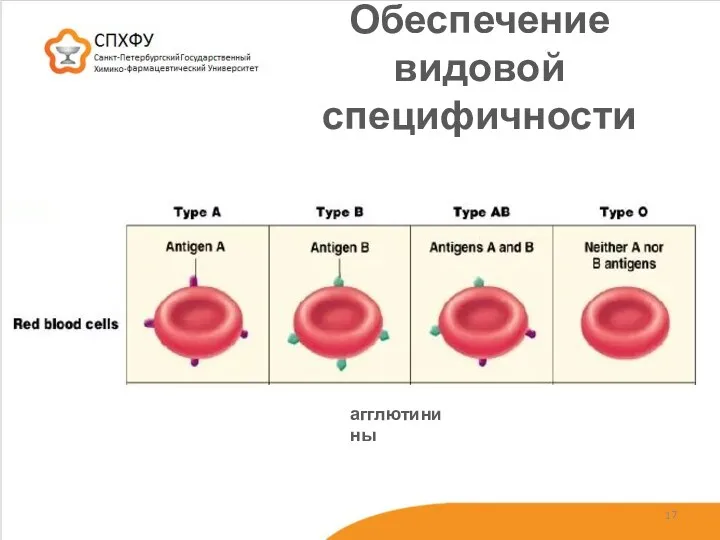
- 17. Обеспечение видовой специфичности агглютинины
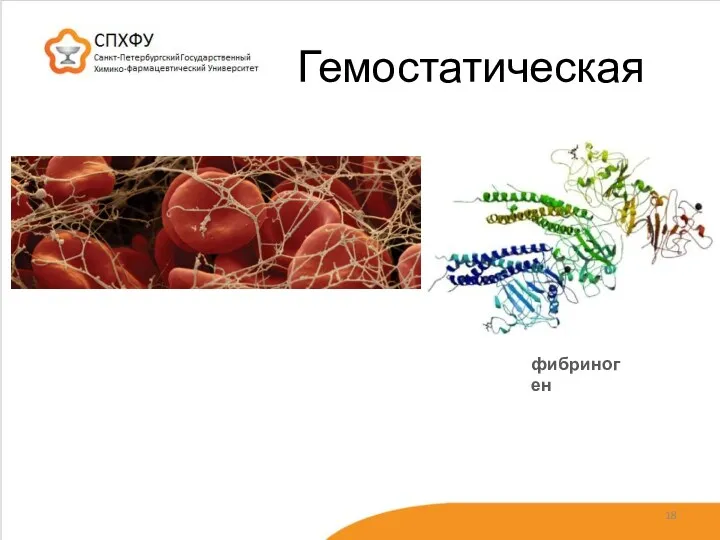
- 18. Гемостатическая фибриноген
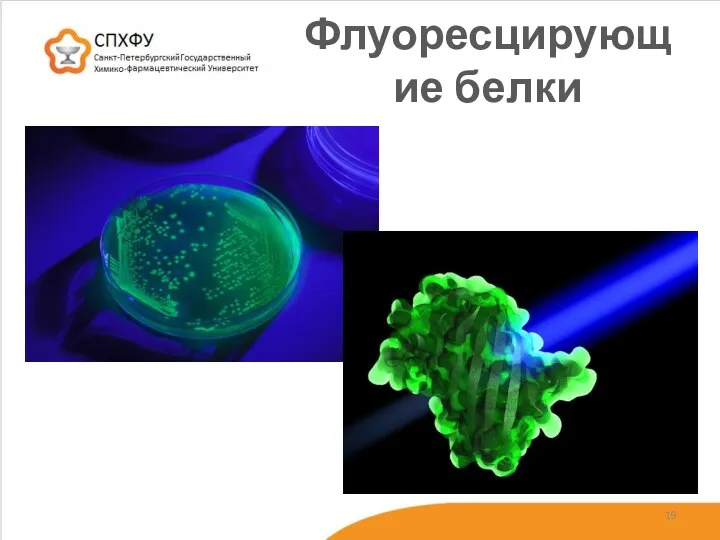
- 19. Флуоресцирующие белки
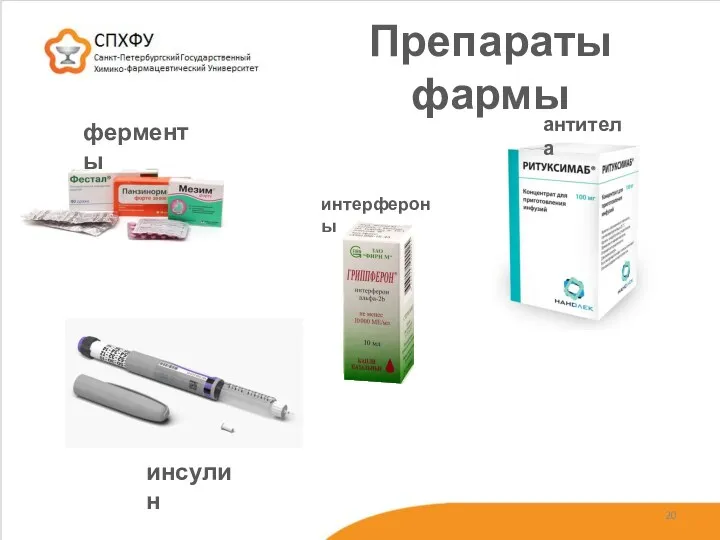
- 20. Препараты фармы ферменты антитела инсулин интерфероны
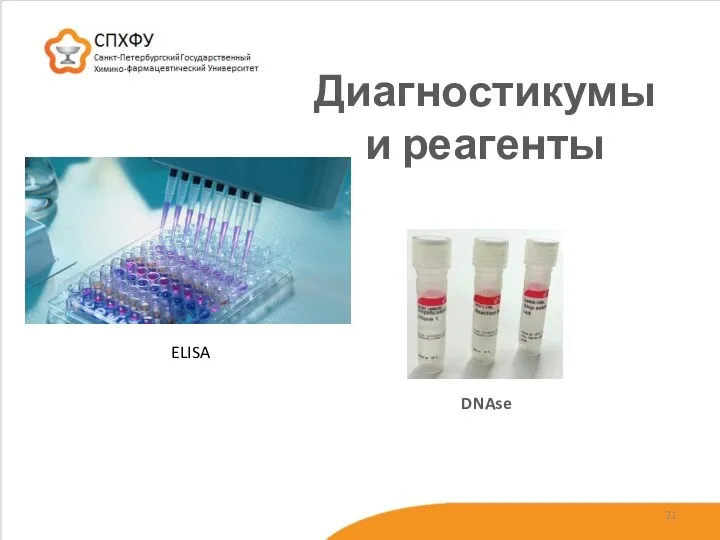
- 21. Диагностикумы и реагенты ELISA DNAse
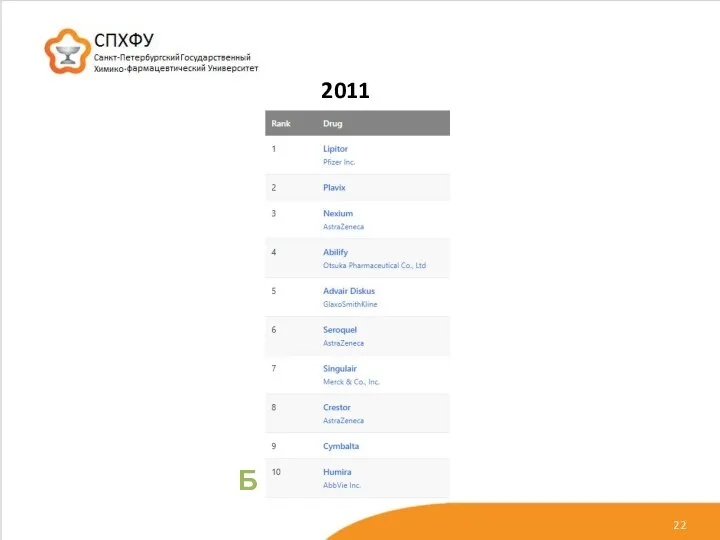
- 22. 2011 Б
- 23. 2017 Б Б Б Б Б Б Б
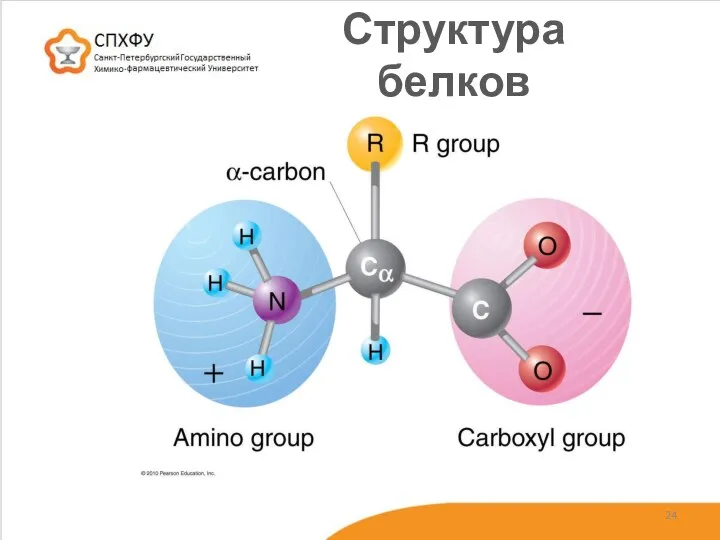
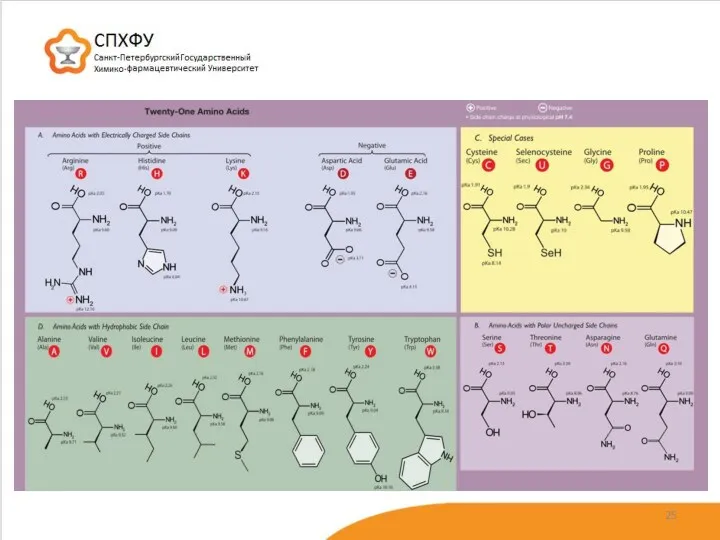
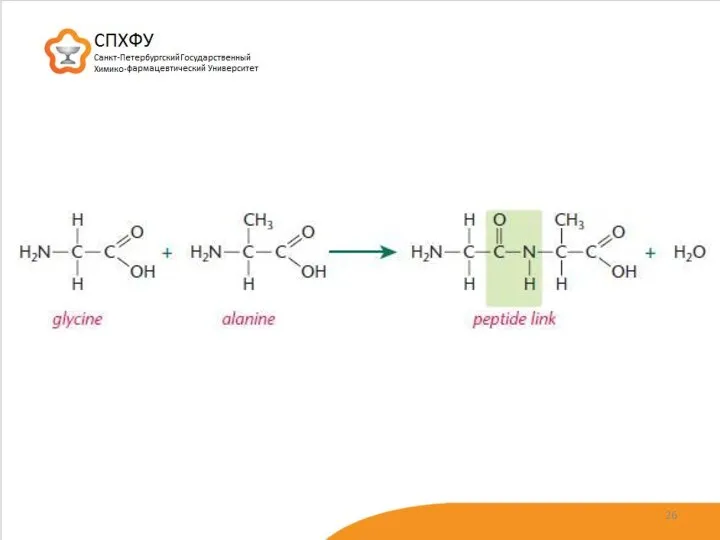
- 24. Структура белков
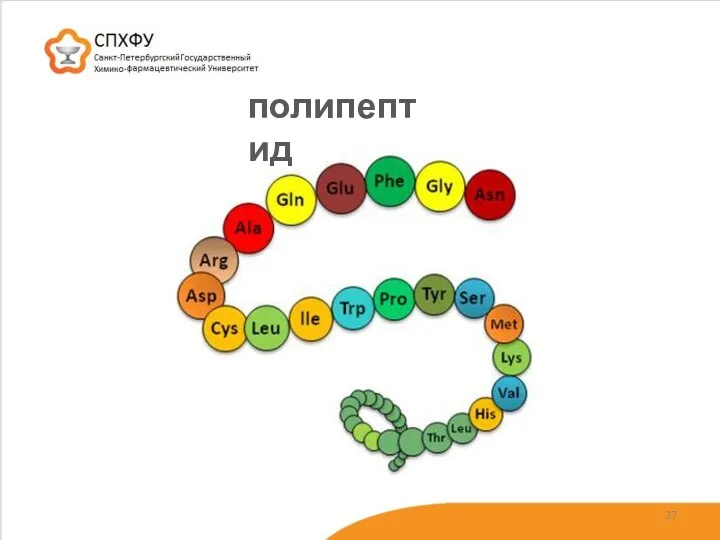
- 27. полипептид
- 28. Пептид или белок? ~до 30и аминокислотных остатка
- 29. Уровни организации белков
- 30. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя
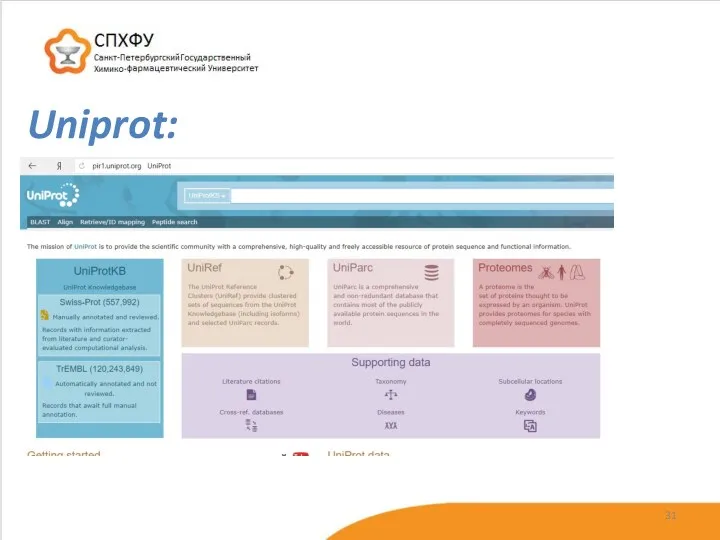
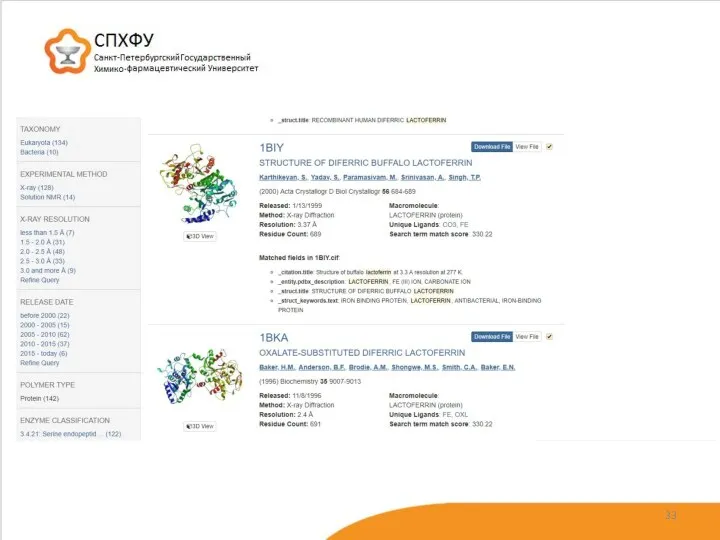
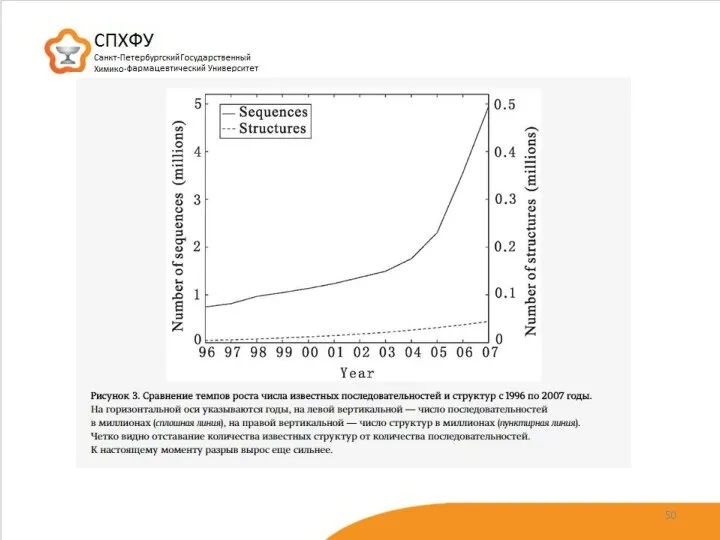
- 31. Uniprot:
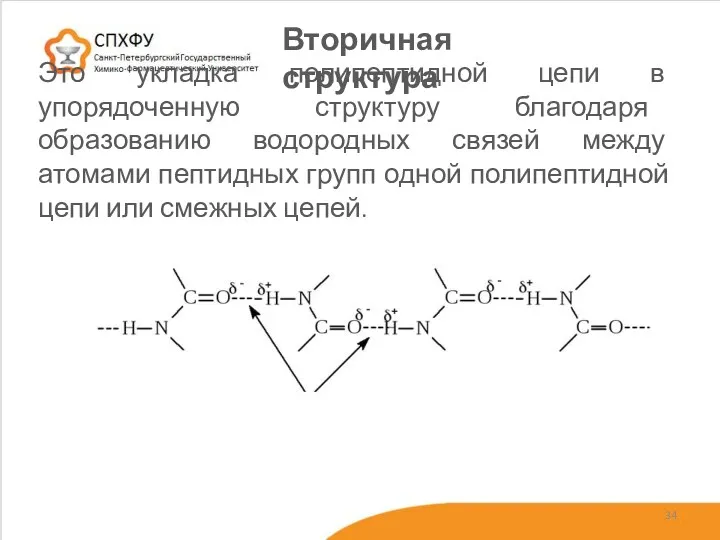
- 34. Это укладка полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между атомами пептидных групп одной
- 36. Основные характеристики α-спирали: – водородные связи образуются между пептидными группами каждого первого и четвертого аминокислотного остатка;
- 37. β-Структура (слоисто-складчатая) – имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей
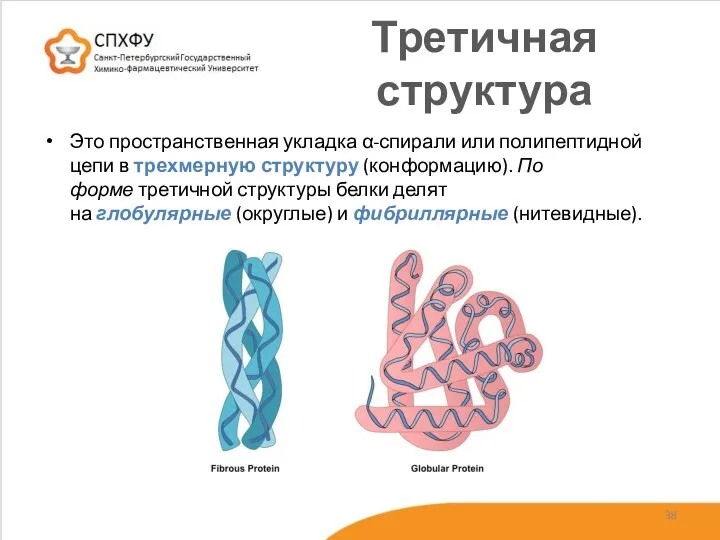
- 38. Третичная структура Это пространственная укладка α-спирали или полипептидной цепи в трехмерную структуру (конформацию). По форме третичной
- 39. Связи, стабилизирующие третичную структуру образуются между боковыми радикалами аминокислот и их функциональными группами. Связи могут быть
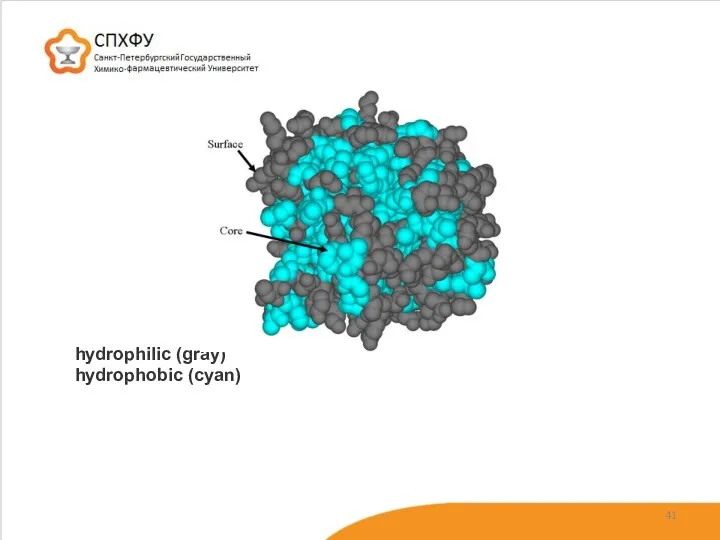
- 40. Слабые связи: – гидрофобная связь (ван-дер-ваальсова) – образуется между гидрофобными (неполярными) радикалами аминокислот; – водородные связи
- 41. hydrophilic (gray) hydrophobic (cyan)
- 42. Четвертичная структура белка Некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет вторичную и
- 43. Денатурация -это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а
- 44. Фолдинг белка -процесс пространственной упаковки белковой молекулы, принятия белком строго определенной формы, в которой он выполняет
- 46. Шапероны Класс белка, главная функция которого состоит в восстановлении правильной нативной третичной или четвертичной структуры белка,
- 47. Посттрансляционная модификация белка Посттрансляционная модификация белков 1. Удаление с N-конца метионина или даже нескольких аминокислот специфичными
- 48. Сложные белки Фосфопротеиды Гликопротеиды Хромопротеиды Металлопротеиды Липопротеиды Нуклеопротеиды
- 52. Скачать презентацию






















 f611e845-2141-4c61-a9b2-34e2049b0658
f611e845-2141-4c61-a9b2-34e2049b0658 Морские свинки
Морские свинки Особенности пищеварения у собак и котов. Питательные и биологически активные вещества
Особенности пищеварения у собак и котов. Питательные и биологически активные вещества Лекция 1. Растениеводство
Лекция 1. Растениеводство Этимология названий лекарственных растений. Мифы и легенды
Этимология названий лекарственных растений. Мифы и легенды Почки растений
Почки растений Турбота про потомство
Турбота про потомство Путешествие в страну Легумия. Систематика покрытосеменных. 6 класс
Путешествие в страну Легумия. Систематика покрытосеменных. 6 класс Нейропрорывы-2017/2018
Нейропрорывы-2017/2018 Презентация по биологии для учащихся 7 класса по теме Класс Пресмыкающиеся
Презентация по биологии для учащихся 7 класса по теме Класс Пресмыкающиеся Вітаміни. Їх роль у життєдіяльності людини
Вітаміни. Їх роль у життєдіяльності людини Размножение - свойство живых организмов
Размножение - свойство живых организмов Підряд Мавпи
Підряд Мавпи Энергетический обмен. Дыхание
Энергетический обмен. Дыхание Цікаві факти про риб
Цікаві факти про риб Талдағыштар физиологиясы. Талдағыштардың жалпы қасиеттері. Көру талдағыштары
Талдағыштар физиологиясы. Талдағыштардың жалпы қасиеттері. Көру талдағыштары Структура и функции клетки
Структура и функции клетки Размножение и развитие человека
Размножение и развитие человека Покрытосеменные, или Цветковые
Покрытосеменные, или Цветковые Самые страшные животные мира
Самые страшные животные мира Рост и развитие растений
Рост и развитие растений Освоение суши растениями
Освоение суши растениями Хромосомная теория наследственностию. Генетика пола
Хромосомная теория наследственностию. Генетика пола Юрский период (195 -137 млн.)
Юрский период (195 -137 млн.) Презентация Великаны и карлики в животном мире
Презентация Великаны и карлики в животном мире Насекомые. Отряд равнокрылые
Насекомые. Отряд равнокрылые Биотические факторы
Биотические факторы Становление наук о человеке. (8 класс)
Становление наук о человеке. (8 класс)