Содержание
- 2. В роли лиганда могут выступать любые молекулы: молекулы, выполняющие в белке структурную функцию: липиды, углеводы, нуклеиновые
- 3. Узнавание лиганда обеспечивается: комплементарностью структуры центра связывания белка структуре лиганда, иначе говоря, пространственным и химическим соответствием
- 4. Функции лиганда в составе сложного белка: изменяет свойства белков (заряд, растворимость, термолабильность), например, фосфорная кислота в
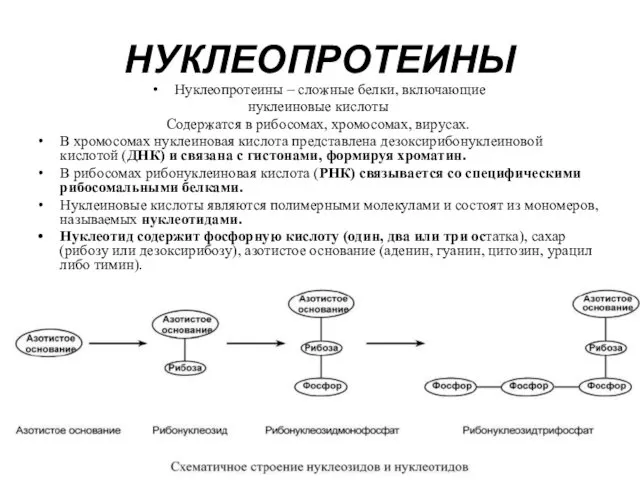
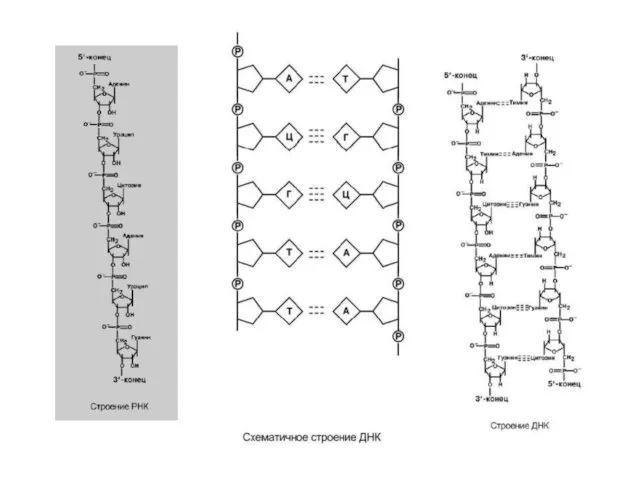
- 5. НУКЛЕОПРОТЕИНЫ Нуклеопротеины – сложные белки, включающие нуклеиновые кислоты Содержатся в рибосомах, хромосомах, вирусах. В хромосомах нуклеиновая
- 6. Самым распространенным в природе является нуклеотид аденозинтрифосфат, используемый как высокоэнергетическое соединение для реакций трансмембранного переноса веществ
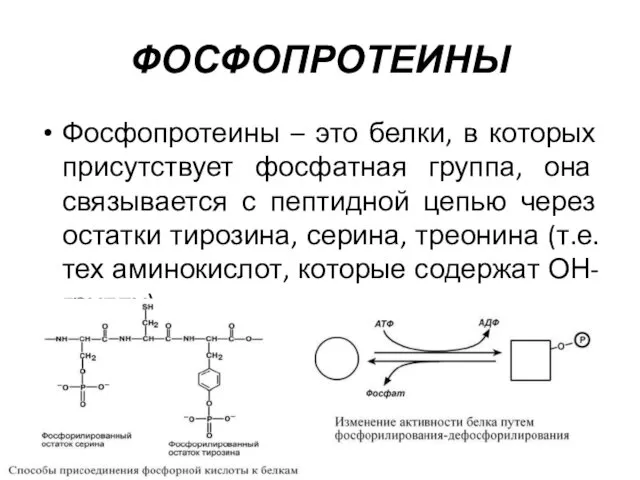
- 8. ФОСФОПРОТЕИНЫ Фосфопротеины – это белки, в которых присутствует фосфатная группа, она связывается с пептидной цепью через
- 9. Фосфорная кислота может выполнять: Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине
- 10. ЛИПОПРОТЕИНЫ К липопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды. Однако традиционно к липопротеинам
- 11. Выделяют четыре основных класса липопротеинов: хиломикроны (ХМ), липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП), липопротеины низкой плотности
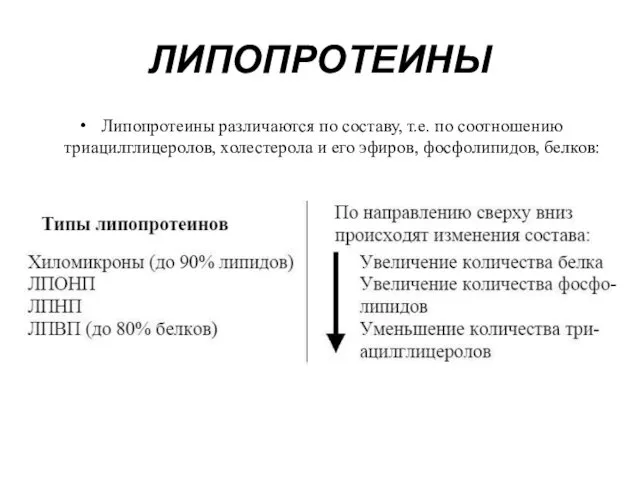
- 12. Липопротеины различаются по составу, т.е. по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов, белков: ЛИПОПРОТЕИНЫ
- 13. ХРОМОПРОТЕИНЫ Хромопротеины содержат окрашенные простетические группы. Сюда относят: гемопротеины (содержат гем) ретинальпротеины (содержат витамин А) флавопротеины
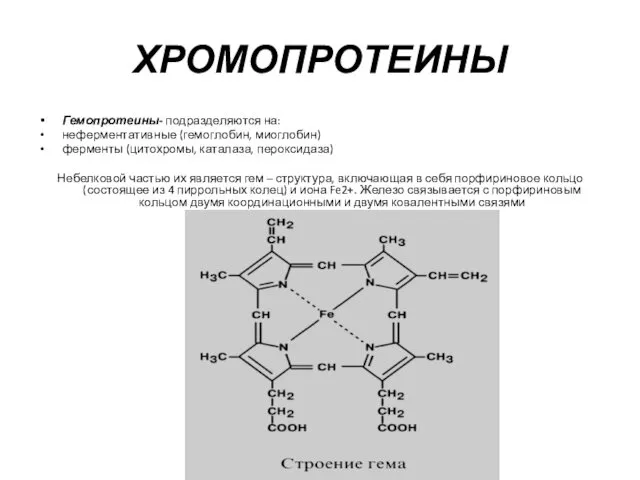
- 14. Гемопротеины- подразделяются на: неферментативные (гемоглобин, миоглобин) ферменты (цитохромы, каталаза, пероксидаза) Небелковой частью их является гем –
- 15. Цитохромы Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b,
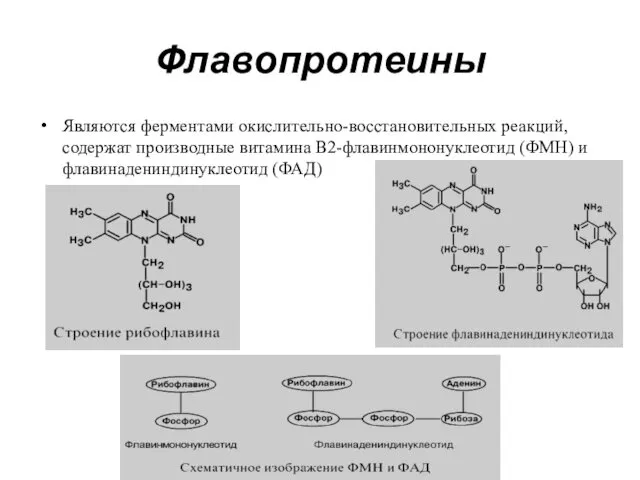
- 16. Флавопротеины Являются ферментами окислительно-восстановительных реакций, содержат производные витамина В2-флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД)
- 17. МЕТАЛЛОПРОТЕИНЫ Металлопротеины, кроме белка, содержат ионы одного или нескольких металлов. Металлопротеины часто являются ферментами. Ионы металлов
- 18. участвуют в ориентации субстрата в активном центре фермента, входят в состав активного центра фермента и участвуют
- 19. К металлопротеинам, например, относятся белки, содержащие: медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи
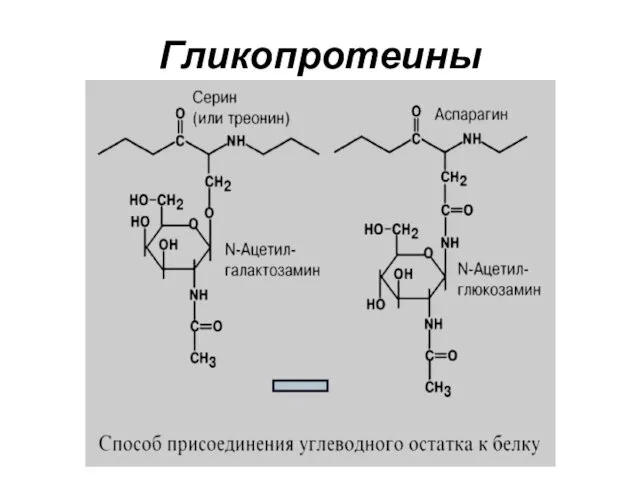
- 20. ГЛИКОПРОТЕИНЫ (ГЛИКОКОНЪЮГАТЫ) Гликопротеины – белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов варьирует
- 21. Между этими подклассами имеются существенные отличия: ГЛИКОПРОТЕИНЫ (ГЛИКОКОНЪЮГАТЫ)
- 22. Гликопротеины Для гликопротеинов характерно низкое содержание углеводов. Они присоединены либо N-гликозидной связью к амидному азоту аспарагина,
- 23. Гликопротеины
- 24. Функцией гликопротеинов являются: 1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин. 2. Защитная
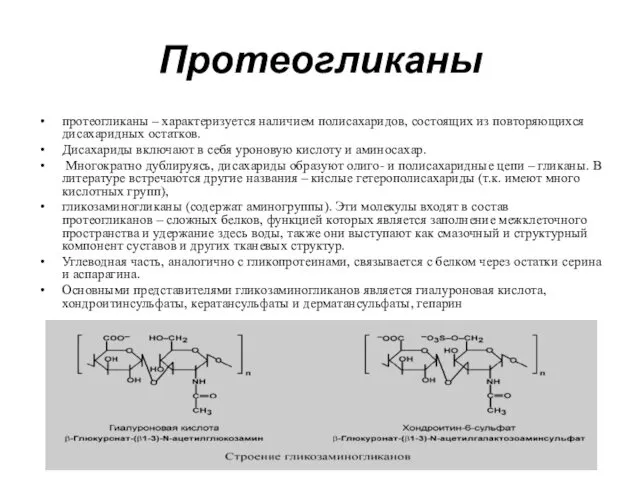
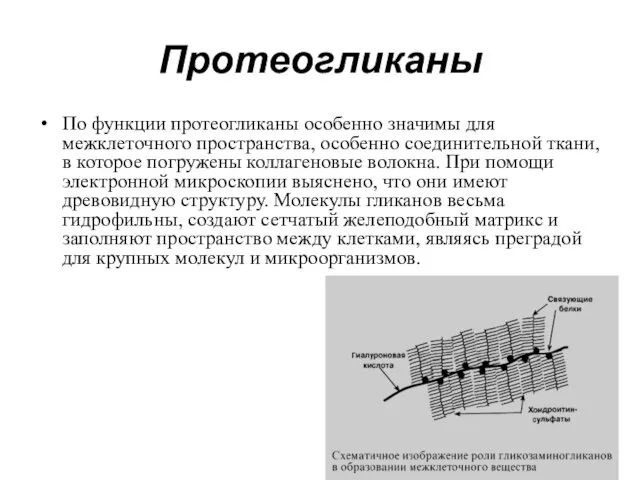
- 25. Протеогликаны протеогликаны – характеризуется наличием полисахаридов, состоящих из повторяющихся дисахаридных остатков. Дисахариды включают в себя уроновую
- 26. По функции протеогликаны особенно значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна.
- 27. ВИТАМИНЫ, ИХ КОФЕРМЕНТНЫЕ ФОРМЫ, ФУНКЦИИ Понятием витамины в настоящее время объединяется группа низкомолекулярных веществ разнообразной природы,
- 28. ОБЩАЯ ХАРАКТЕРИСТИКА Независимо от своих свойств витамины характеризуются следующими общебиологическими свойствами: 1. В организме витамины не
- 29. Жирорастворимые витамины при увеличении дозы накапливаются и могут вызывать гипервитаминозы с рядом общих симптомов (потеря аппетита,
- 30. Витамины А и Е при избыточном потреблении оказывают канцерогенное действие, что выяснилось после массового использования непроверенных
- 31. Причины нехватки витаминов могут быть: а. Экзогенные: нерациональное питание, т.е. недостаточное потребление с пищей (Установлено, что
- 32. Некоторые витамины поступают в организм в виде провитаминов. В организме провитамины превращаются в активные формы например:
- 34. Скачать презентацию






















 Клеточное строение листа
Клеточное строение листа Бактерии. Распространение бактерий
Бактерии. Распространение бактерий Чибис-птица года - 2010
Чибис-птица года - 2010 Свойства живых организмов
Свойства живых организмов Генетика людини
Генетика людини Покровные и проводящие растительные ткани
Покровные и проводящие растительные ткани Эндокринная система
Эндокринная система Оплодотворение у цветковых растений
Оплодотворение у цветковых растений ПРЕЗЕНТАЦИЯ ДЛЯ ИНТЕРАКТИВНОЙ ДОСКИ. ТЕСТ. МЕХАНИЗМЫ ЭВОЛЮЦИИ.
ПРЕЗЕНТАЦИЯ ДЛЯ ИНТЕРАКТИВНОЙ ДОСКИ. ТЕСТ. МЕХАНИЗМЫ ЭВОЛЮЦИИ. Конкурс:Экология. Книга. Мы. Лучший библиотечный цветник
Конкурс:Экология. Книга. Мы. Лучший библиотечный цветник Плод. Строение плода
Плод. Строение плода Алдыңғы іш қабырғасының анатомиялық құрылымы
Алдыңғы іш қабырғасының анатомиялық құрылымы Обмен белков-3
Обмен белков-3 Биотические факторы среды. Отношения организмов
Биотические факторы среды. Отношения организмов Основы молекулярной биологии. Биосинтез белка. Транскрипция
Основы молекулярной биологии. Биосинтез белка. Транскрипция Подтип Хелицеровые (Сhelicerata)
Подтип Хелицеровые (Сhelicerata) Царство Животные
Царство Животные Живая и неживая природа
Живая и неживая природа История развития организмов по эрам
История развития организмов по эрам Знатоки растений
Знатоки растений Загальна характеристика класу Кісткові риби
Загальна характеристика класу Кісткові риби Внешнее строение листа
Внешнее строение листа Отряд Черепахи
Отряд Черепахи Клеточная теория
Клеточная теория Нервная система животных. Рефлекс. Инстинкт
Нервная система животных. Рефлекс. Инстинкт Ядовитые растения Самарской области
Ядовитые растения Самарской области Анализаторы. Органы слуха и равновесия
Анализаторы. Органы слуха и равновесия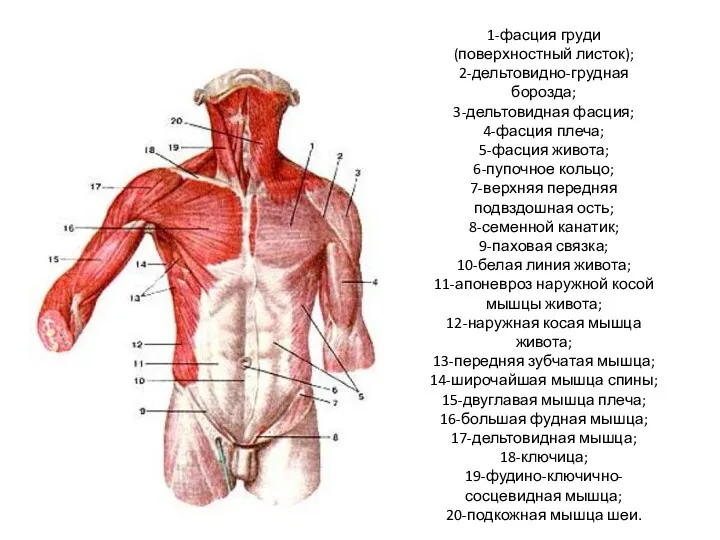 Мышцы туловища
Мышцы туловища