Содержание
- 3. Нуклеиновые кислоты являются нерегулярными полимерами, мономеры которых - нуклеотиды. Нуклеотид = нуклеозид + фосфорная кислота =
- 4. Нуклеотиды соединяются друг с другом в полимерную цепочку с помощью фосфодиэфирных связей. Азотистые основания не принимают
- 5. Существует два класса азотистых оснований. Пурины: аденин (А) и гуанин (Г) - содержат два гетероцикла. Пиримидины:
- 6. Принципы строения ДНК Нерегулярность. Антипараллельность. Комплементарность Наличие регулярной вторичной структуры рис.2.4
- 7. Формы двойной спирали ДНК
- 8. Характеристики разных РНК E.coli
- 9. мРНК (матричная или информационная) Одноцепочечная молекула, образующаяся на 1 из цепей ДНК в процессе транскрипции. Последовательность
- 10. рРНК (рибосомная) Кодируется особыми генами, находящимися в нескольких хромосомах и расположенными в участке ядрышка, известного под
- 11. тРНК (транспортная) Для каждой аминокислоты имеется специфическая тРНК, и все они доставляют содержащиеся в цитоплазме аминокислоты
- 12. рис.2.5
- 13. рис.2.6
- 14. У нуклеотидов много других функций
- 16. 2. Структура белков Определение: белки - это нерегулярные полимеры, мономерами которых являются L-аминокислоты. Общая формула аминокислоты:
- 17. Белки глобулярные катализ, транспорт, регуляция фибриллярные в основном структурная роль
- 18. Первичная структура белка Определение: первичная структура белка – это последовательность расположения аминокислотных остатков в полипептидной цепи.
- 19. Радикалы со свойствами оснований (щелочные) рис.2.7
- 20. Радикалы со свойствами кислот
- 21. Незаряженные полярные радикалы
- 22. Неполярные радикалы
- 23. Неполярные радикалы
- 24. Расшифровка первичной структуры белка Ф. Сангер, 1953г. – аминокислотная последовательность инсулина секвенирование анализ нуклеотидной последовательности сопоставление
- 25. Серповидно-клеточная анемия точечная мутация - замена Glu на Val – появление аномального гемоглобина, не способного связывать
- 26. Вторичная структура белка Определение: Вторичная структура белка – это упорядоченное строение полипептидных цепей, обусловленное водородными связями
- 27. рис.2.9
- 28. Вторичная структура белка
- 29. Третичная структура белка Определение: третичная структура белка – это пространственная конформация полипептида, имеющего вторичную структуру, и
- 30. Существует четыре типа взаимодействий между радикалами: Ковалентные связи между остатками двух цистеинов(дисульфидные мостики). 2. Ионные (электростатические)
- 31. В сворачивании (фолдинге) задействованы 3 типа нековалентных взаимодействий
- 32. Гидрофобные взаимодействия способствуют укладке белков в компактные конформации
- 33. Четвертичная структура белка Определение: четвертичная структура белка - это агрегация двух или большего числа полипептидных цепей,
- 34. Определение: Белок - это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию Полипептид - понятие
- 35. Наличие сайтов связывания позволяет белку взаимодействовать с лигандами избирательно
- 36. Функции белков 1. Структурная функция 2. Каталитическая функция. 3. Защитная функция (пока уникальна). 4. Регуляторная функция.
- 37. 3. Моносахариды
- 38. изомеры
- 40. 4. жирные кислоты и другие липиды
- 44. Скачать презентацию
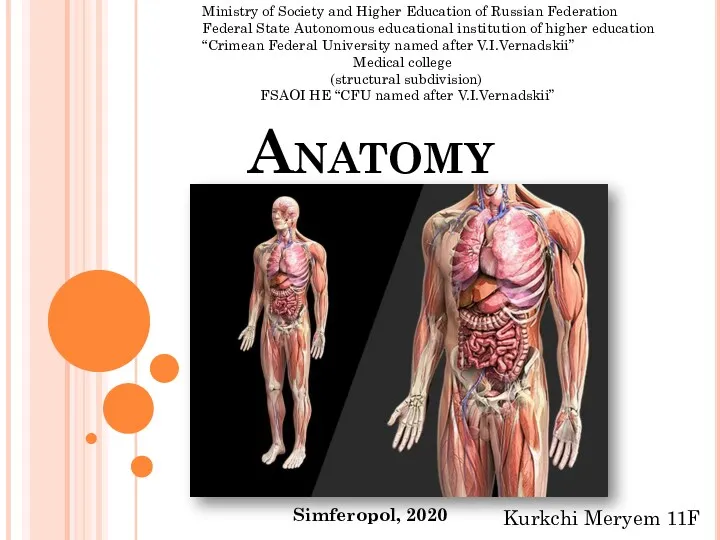 Anatomy is the identification and description
Anatomy is the identification and description Характеристика видов газонных сорных растений. Однолетние сорные растения
Характеристика видов газонных сорных растений. Однолетние сорные растения Ағзалардың тіршілігіндегі бөліп шығарудың маңызы Өсімдіктер мен жануарлардың бөліп шығару өнімдері
Ағзалардың тіршілігіндегі бөліп шығарудың маңызы Өсімдіктер мен жануарлардың бөліп шығару өнімдері Водоросли: зеленые, бурые, красные
Водоросли: зеленые, бурые, красные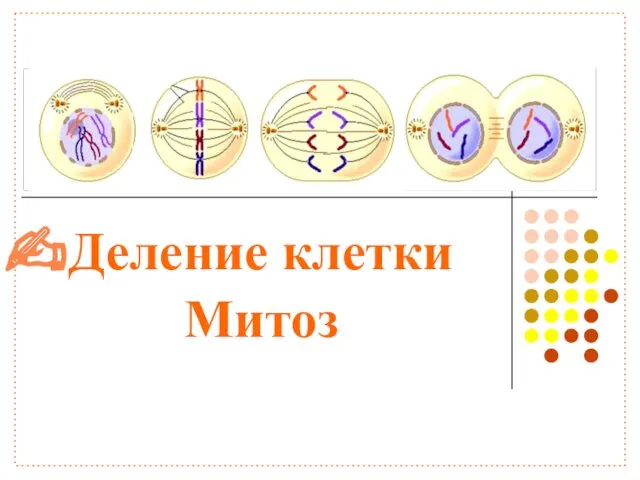 Деление клетки. Митоз
Деление клетки. Митоз Насекомые Красной Книги
Насекомые Красной Книги Сравнение характеристик процессов фотосинтеза и дыхания
Сравнение характеристик процессов фотосинтеза и дыхания Безпека харчування в умовах ситуацій воєнного стану
Безпека харчування в умовах ситуацій воєнного стану Класс насекомые. Общая характеристика
Класс насекомые. Общая характеристика Функциональная анатомия нервной системы. Спинной мозг. Спинномозговые нервы
Функциональная анатомия нервной системы. Спинной мозг. Спинномозговые нервы Живое вещество биосферы, его функции
Живое вещество биосферы, его функции Отряд Лососеобразные
Отряд Лососеобразные Проверочная работа Зрительный анализатор 8 класс
Проверочная работа Зрительный анализатор 8 класс КЛЕТКА
КЛЕТКА Презентация по биологии Плоды. Классификация плодов
Презентация по биологии Плоды. Классификация плодов Отряды насекомых. Стрекозы, Вши, Жуки, Клопы. 7 класс
Отряды насекомых. Стрекозы, Вши, Жуки, Клопы. 7 класс Эндокринная система. Железы внутренней секреции, строение, функции
Эндокринная система. Железы внутренней секреции, строение, функции Биологиялық жүйелердің жарықты жұту заңдылықтары. Фотобиологиялық үрдістердің алғашқы стадиялары
Биологиялық жүйелердің жарықты жұту заңдылықтары. Фотобиологиялық үрдістердің алғашқы стадиялары Ткани растений
Ткани растений Мышцы. Типы мышц, их строение и значение
Мышцы. Типы мышц, их строение и значение Надцарство прокариоты или доядерные организмы. Бактерии и цианобионты
Надцарство прокариоты или доядерные организмы. Бактерии и цианобионты Пищеварение и усвояемость пищи
Пищеварение и усвояемость пищи Пори року. Дні тижня. Доба. Урок №97. Я досліджую світ
Пори року. Дні тижня. Доба. Урок №97. Я досліджую світ Репликация. Синтез ДНК по матрице ДНК
Репликация. Синтез ДНК по матрице ДНК Строение и функции оболочек глаза. Гигиена зрения
Строение и функции оболочек глаза. Гигиена зрения Мозжечок и средний мозг
Мозжечок и средний мозг Решение генетических задач ЕГЭ 2014
Решение генетических задач ЕГЭ 2014 Как звери в лесу готовятся к зиме
Как звери в лесу готовятся к зиме