Содержание
- 2. Таргетинг генов
- 3. Гомологичная рекомбинация Осуществляется через образование структуры Холидея. В этом участвуют разнообразные ферменты: - комплекс топоизомераз, -
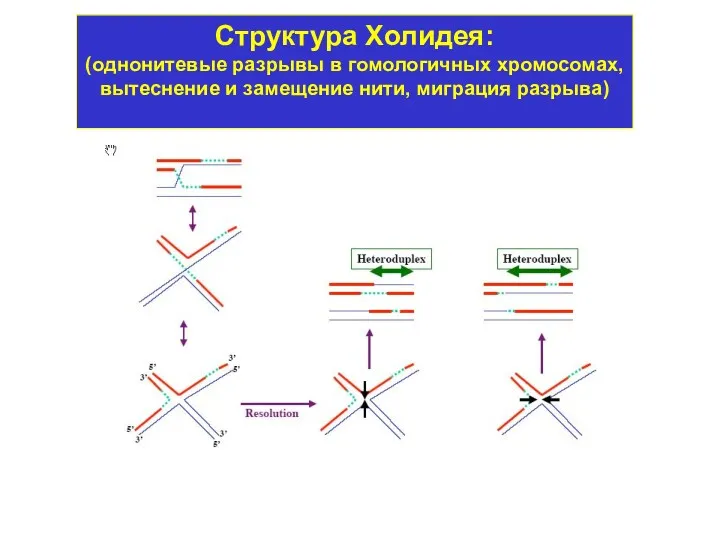
- 4. Структура Холидея: (однонитевые разрывы в гомологичных хромосомах, вытеснение и замещение нити, миграция разрыва)
- 5. Хронологическая справка о направленный переносе генов через механизм гомологичной рекомбинации Б. Бринстер – 1987 г. (500
- 6. Основные свойства ЭС клеток - плюрипотентность (тотипотентность) - неограниченный пролиферативный потенциал с сохранением исходного фенотипа сохранение
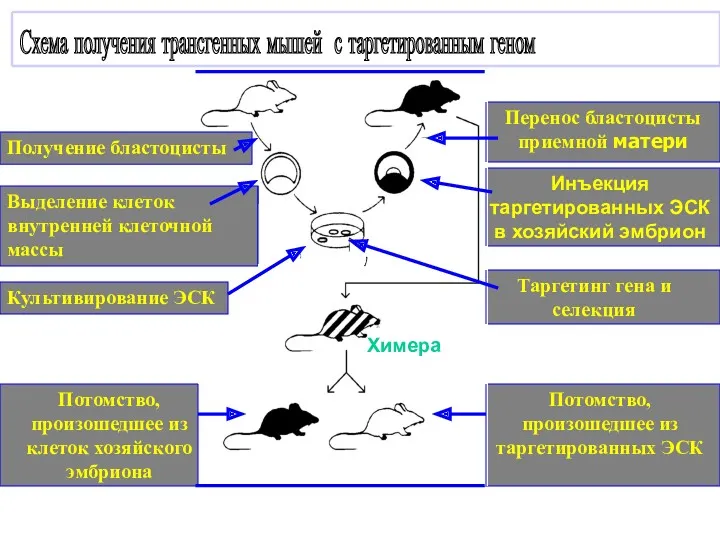
- 7. Потомство, произошедшее из таргетированных ЭСК Потомство, произошедшее из клеток хозяйского эмбриона Химера Таргетинг гена и селекция
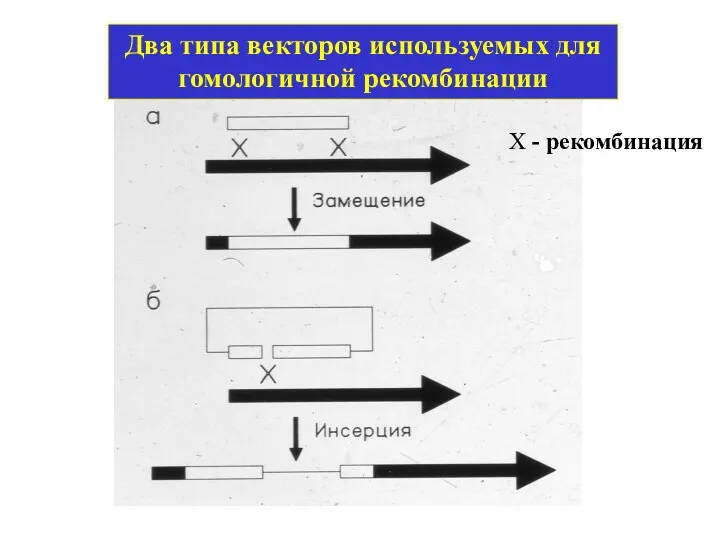
- 8. Два типа векторов используемых для гомологичной рекомбинации Х - рекомбинация
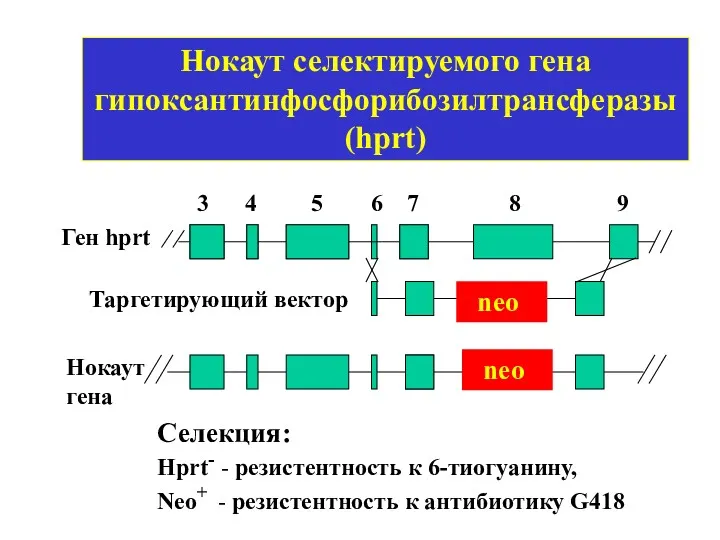
- 9. Нокаут селектируемого гена гипоксантинфосфорибозилтрансферазы (hprt) Ген hprt neo Таргетирующий вектор 3 4 5 6 7 8
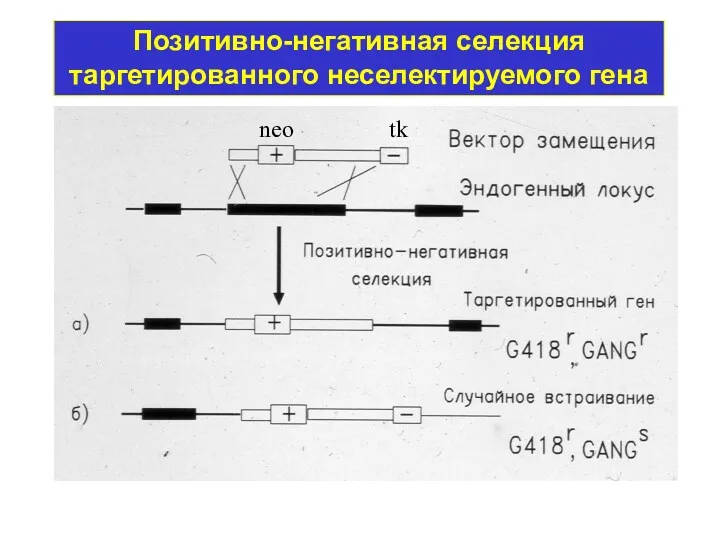
- 10. Позитивно-негативная селекция таргетированного неселектируемого гена neo tk
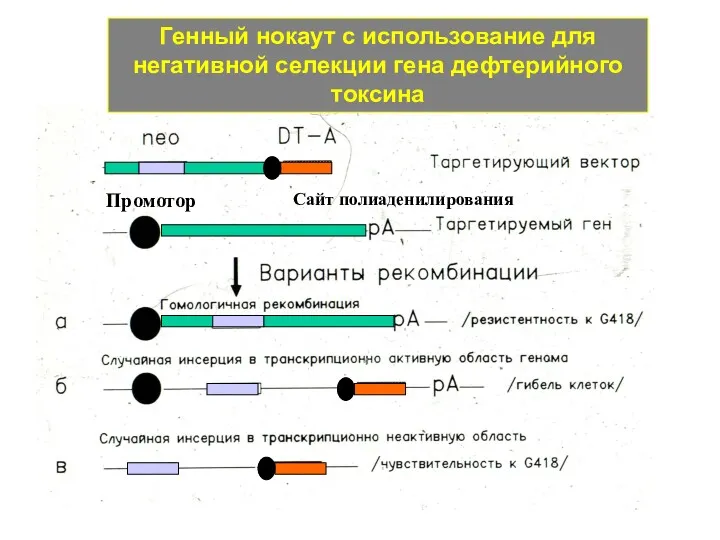
- 11. Генный нокаут с использование для негативной селекции гена дефтерийного токсина Промотор Сайт полиаденилирования
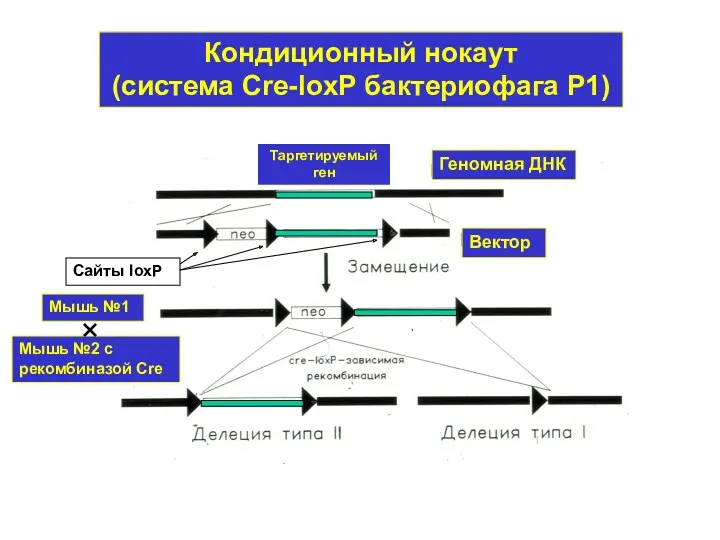
- 12. Кондиционный нокаут (система Cre-loxP бактериофага Р1) Сайты loxP Мышь №1 Мышь №2 с рекомбиназой Cre Таргетируемый
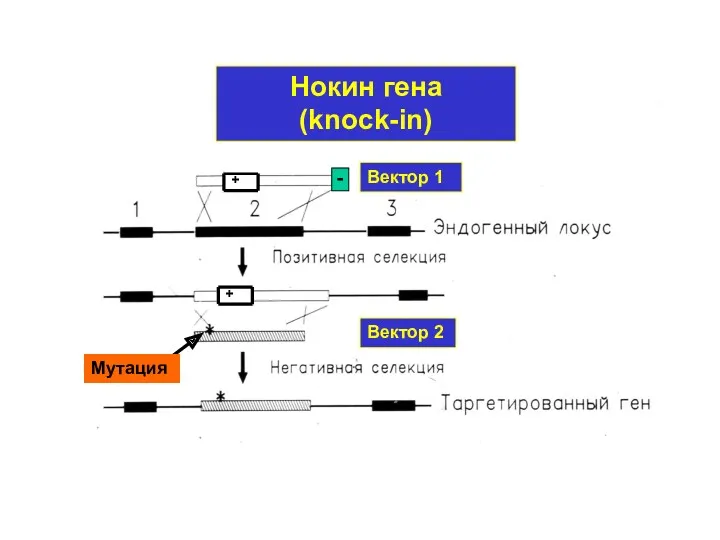
- 13. Вектор 1 Вектор 2 Нокин гена (knock-in) Мутация + +
- 14. Функции генов, установленные с помощью их нокаута
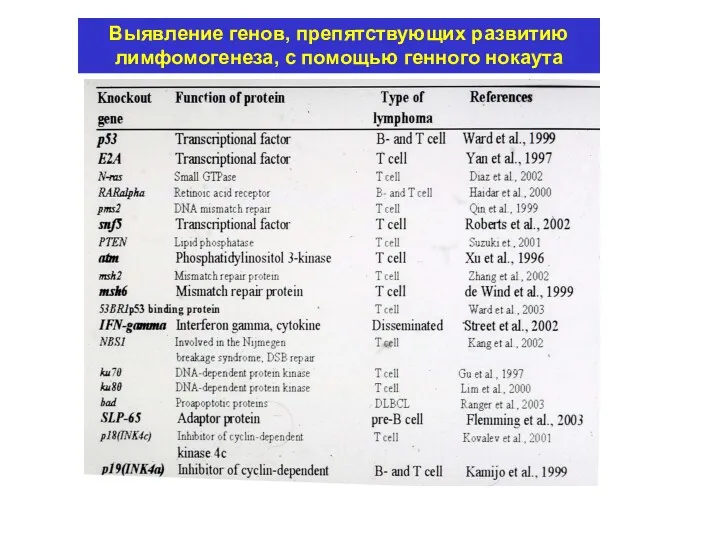
- 15. Выявление генов, препятствующих развитию лимфомогенеза, с помощью генного нокаута
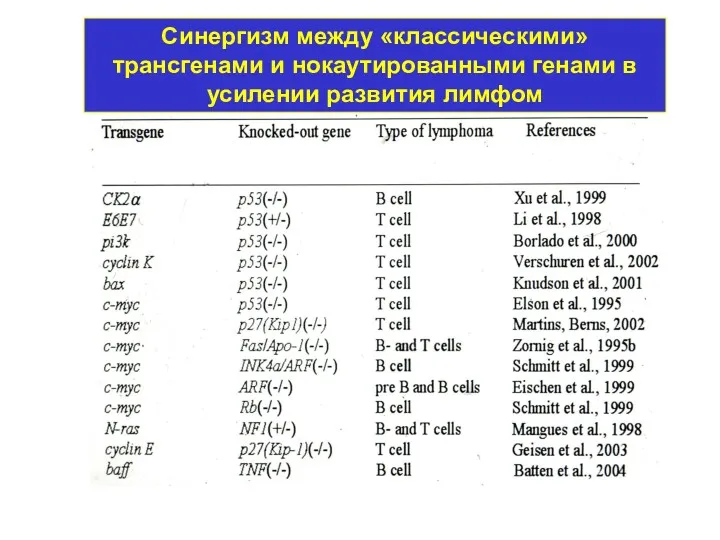
- 16. Синергизм между «классическими» трансгенами и нокаутированными генами в усилении развития лимфом
- 17. Синергизм между действием генов в лимфомогенезе, установленный на основе анализа дважды и трижды нокаутированных мышей
- 18. Обнаружение генов, участвующих в раннем развитии, с помощью нокаута генов Нокаутированный ген Аномалии развития Гамма-субъединица ламинина
- 19. Было известно: Белок TAS1R3 принимает участие в работе вкусовых рецепторов, а белок GNAT3 нужен для передачи
- 20. Примеры изучения вирусного патогенеза с помощью нокаута генов Вирус лейкоза мышей Мыши дикого типа – синдром
- 21. Таргетинг генов без ЭСК – прямо в зиготе (редактирование генома) 2009 г. – белки с «цинковыми
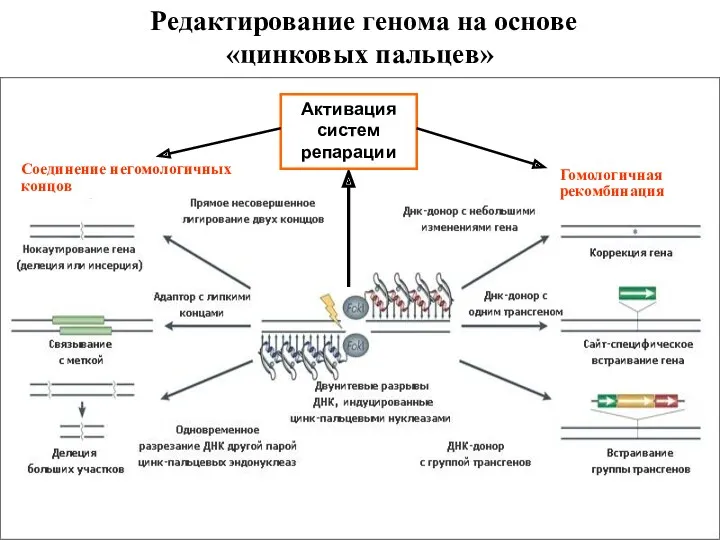
- 22. Редактирование генома на основе «цинковых пальцев» Соединение негомологичных концов Гомологичная рекомбинация Активация систем репарации
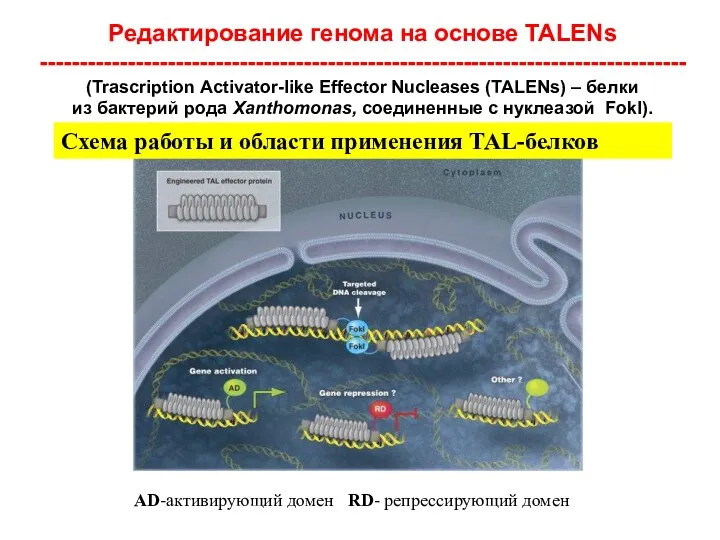
- 23. Редактирование генома на основе TALENs ---------------------------------------------------------------------------------(Trascription Activator-like Effector Nucleases (TALENs) – белки из бактерий рода Xanthomonas,
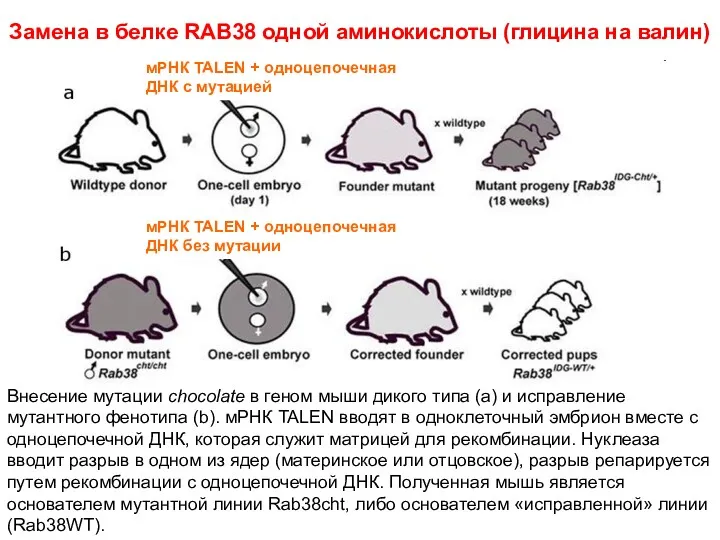
- 24. Замена в белке RAB38 одной аминокислоты (глицина на валин) мРНК TALEN + одноцепочечная ДНК с мутацией
- 25. CRISPR (от англ. clustered regularly interspaced short palindromic repeats — короткие палиндромные — короткие палиндромные повторы,
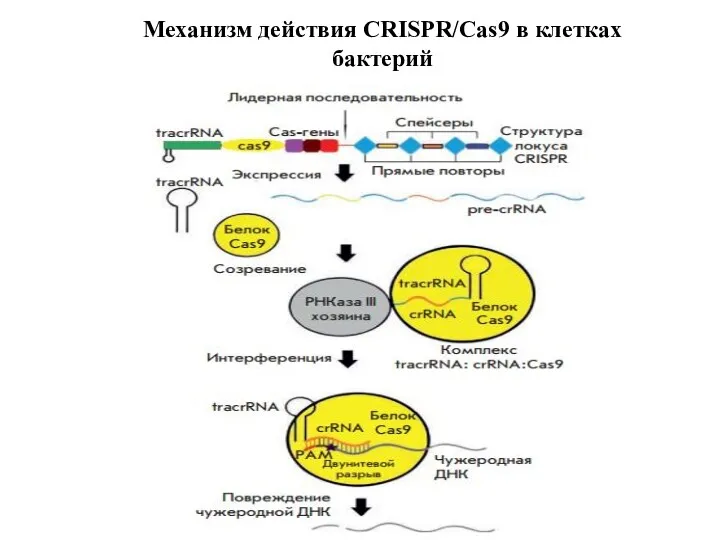
- 26. Механизм действия CRISPR/Cas9 в клетках бактерий
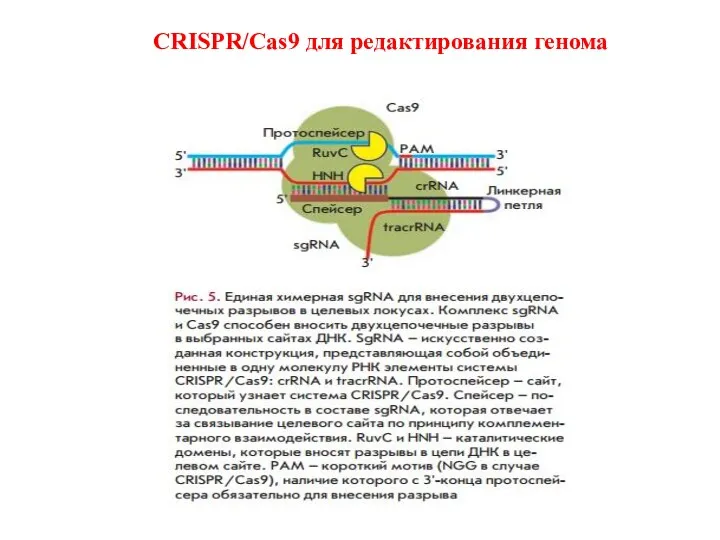
- 27. CRISPR/Cas9 для редактирования генома
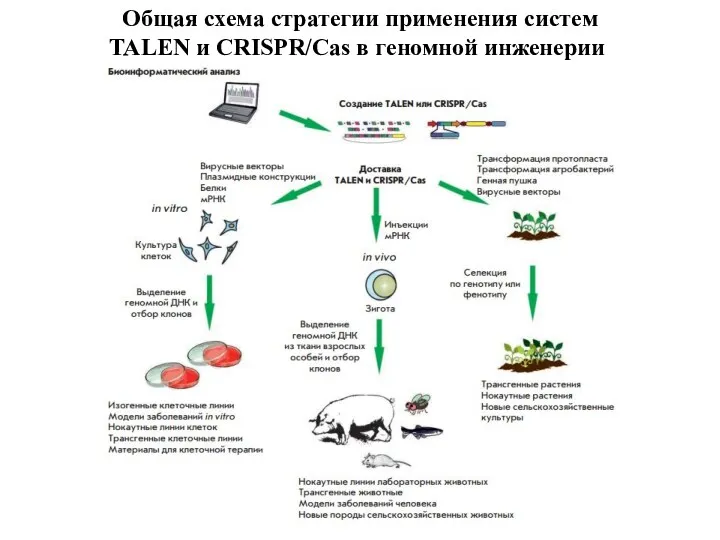
- 28. Общая схема стратегии применения систем TALEN и CRISPR/Cas в геномной инженерии
- 29. Впервые в мире технологию CRISPR/Cas9 для модификации эмбрионов человека применили исследователи из Университета Сунь Ятсена в
- 30. Осуществлена коррекция локуса CFTR (муковис-цидозный регулятор трансмембранной проводимости) в культивируемых интестинальных стволовых клетках, полученных от больных
- 32. Искусственная хромосома Содержит три основных элемента: 1) концевые участки (теломеры), 2) центромеру, 3) точки инициации репликации.
- 34. Скачать презентацию















 Животные жарких стран. Для дошкольников
Животные жарких стран. Для дошкольников Роль витаминов для организма человека, нормы их потребления и содержание в продуктах питания
Роль витаминов для организма человека, нормы их потребления и содержание в продуктах питания Імунітет. Імунна система
Імунітет. Імунна система Размножение и воспроизведение. Морфология цветка
Размножение и воспроизведение. Морфология цветка Parts of Human Skeleton
Parts of Human Skeleton Царство животные. Общая характеристика. Классификация животных
Царство животные. Общая характеристика. Классификация животных Мир пернатых. Урок-соревнование
Мир пернатых. Урок-соревнование Бионика
Бионика Класс двудольные. Семейство крестоцветные. Род капуста
Класс двудольные. Семейство крестоцветные. Род капуста Розмноження птахів
Розмноження птахів Культуры животных клеток
Культуры животных клеток Майстерність маскування
Майстерність маскування Опасные медузы
Опасные медузы Бейімделу физиологиясы
Бейімделу физиологиясы Тестирование экспресс-методов определения фальсификации меда
Тестирование экспресс-методов определения фальсификации меда Семейство Пасленовые
Семейство Пасленовые Терморегуляция
Терморегуляция Нуклеин қышқылдары ДНҚ
Нуклеин қышқылдары ДНҚ Механизм превращения азотосодержащих веществ в природе
Механизм превращения азотосодержащих веществ в природе Зуби ссавців
Зуби ссавців Открытое мероприятие по профилактике вредных привычек
Открытое мероприятие по профилактике вредных привычек Пресс-обзор. Детские журналы о природе
Пресс-обзор. Детские журналы о природе Витамины для зрения
Витамины для зрения Внеклассное мероприятие по биологии в 7-8 классах на тему: Мы- за здоровье!
Внеклассное мероприятие по биологии в 7-8 классах на тему: Мы- за здоровье! Химический состав клетки
Химический состав клетки Удивительное животное. Дельфин
Удивительное животное. Дельфин ДНҚ құрылымы
ДНҚ құрылымы Витамины
Витамины