Содержание
- 2. Исторические факты. Тростниковый сахар был известен человеку давно. Родиной сахарного тростника считают Индию. Белые куски использовались
- 3. Сахар в Европе. В Европе сахар был открыт в 1747 году. Немецкий химик Андреас Сигизмунд Маргграф,
- 4. Разновидности сахара. Из сладких плодов и ягод был выделен виноградный сахар, впоследствии глюкоза. В составе меда
- 5. Углеводы. Несмотря на разные источники получения углеводов, различную степень сладости, состав всех этих веществ, на удивление,
- 6. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода. Общая формула: Сn(Н2О)m
- 7. Получение В растениях углеводы образуются из оксида углерода (IV) и воды в процессе фотосинтеза, осуществляемого за
- 8. Функции углеводов Энергетическая: поставка энергии для мозговой деятельности за счет окисления глюкозы. Пластическая: принимают участие в
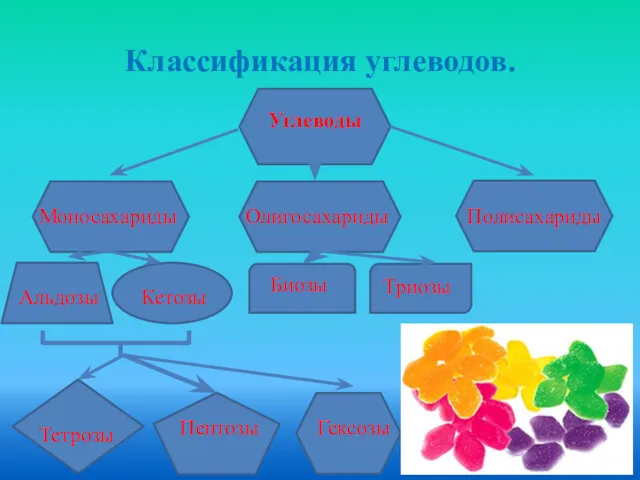
- 9. Классификация углеводов. Углеводы Моносахариды Олигосахариды Полисахариды Альдозы Кетозы Триозы Биозы Пентозы Гексозы Тетрозы
- 10. Определения углеводов. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем
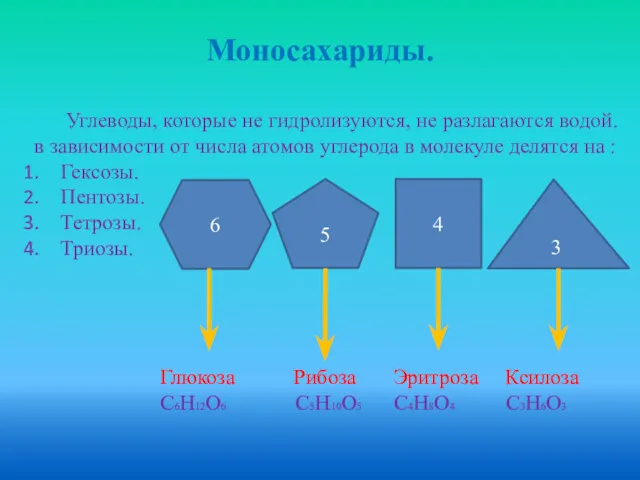
- 11. Моносахариды. Углеводы, которые не гидролизуются, не разлагаются водой. в зависимости от числа атомов углерода в молекуле
- 12. Важнейшие моносахариды: строение, свойства. Глюкоза: Самый распространенный моносахарид. Содержится в соке винограда, других ягод и фруктов.
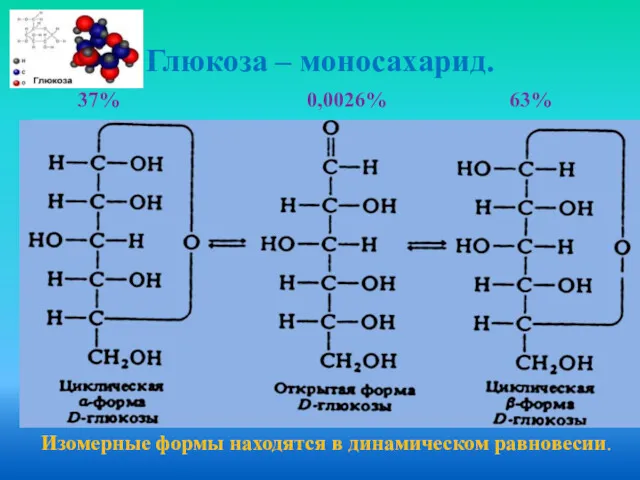
- 13. Глюкоза – моносахарид. 37% 0,0026% 63% Изомерные формы находятся в динамическом равновесии.
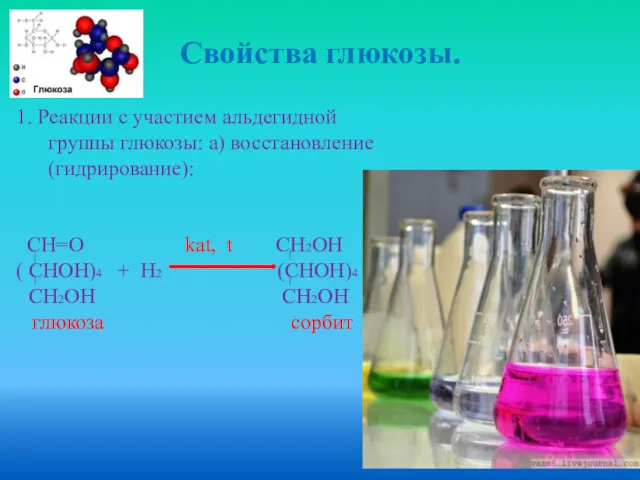
- 14. Свойства глюкозы. 1. Реакции с участием альдегидной группы глюкозы: а) восстановление (гидрирование): СН=О kat, t СН2ОН
- 15. Свойства глюкозы. б) окисление альдегидной группы. Качественная реакция на глюкозу как альдегид – реакция «серебряного зеркала»:
- 16. Свойства глюкозы. Окисление свежеполученным раствором гидроксида меди при нагревании: t СН2ОН –(СНОН)4- СН=О + 2Сu(OH)2 желтый
- 17. Свойства глюкозы. Реакции глюкозы как многоатомного спирта (качественная реакция): а) взаимодействие с гидроксидом меди (II) на
- 18. Свойства глюкозы. Реакции глюкозы как многоатомного спирта: б) образование сложных эфиров: Н2SO4(H+) СН2ОН(СНОН)4 – СН –О
- 19. Свойства глюкозы. 3.Реакции брожения (ферментации). Действуют особые биологические катализаторы белковой природы – ферменты (Ф): 2С2Н5ОН +
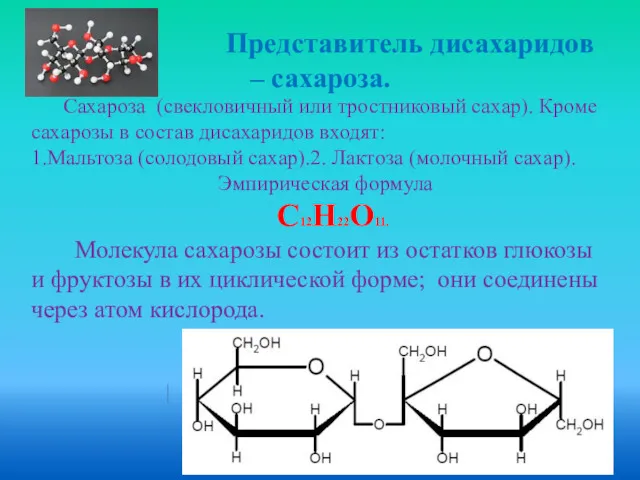
- 20. Представитель дисахаридов – сахароза. Cахароза (свекловичный или тростниковый сахар). Кроме сахарозы в состав дисахаридов входят: 1.Мальтоза
- 21. Свойства сахарозы. 1. В химическом отношении сахароза довольно инертна. 2. Не проявляет восстановительных свойств. 3. Важнейшим
- 22. Полисахариды. Крахмал и целлюлоза (С6Н10О5)n и гликоген.
- 23. Полисахариды. По внешнему виду ничем не напоминают сахаристые вещества: имеют аморфную структуру; в воде не растворяются
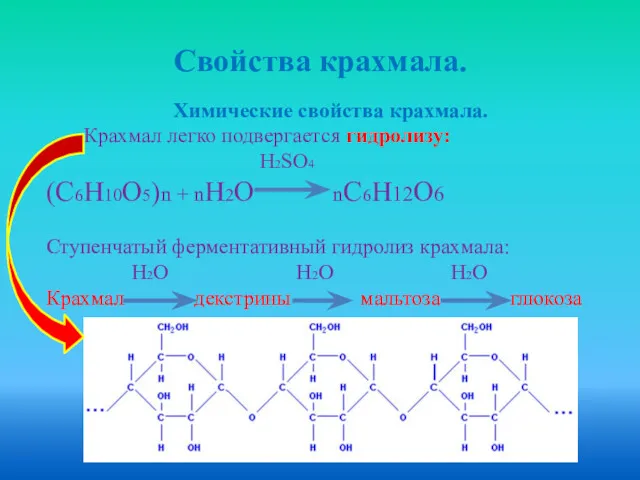
- 24. Свойства крахмала. Химические свойства крахмала. Крахмал легко подвергается гидролизу: H2SO4 (С6Н10О5)n + nH2O nC6H12O6 Ступенчатый ферментативный
- 25. Свойства крахмала. Окрашивание крахмала раствором иода. Признак реакции - изменение цвета раствора с белого на сине
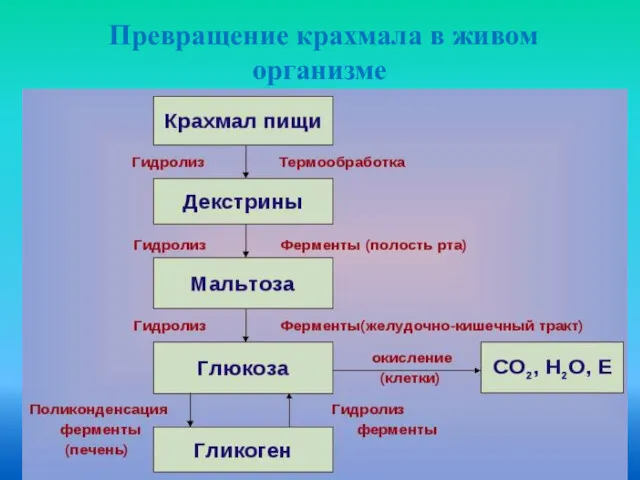
- 26. Превращение крахмала в живом организме
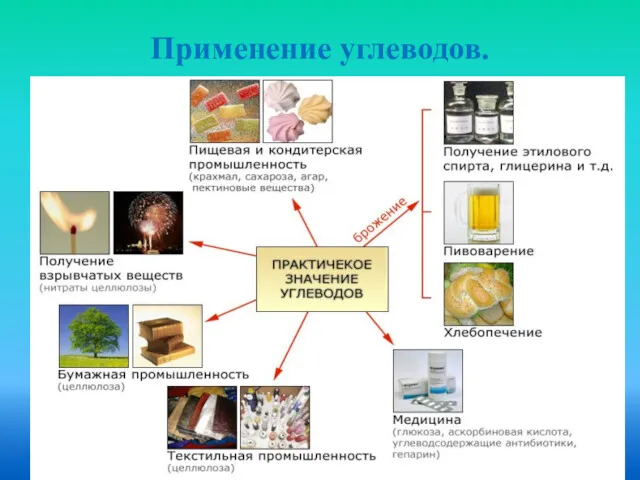
- 27. Применение углеводов.
- 29. Скачать презентацию


















 Энергетический обмен. Взаимосвязь обмена веществ и энергии. Лекция №3
Энергетический обмен. Взаимосвязь обмена веществ и энергии. Лекция №3 Пищеварение в кишечнике. 8 класс
Пищеварение в кишечнике. 8 класс Транспорт веществ в живом организме. Урок биологии в 11 классе
Транспорт веществ в живом организме. Урок биологии в 11 классе Жизнь организмов на планете Земля. Природные сообщества
Жизнь организмов на планете Земля. Природные сообщества Класс млекопитающие или звери
Класс млекопитающие или звери Птицы в Санкт-Петербурге
Птицы в Санкт-Петербурге Размножение цветковых растений
Размножение цветковых растений Скватинтәрізділер акулалар отряды немесе Теңіз періштелері --Squatiniformes
Скватинтәрізділер акулалар отряды немесе Теңіз періштелері --Squatiniformes Эмбриональное развитие организмов
Эмбриональное развитие организмов Цитоплазма. ЭПС
Цитоплазма. ЭПС Клетка – структурная и функциональная единица жизни
Клетка – структурная и функциональная единица жизни Птицы наши друзья и соседи
Птицы наши друзья и соседи Красная книга России. Растения
Красная книга России. Растения Популяция. Основные показатели популяции
Популяция. Основные показатели популяции Международный день полярного медведя
Международный день полярного медведя Тип кишечнополостные пресноводный полип гидра
Тип кишечнополостные пресноводный полип гидра Пагін. Його будова
Пагін. Його будова Пищеварительная система человека
Пищеварительная система человека Биология и жизнь
Биология и жизнь Происхождение человека. Классификация приматов
Происхождение человека. Классификация приматов Матричные процессы
Матричные процессы Радиационная безопасность населения
Радиационная безопасность населения Земледелие. Введение
Земледелие. Введение Влияние радиоактивных излучений на живые организмы
Влияние радиоактивных излучений на живые организмы Сорные растения и их вредность
Сорные растения и их вредность Гипофиз, гипоталамус гормондары
Гипофиз, гипоталамус гормондары Необычное в природе
Необычное в природе Этапы развития жизни на Земле
Этапы развития жизни на Земле