Содержание
- 2. БИОХИМИЯ Это наука, занимающаяся изучением различных молекул, химических реакций и процессов, протекающих в живых клетках и
- 3. Благодаря биохимическим исследованиям можно: • выявить причину болезни • предложить рациональный и эффективный путь лечения •
- 4. Главная задача биохимии Достижение полного понимания на молекулярном уровне всех химических процессов, связанных с жизнедеятельностью клеток.
- 5. Сфера биохимии Изучение химических реакций, протекающих во всех организмах Способствует развитию биохимии: • изучение болезней изучение
- 6. Связь биохимии с другими науками: Генетика Физиология Иммунология Фармакология и фармация Токсикология Патология Зоология и ботаника
- 7. Этапы развития биохимии
- 8. Эмиль Фишер (1852-1919)
- 9. 1953г. Нобелевская премия в области физиологии и медицины Hans Adolf Krebs (UK) Fritz Albert Lipmann (USA)
- 10. 1953г. – Структура репликационной модели ДНК Francis Crick James Watson Frederick Wilkins
- 11. Методы исследования в биохимии 1. Исследование на целом организме (in vivo) а) Метод нагрузок б) Метод
- 12. Общий экспериментальный подход, используемый в биохимии 1. Выделение биомолекул и органелл, находящихся в клетке 2. Определение
- 13. СТРУКТУРА И ФУНКЦИИ БЕЛКОВ © 2010, Ш.Н.Галимов
- 14. БЕЛКИ Высокомолекулярные природные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью; являются главной составной частью живых
- 15. КЛАССИФИКАЦИЯ БЕЛКОВ I. Функциональная II. По форме молекулы Фибриллярные (нитевидные) коллаген Глобулярные (шаровидные) (альбумины, глобулины) III.
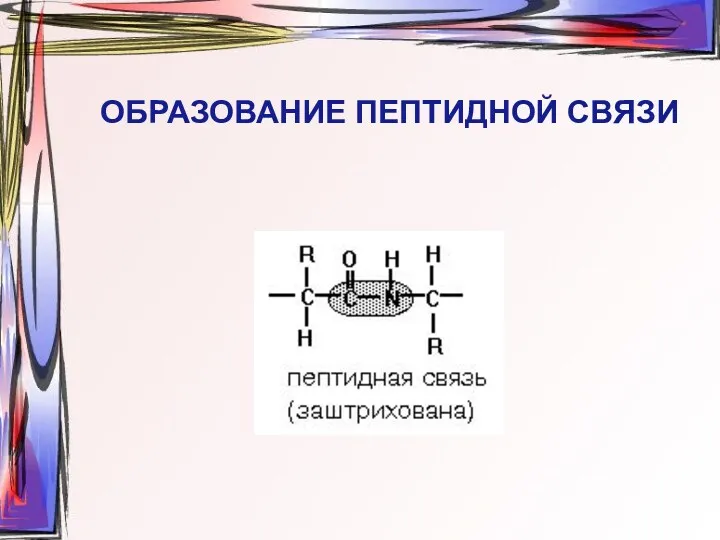
- 16. ОБРАЗОВАНИЕ ПЕПТИДНОЙ СВЯЗИ
- 18. Постулаты Л.Полинга и Р.Кори 1. Вращение атомов вокруг пептидной связи невозможно (копланарность) 2. Все аминокислоты (искл.
- 19. Водородная связь
- 20. Первичная структура белка Это конфигурация полипептидной цепи, которая формируется в результате образования пептидных связей между остатками
- 21. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА Это локальная конформация полипептидной цепи, обусловленная вращением отдельных участков вокруг одинарных ковалентных связей.
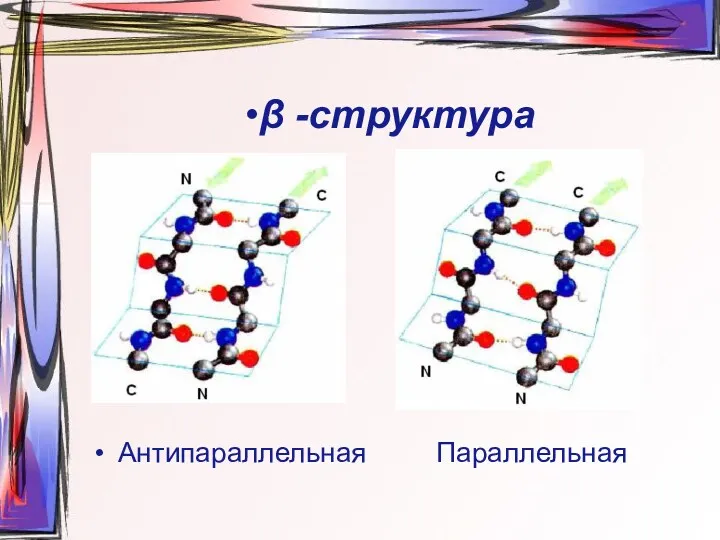
- 22. •β -структура Антипараллельная Параллельная
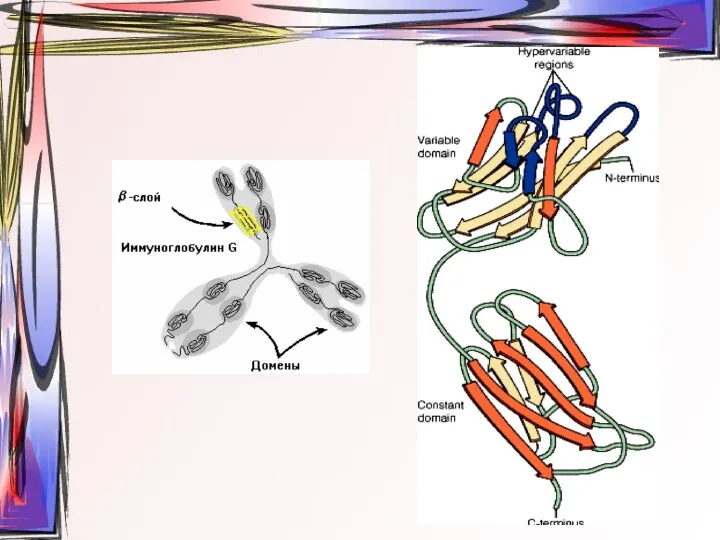
- 23. β-слой
- 25. ТРЕТИЧНАЯ СТРУКТУРА Расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют локальную конформацию СВЯЗИ, СТАБИЛИЗИРУЮЩИЕ
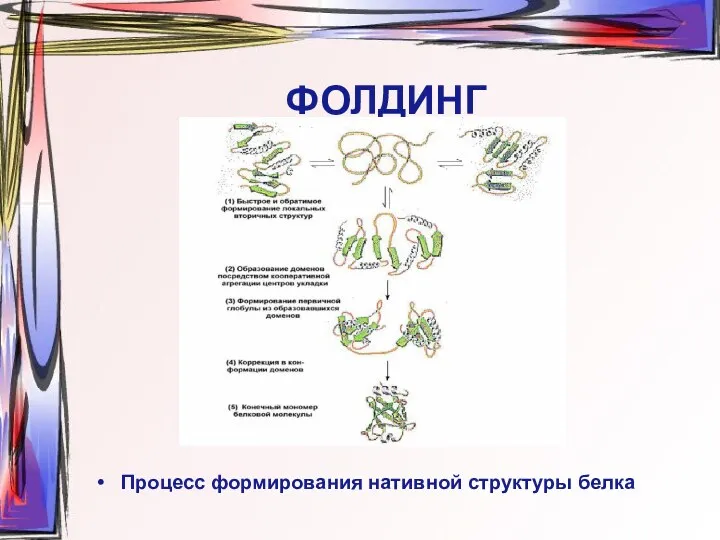
- 26. ФОЛДИНГ Процесс формирования нативной структуры белка
- 27. ЧЕТВЕРТИЧНАЯ СТРУКТУРА Объединение нескольких полипептидных цепей, имеющих третичную структуру, ведущее к возникновению новой функции молекулы. Подобные
- 28. ПРЕИМУЩЕСТВА белков с четвертичной структурой 1.Экономия генетического материала 2. Уменьшение числа ошибок при синтезе белка 3.
- 30. Скачать презентацию























 Этические проблемы использования животных
Этические проблемы использования животных Пищеварение 1.1
Пищеварение 1.1 Общие признаки животных. 5 класс
Общие признаки животных. 5 класс Ретикулярная формация. Лимбическая система. Оболочки мозга
Ретикулярная формация. Лимбическая система. Оболочки мозга Хемосинтез. Хемосинтезирующие организмы
Хемосинтез. Хемосинтезирующие организмы Визначення типу шкіри на різних ділянках обличчя та складання правил догляду за власною шкірою
Визначення типу шкіри на різних ділянках обличчя та складання правил догляду за власною шкірою Прокариоты на службе по защите почвенной среды жизни от тяжёлых металлов
Прокариоты на службе по защите почвенной среды жизни от тяжёлых металлов Прісноводна гідра
Прісноводна гідра Zebra is a striped member of the horse family
Zebra is a striped member of the horse family Голоса птиц
Голоса птиц Імунітет рослин до інфекційних хвороб
Імунітет рослин до інфекційних хвороб Морфологическое описание растения
Морфологическое описание растения Презентация по биологии для учащихся 9 класса по теме Клеточная мембрана
Презентация по биологии для учащихся 9 класса по теме Клеточная мембрана Про кошек
Про кошек Презентация к уроку биологии в 7 классе Отряд Жесткокрылые, или Жуки
Презентация к уроку биологии в 7 классе Отряд Жесткокрылые, или Жуки Транскрипция и трансляция. Генетическая трансформация
Транскрипция и трансляция. Генетическая трансформация Китообразные и ластоногие
Китообразные и ластоногие Породы кошек
Породы кошек Классификация и характеристика рыб
Классификация и характеристика рыб Строение клеток прокариот и эукариот
Строение клеток прокариот и эукариот Органы и системы органов
Органы и системы органов Мед - пчелиная заслуга
Мед - пчелиная заслуга Микробиология - наука о микроорганизмах
Микробиология - наука о микроорганизмах Карл Линней - основоположник биологической систематики
Карл Линней - основоположник биологической систематики Движение крови в организме. Органы кровообращения
Движение крови в организме. Органы кровообращения Приглашение на семинар по управлению инкубаторием компании Пас Реформ
Приглашение на семинар по управлению инкубаторием компании Пас Реформ Витамины красоты
Витамины красоты Внеклассное мероприятие Красная книга Оренбургской области
Внеклассное мероприятие Красная книга Оренбургской области