Содержание
- 2. Химия и окружающая среда Химия переживает трудные времена: потребность в разных химикатах и химических продуктах в
- 3. Почему у химической промышленности плохая репутация? Плохая репутация (image) химии в значительной мере обусловлена ее влиянием
- 4. Насколько химия и химическая технология должны меняться? Путь 20-го века начинай с нефтяного сырья растворяй это
- 5. Химия и окружающая среда There is a sufficiency in the world for man’s need, but not
- 6. Атмосфера Атмосфера – самая легкая составляющая окружающей среды. Она составляет только 0,2% от массы гидросферы и
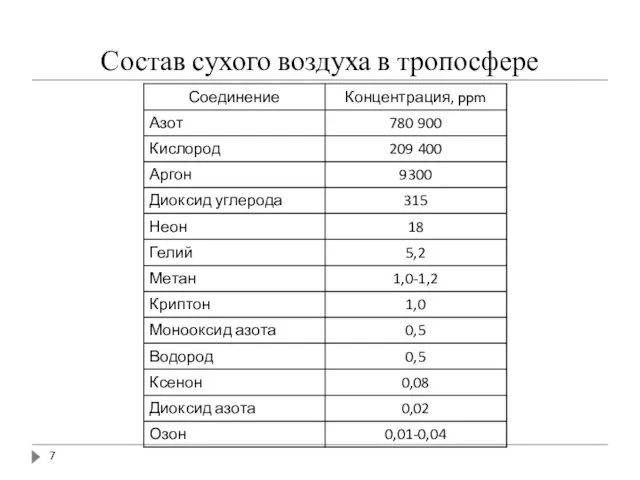
- 7. Состав сухого воздуха в тропосфере
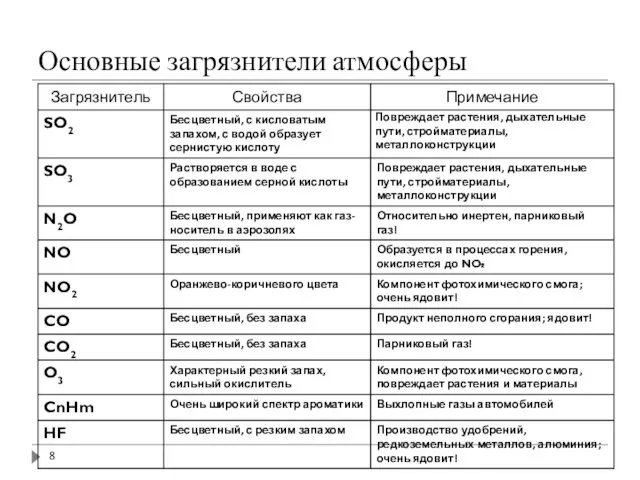
- 8. Основные загрязнители атмосферы
- 9. Классификация загрязнителей атмосферы Все атмосферные загрязнители подразделяют на 3 группы: первичные или примарные (primary) - те,
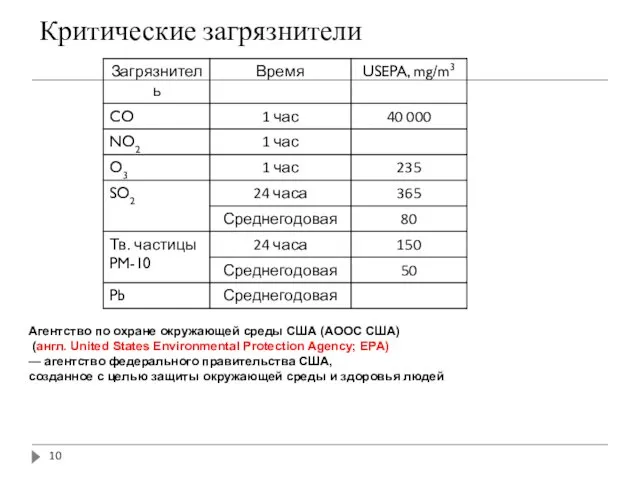
- 10. Критические загрязнители Агентство по охране окружающей среды США (АООС США) (англ. United States Environmental Protection Agency;
- 11. Единицы выражения концентрации газов мг/м3; мкг/м3; ppm (v/v); ppb (v/v). Здесь: Nм3 = нормальный м3 v/v
- 12. Соединения серы (SO₂) SO2 является первичным и критическим загрязнителем. Подавляющее большинство топлив содержит серу: в каменном
- 13. Соединения серы (SO₂) Как SO2 так и Н2SO4 в достаточных концентрациях оказывают вредное влияние на природу
- 14. Соединения азота NOx Газообразные выбросы тепловых электростанций и печей содержат в основном NО вместе с 10%
- 15. Соединения азота NOx NO2 очень токсичен, сильно раздражает дыхательные пути NО относительно инертен, умеренно токсичен NO2
- 16. Оксид углерода СО Это, в основном, антропогенный загрязнитель, который эмитируется из двигателей внутреннего сгорания (транспорт -
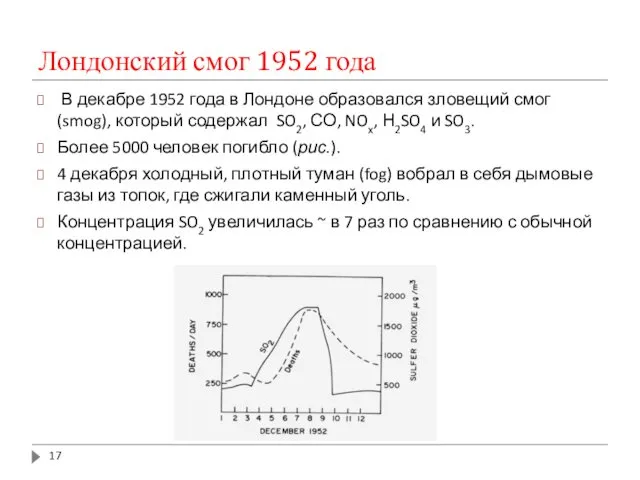
- 17. Лондонский смог 1952 года В декабре 1952 года в Лондоне образовался зловещий смог (smog), который содержал
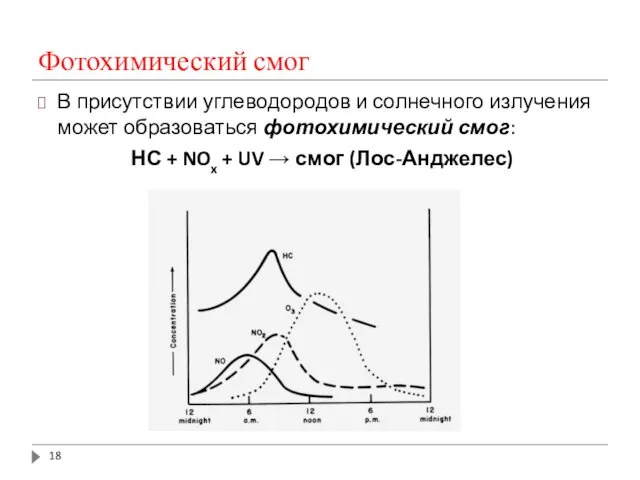
- 18. Фотохимический смог В присутствии углеводородов и солнечного излучения может образоваться фотохимический смог: НС + NOx +
- 19. Оксид углерода СО СО выводится из атмосферы очень медленно (!), только в результате его реакции с
- 20. Летучие органические соединения (ЛОС) Volatile Organic Compounds (VOC) Под летучими органическими соединениями (ЛОС) понимают любое органическое
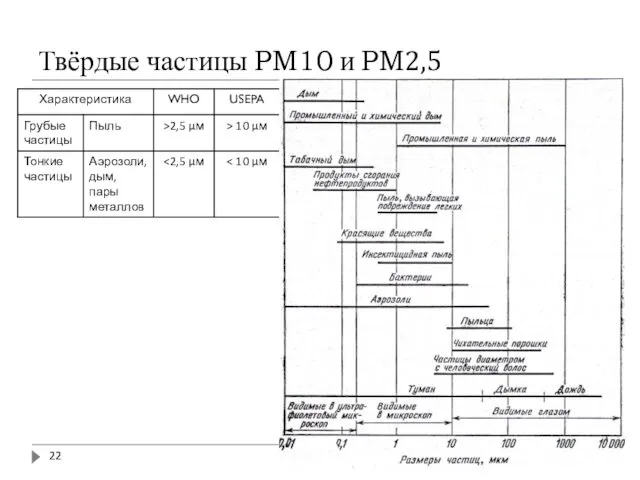
- 21. Твёрдые частицы PM10 и PM2,5 РМ10 (particulate matter – твёрдые частицы с диаметром до 10 μм)
- 22. Твёрдые частицы PM10 и PM2,5
- 23. Стойкие органические загрязнители (СОЗ) POP – persistant organic pollutants СОЗ - группа химических веществ, чрезвычайно устойчивых
- 24. ПАУ Polycyclic aromatic hydrocarbons (PAHs) Полициклические ароматические углеводороды (ПАУ) – органические соединения, для которых характерно наличие
- 25. Полихлорированные бифенилы/дифенилы Polychlorinated biphenyls (PCBs) Полихлорированные бифенилы (ПХБ)- группа органических соединений, включающая в себя все хлорзамещённые
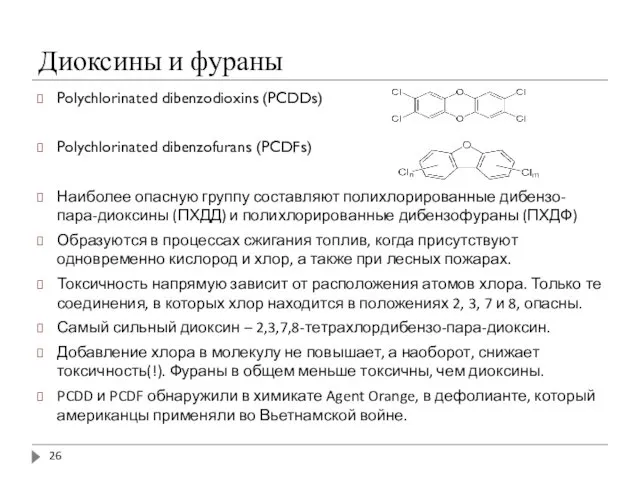
- 26. Диоксины и фураны Polychlorinated dibenzodioxins (PCDDs) Polychlorinated dibenzofurans (PCDFs) Наиболее опасную группу составляют полихлорированные дибензо-пара-диоксины (ПХДД)
- 27. Озон в тропосфере Тропосферный озон - вторичный загрязнитель (за редким исключением, например, Таллиннская водоочистная станция, выбрасывает
- 28. Озон в стратосфере Стратосферный озон необходим всем живым организмам на Земли! Озон поглощает опасную УФ-радиацию (λ
- 29. Озоновые дыры В 70-тые 20 века годы заговорили о проблеме разрушения озонового слоя. Ученые пришли к
- 30. Фреоны В холодильной технике используют фреоны (хладоны). Это хлорированные и фторированные углеводороды на базе метана (СН4)
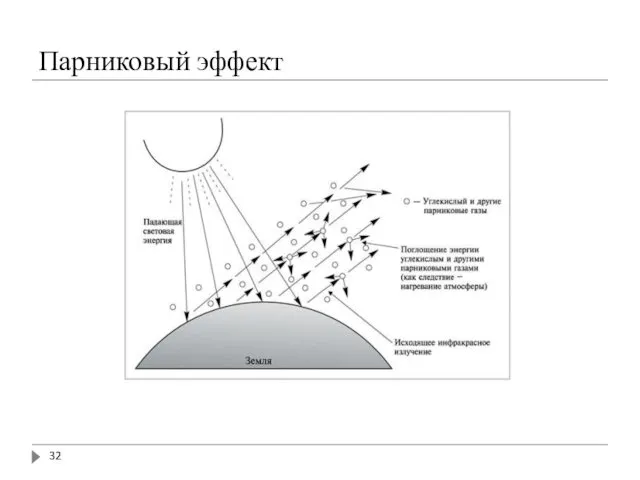
- 31. Парниковый эффект Greehouse effect Это явление очень важно с точки зрения последующего в этом курсе анализа
- 32. Парниковый эффект
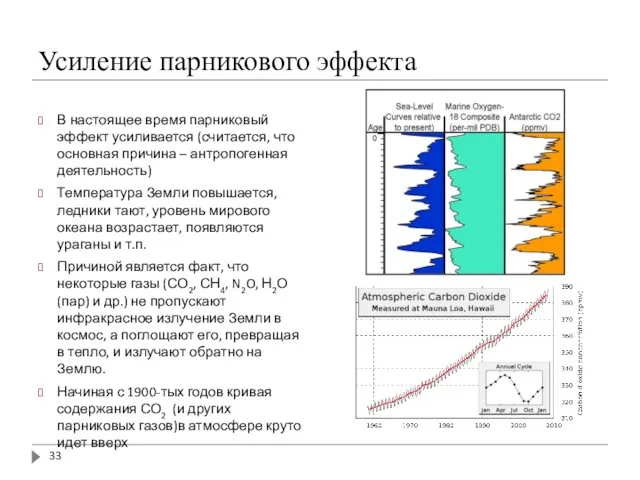
- 33. Усиление парникового эффекта В настоящее время парниковый эффект усиливается (считается, что основная причина – антропогенная деятельность)
- 34. Химикаты в воде и почве Исторически первыми загрязнителями в питьевой воде были не химические вещества, а
- 35. Тяжёлые металлы heavy metals Самые важные из них в воде и почве: As, Cd, Cr6+, Hg,
- 36. Тяжёлые металлы Ртуть (Hg) содержится в следовых количествах во многих минералах. Основным источником Hg являются современные
- 37. Пестициды Пестициды (лат. pestis — зараза и caedo — убиваю) - сельскохозяйственные ядохимикаты Подразделяют по объектам
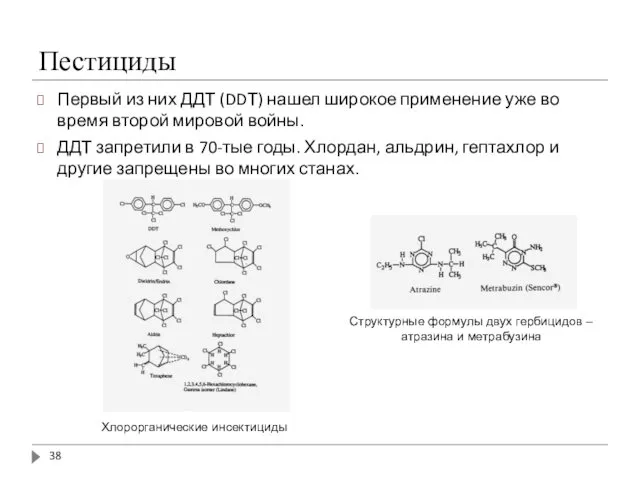
- 38. Пестициды Первый из них ДДТ (DDТ) нашел широкое применение уже во время второй мировой войны. ДДТ
- 39. Детергенты Детергент (лат. detergeo - стираю) – моющее средство (мыло, стиральные порошки, шампуни) Синтетические детергенты имеют
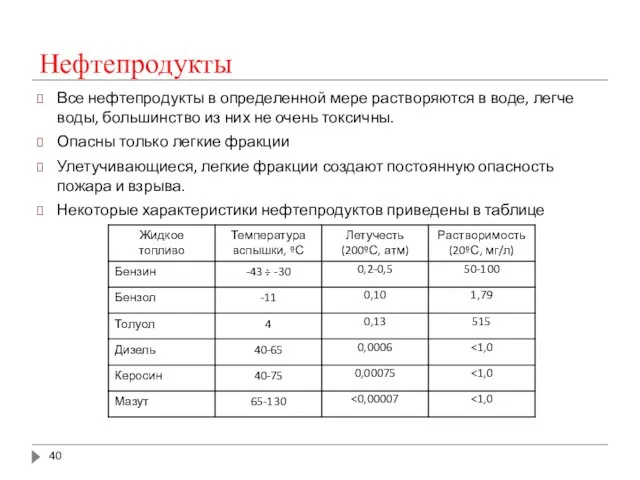
- 40. Нефтепродукты Все нефтепродукты в определенной мере растворяются в воде, легче воды, большинство из них не очень
- 41. Метилтретбутиловый эфир MTBE (methyl-tert-butylether) C(CH3)3OCH3 Известная добавка к бензинам (~ 11 об. %) для повышения октанового
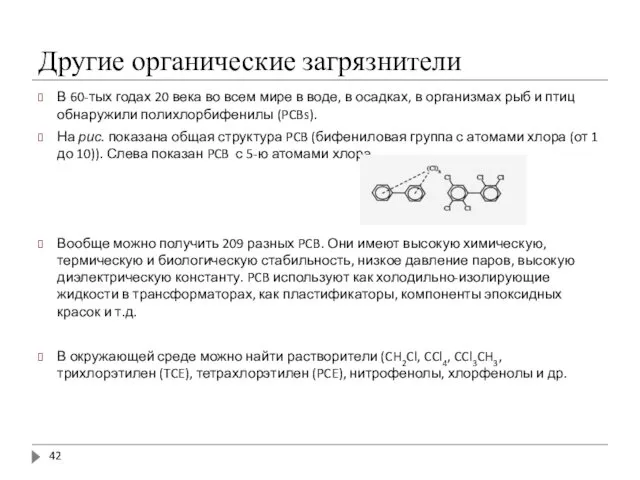
- 42. Другие органические загрязнители В 60-тых годах 20 века во всем мире в воде, в осадках, в
- 43. Токсичность После второй мировой войны в западных странах, а также в бывшем СССР, химическая промышленность росла
- 44. Токсичность Токсичность - степень проявления вредного действия разнообразных химических соединений и их смесей. Разделяют острую (акутную)
- 45. Измерение токсичности Полулетальная доза LD50 (Lethal Dose, 50% ), ЛД50 - средняя смертельная (летальная) доза токсического
- 46. Оценка токсичности Целью этой оценки является выявление зависимости между количеством токсичного вещества, которое человек получил с
- 47. Характеристика риска Характеристика риска – это оценка величины потенциального канцерогенного или неканцерогенного эффекта. Для неканцерогенных эффектов
- 49. Скачать презентацию


































 Эко эстафета. Интересные места в Гродно
Эко эстафета. Интересные места в Гродно Заповедники России
Заповедники России Проект по сбору макулатуры Бумажный Бум. Итоги
Проект по сбору макулатуры Бумажный Бум. Итоги Контроль и надзор в области природопользования и охраны природных ресурсов
Контроль и надзор в области природопользования и охраны природных ресурсов Экологический календарь
Экологический календарь Табиғи ортаның әлемдік деңгейде ластануы
Табиғи ортаның әлемдік деңгейде ластануы Космический мусор
Космический мусор Современные биотехнологии охраны окружающей среды
Современные биотехнологии охраны окружающей среды Мониторинг расселения ясеневой изумрудной златки в городе Брянске и в Погарском районе Брянской области
Мониторинг расселения ясеневой изумрудной златки в городе Брянске и в Погарском районе Брянской области Каспий теңізінің экологиялық жағдайы. Каспийдің маңындағы қалалар. Каспий теңізінің ғасырлар бойғы деңгейлік өзгерістері
Каспий теңізінің экологиялық жағдайы. Каспийдің маңындағы қалалар. Каспий теңізінің ғасырлар бойғы деңгейлік өзгерістері Изучение качеств родниковой воды в колодцах д. Корпово
Изучение качеств родниковой воды в колодцах д. Корпово Экологическое состояние территории микрорайона Кутузовский г. Ельни
Экологическое состояние территории микрорайона Кутузовский г. Ельни Эффективность природоохранной деятельности на предприятии
Эффективность природоохранной деятельности на предприятии Охрана природы Краснодарского края. Красная книга Кубани
Охрана природы Краснодарского края. Красная книга Кубани Гигиена воды
Гигиена воды Перспективы развития возобновляемых источников электроэнергии. Преимущества и недостатки
Перспективы развития возобновляемых источников электроэнергии. Преимущества и недостатки Zero waste fashion
Zero waste fashion Сообщества (биоценозы)
Сообщества (биоценозы) Причины возникновения экологических проблем в сельской местности
Причины возникновения экологических проблем в сельской местности День Земли
День Земли The rainforest are dying
The rainforest are dying Экологические проблемы Республики Карелии
Экологические проблемы Республики Карелии Cреда обитания организмов и её факторы
Cреда обитания организмов и её факторы Нарушение экологического равновесия
Нарушение экологического равновесия Школьная экологическая тропа
Школьная экологическая тропа Аутэкология. Температура как экологический фактор
Аутэкология. Температура как экологический фактор День Земли
День Земли экологическая игра О,отличник ,11 класс
экологическая игра О,отличник ,11 класс