Содержание
- 2. «Назначение человечества, похоже, заключается в том, чтобы уничтожить свой род, предварительно сделав Землю непригодной для обитания»
- 3. Экологические токсины Так условились называть вещества искусственного происхождения, обладающие особой опасностью для природной среды. К ним
- 4. Диоксины Группа хлорорганических соединений – полихлорированные дибензо-п-диоксины (ПХДД) и диоксиноподобные соединения. Чужеродные живым организмам вещества (ксенобиотики),
- 5. Пример диоксина: ДДТ ДДТ (ДихлорДифенилТрихлорметилметан) – пример классического инсектицида. Синтезирован в 1873 г. австрийским химиком Отмаром
- 6. Полициклические ароматические углеводороды (ПАУ) ПАУ – это химические соединения, состоящие из двух и более сцепленных бензольных
- 7. Пример ПАУ: бенз(а)пирен (С20Н12) Бенз(а)пирен является наиболее типичным химическим канцерогеном окружающей среды, он опасен для человека
- 8. Тяжелые металлы Термин тяжёлые металлы чаще рассматривается не с химической, а с медицинской и природоохранной точек
- 9. Тяжелые металлы: ртуть Ртуть (Hg) переносится со стоками промышленных вод и через атмосферу. В составе атмосферной
- 10. Тяжелые металлы: свинец Свинец (Pb) -- рассеянный элемент, содержащийся во всех компонентах окружающей среды: в горных
- 11. Экологические риски
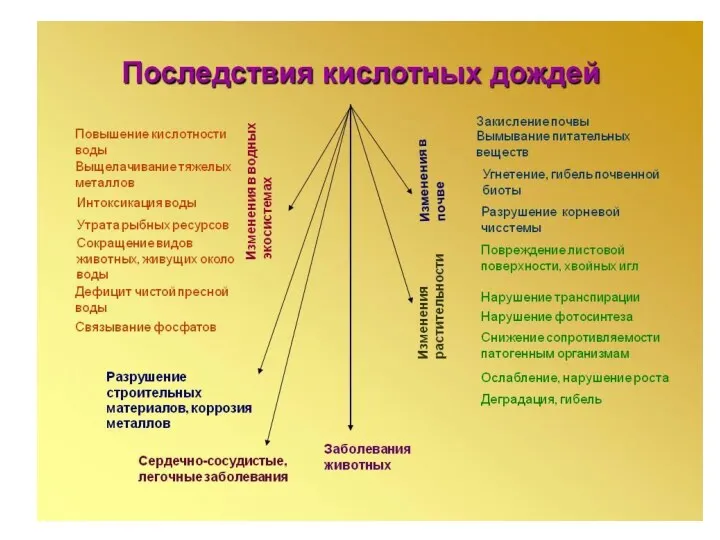
- 12. Кислотные дожди (КД) «Чистый» дождь имеет слегка кислую реакцию с рН 5,6, что соответствует равновесию между
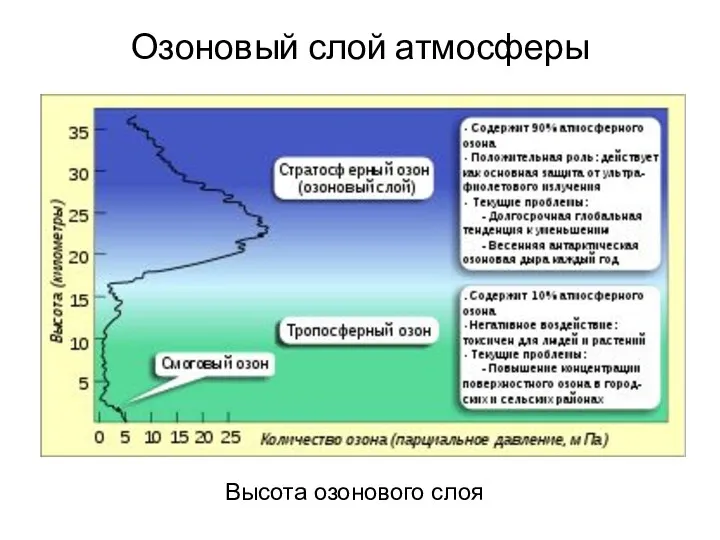
- 14. Озоновый слой атмосферы Высота озонового слоя
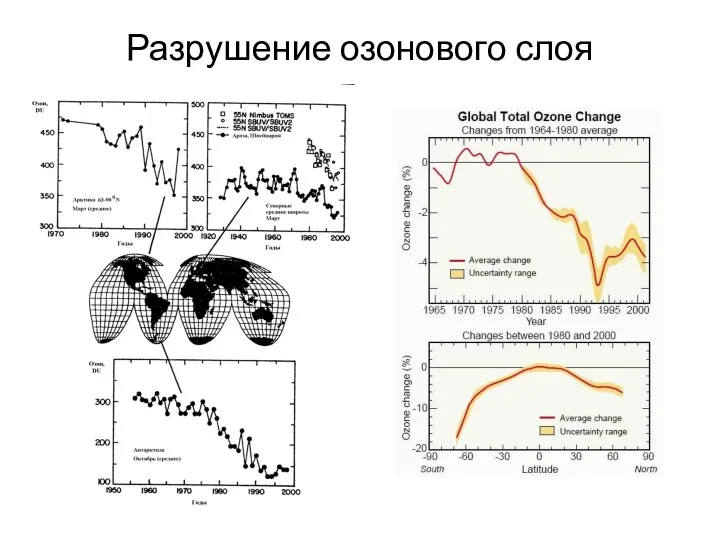
- 15. Динамика озонового слоя Озон (молекула O3), газ тяжелее воздуха с характерным запахом, в тропосфере является микропримесью,
- 16. Цикл Чепмена (Sydney Chapman) Образование озона: O2 + hν → 2 O при длине волны O
- 17. Разрушение озонового слоя
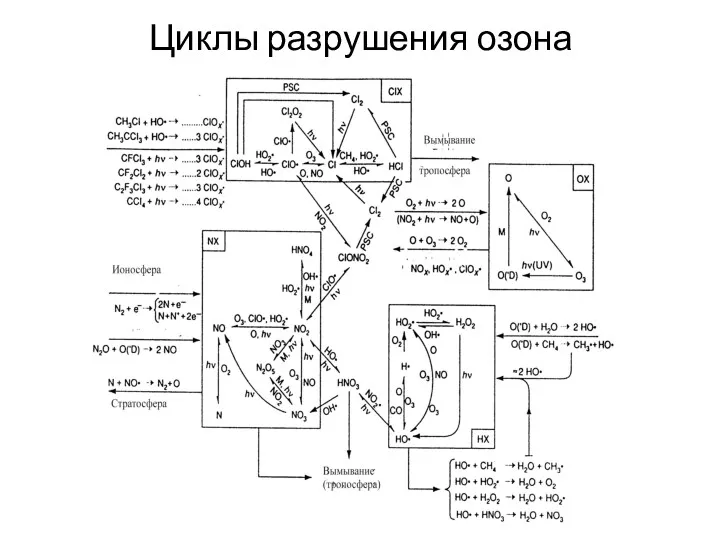
- 18. Циклы разрушения озона
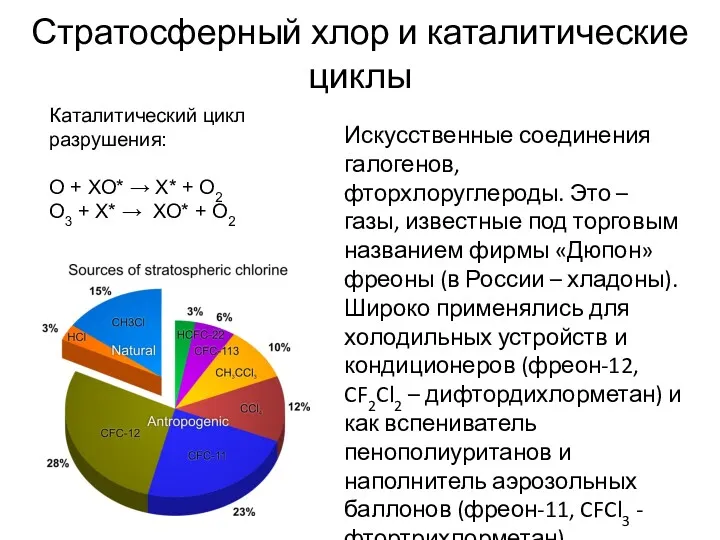
- 19. Стратосферный хлор и каталитические циклы Искусственные соединения галогенов, фторхлоруглероды. Это – газы, известные под торговым названием
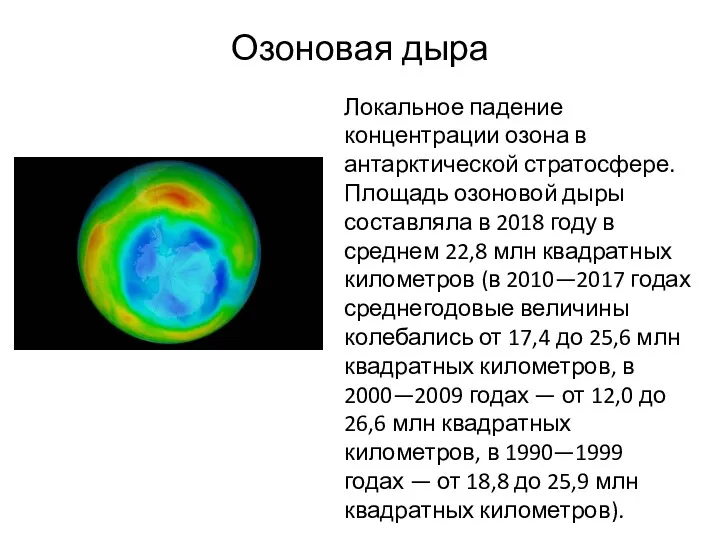
- 20. Озоновая дыра Локальное падение концентрации озона в антарктической стратосфере. Площадь озоновой дыры составляла в 2018 году
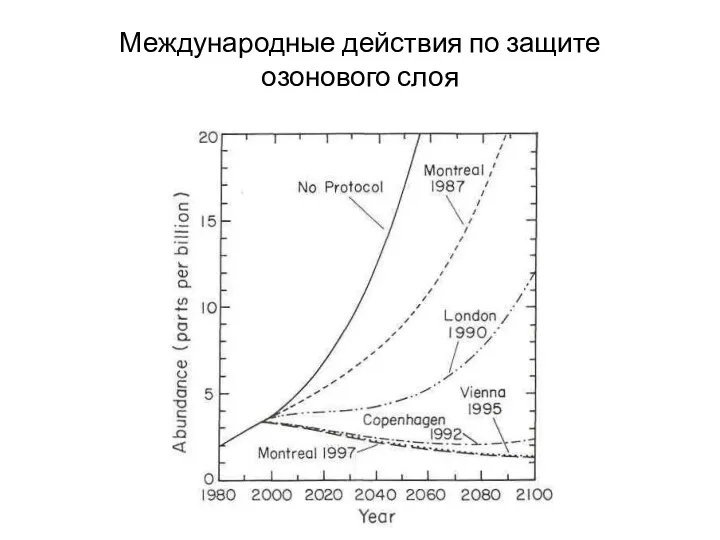
- 21. Международные действия по защите озонового слоя В 1995 г. присуждена Нобелевская премия по химии за работы
- 22. Международные действия по защите озонового слоя
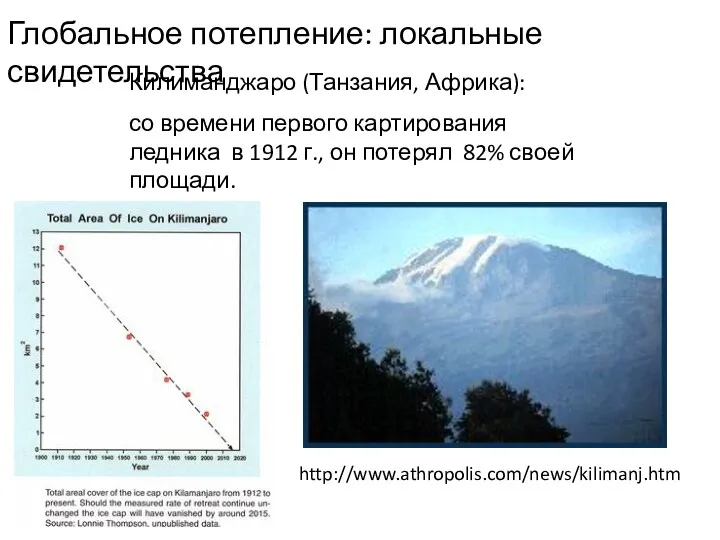
- 23. Килиманджаро (Танзания, Африка): со времени первого картирования ледника в 1912 г., он потерял 82% своей площади.
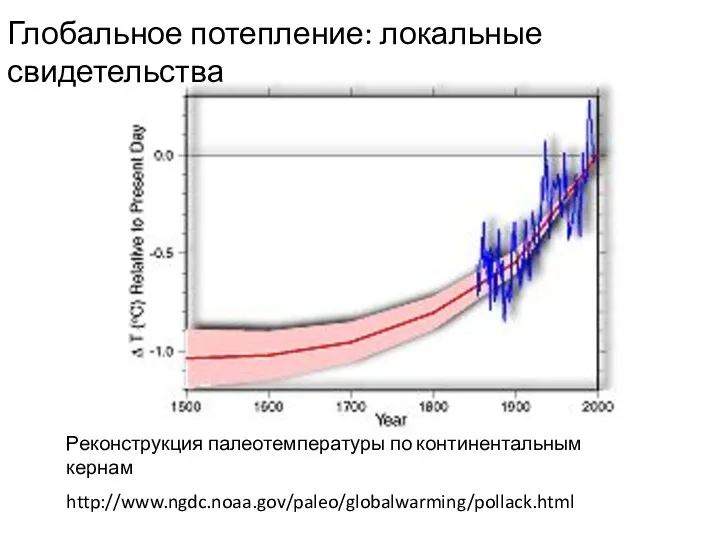
- 24. Реконструкция палеотемпературы по континентальным кернам http://www.ngdc.noaa.gov/paleo/globalwarming/pollack.html Глобальное потепление: локальные свидетельства
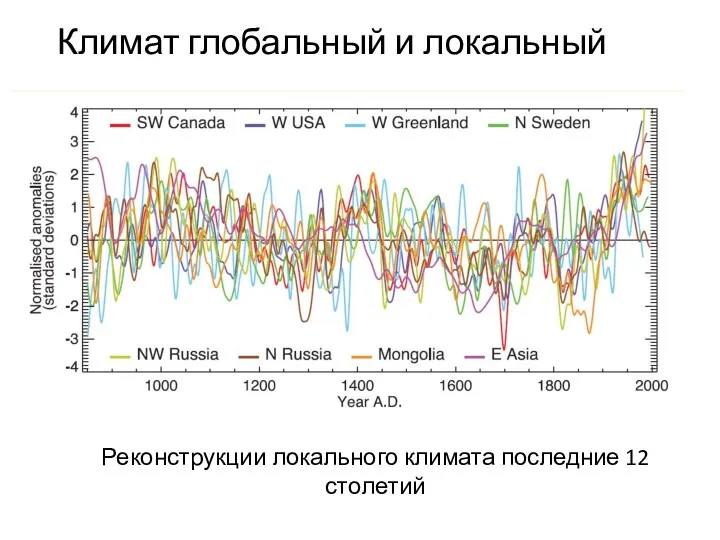
- 25. Климат глобальный и локальный Реконструкции локального климата последние 12 столетий
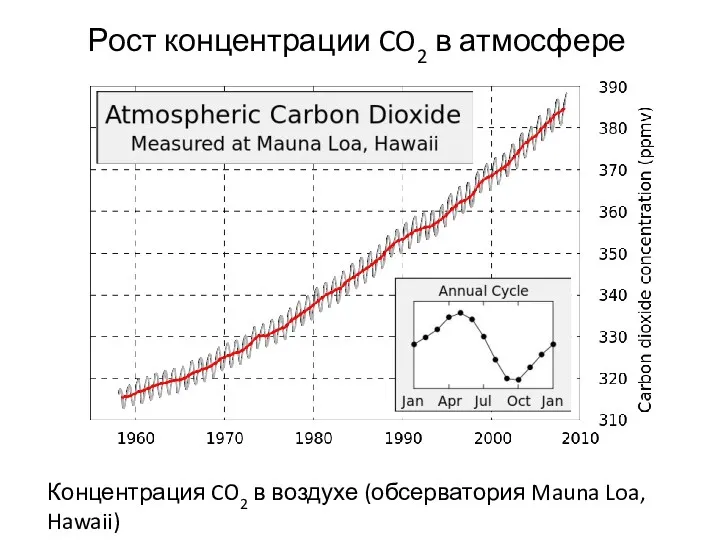
- 26. Рост концентрации CO2 в атмосфере Концентрация CO2 в воздухе (обсерватория Mauna Loa, Hawaii)
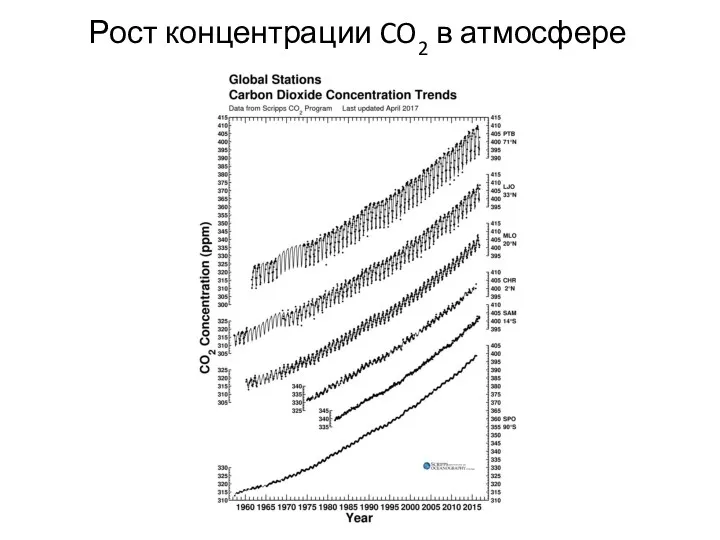
- 27. Рост концентрации CO2 в атмосфере
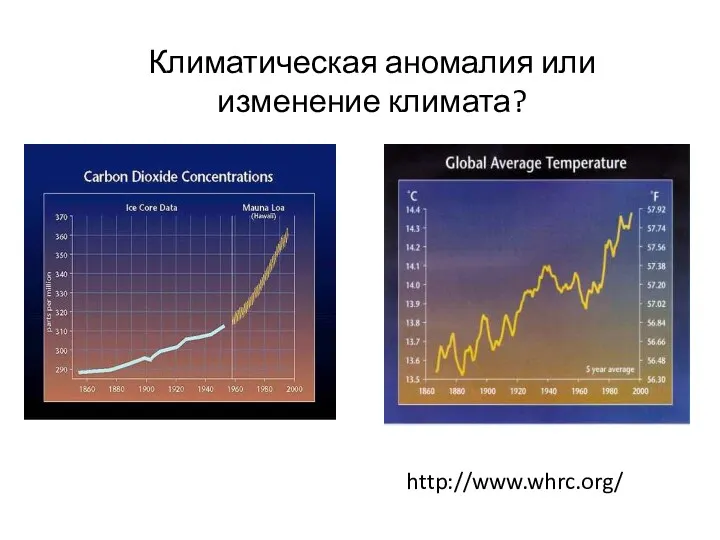
- 28. http://www.whrc.org/ Климатическая аномалия или изменение климата?
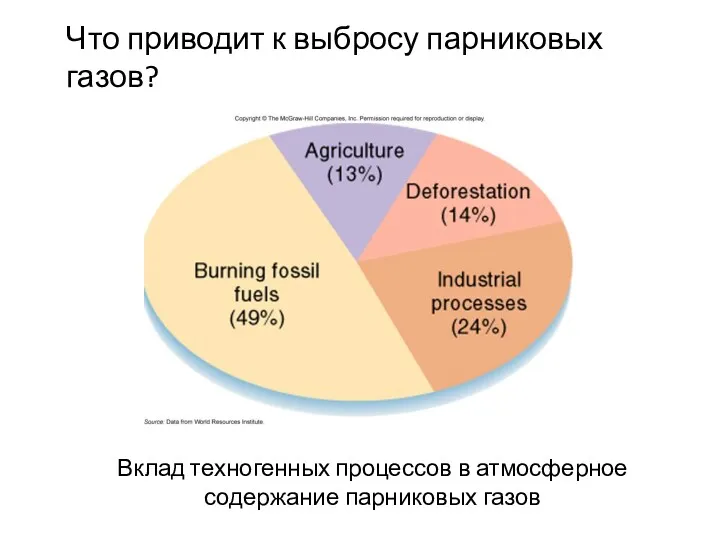
- 29. Вклад техногенных процессов в атмосферное содержание парниковых газов Что приводит к выбросу парниковых газов?
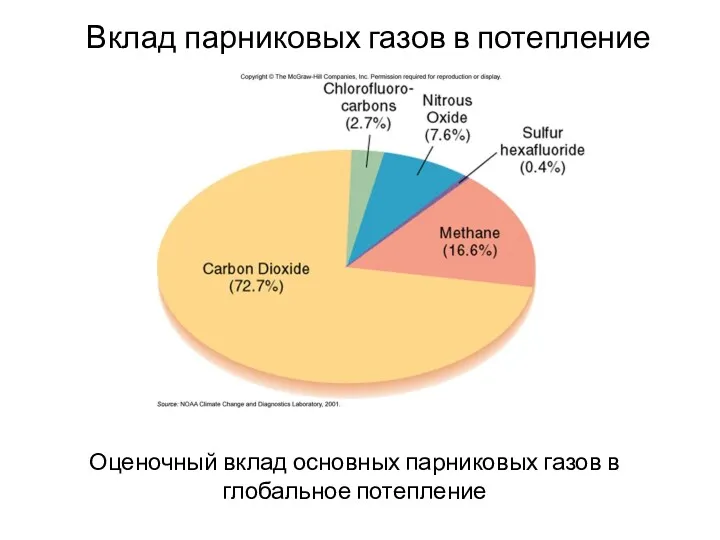
- 30. Оценочный вклад основных парниковых газов в глобальное потепление Вклад парниковых газов в потепление
- 32. Скачать презентацию














 Таксационные показатели насаждений
Таксационные показатели насаждений Час Земли
Час Земли Сьогоденні екологічні катастрофи, пов’язані з водою
Сьогоденні екологічні катастрофи, пов’язані з водою ЭкоТимуровцы
ЭкоТимуровцы Как человек изменял природу
Как человек изменял природу Глобальные экологические проблемы
Глобальные экологические проблемы Recycling. Photo powerpoint
Recycling. Photo powerpoint Биосферный купол
Биосферный купол Повторное использование пластика. Мастер-класс
Повторное использование пластика. Мастер-класс Нарушенные земли и общие подходы к их рекультивации
Нарушенные земли и общие подходы к их рекультивации Экология. Концепция взаимоотношений общества и природы
Экология. Концепция взаимоотношений общества и природы Влияние транспортной загрязнённости воздуха на эпифитные лишайники Первомайского сквера
Влияние транспортной загрязнённости воздуха на эпифитные лишайники Первомайского сквера Загрязнение пресных вод
Загрязнение пресных вод Ислледовательский подход в экологическом воспитании учащихся
Ислледовательский подход в экологическом воспитании учащихся Особливості сучасної цивілізації
Особливості сучасної цивілізації Полезный мусор
Полезный мусор Утрата видов, изменение фаун под воздействием человека. Тема 14
Утрата видов, изменение фаун под воздействием человека. Тема 14 Захист навколишнього середовища
Захист навколишнього середовища Экологические проблемы природной среды мегаполиса
Экологические проблемы природной среды мегаполиса Монреальская декларация дизайна
Монреальская декларация дизайна Презентация по экологии 8 класс Температура окружающей среды и участие кожи в терморегуляции
Презентация по экологии 8 класс Температура окружающей среды и участие кожи в терморегуляции Экология в Татарстане. Состояние воды: питьевая вода, водные ресурсы
Экология в Татарстане. Состояние воды: питьевая вода, водные ресурсы Луганська область
Луганська область Биоценоз. Структура биоценоза
Биоценоз. Структура биоценоза Рациональное использование водных ресурсов, недр и почвенных ресурсов
Рациональное использование водных ресурсов, недр и почвенных ресурсов Экологическое право
Экологическое право The rainforest are dying
The rainforest are dying Дефицит пресной воды в странах мира
Дефицит пресной воды в странах мира