Содержание
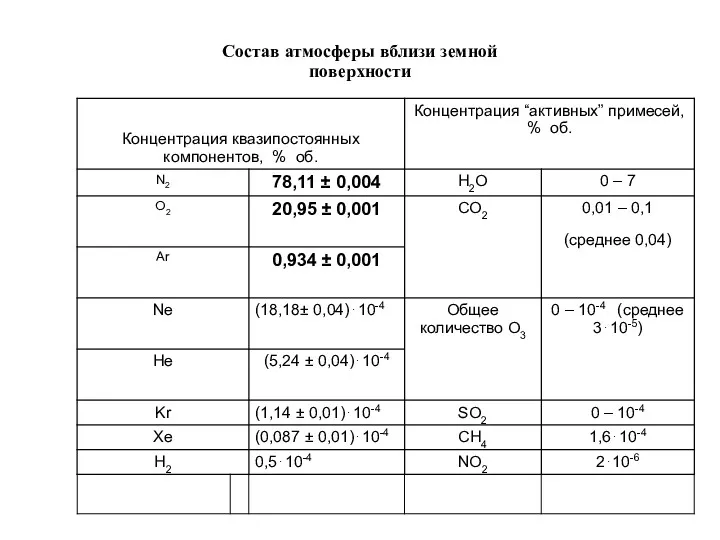
- 2. Состав атмосферы вблизи земной поверхности
- 3. Способы выражения концентрации примесей в воздухе Объемная доля – a a = v / V, где
- 4. Задача. Превышается ли и, если да, то во сколько раз, предельно допустимая максимально разовая концентрация для
- 5. Количество молекул в каждом кубическом сантиметре воздуха No (Молекул /см3 ) = N см-3 При нормальных
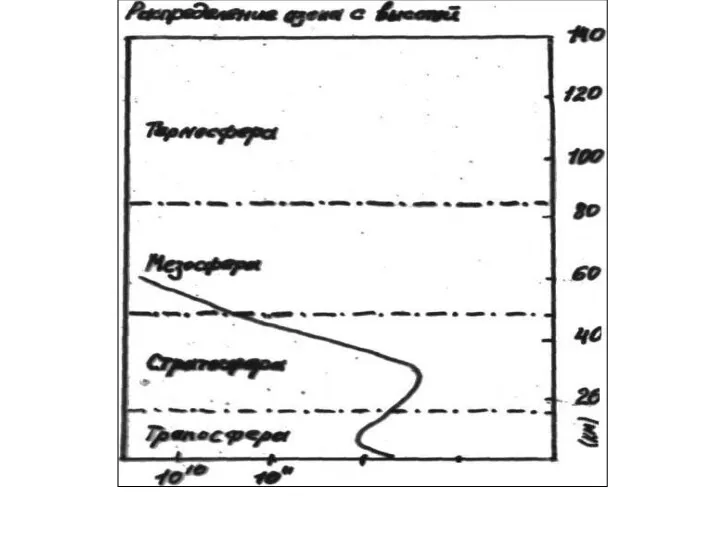
- 8. Озон в стратосфере образуется в результате взаимодействия отомарного и молекулярного кислорода в присутствии третьего тела O
- 9. Эти реакции были открыты в 1930 г. Сиднеем Чепманом И получили название ЦИКЛ ЧЕПМАНА
- 10. Разложение озона О + O3 = 2 O2 Циклические процессы разрушения озона Азотный цикл NO +
- 11. Опасность представляют только образующиеся непосредственно в стратосфере оксид и диоксид азота. Из тропосферы они не доходят
- 12. Хлорный цикл Cl + O3 → ClO + O2 ClO + O → Cl + O2
- 13. На высоте около 25 км вследствие высокой интенсивности солнечной радиации происходит разрушение ХФУ (фреонов) с выделением
- 14. Нобелевская премия по химии вручается с 1901 года Крутцен, Роуленд и Молина , Нобелевская премия по
- 15. Нобелевская премия по химии, 1995 «за работу по химии атмосферы, особенно в связи с образованием и
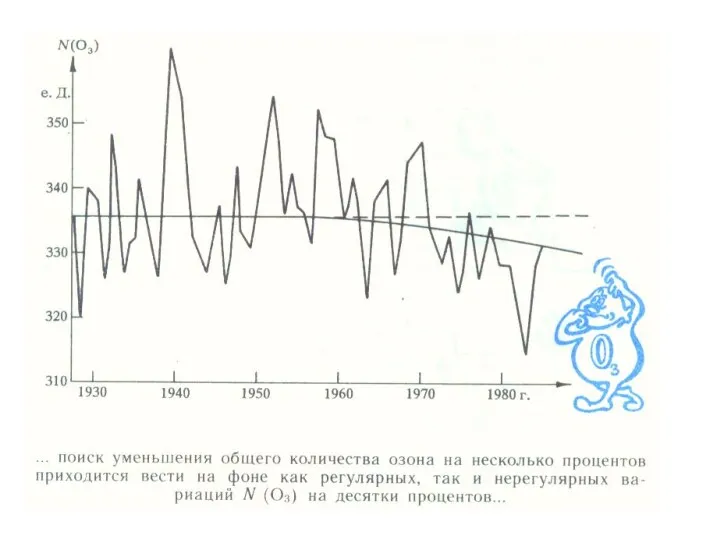
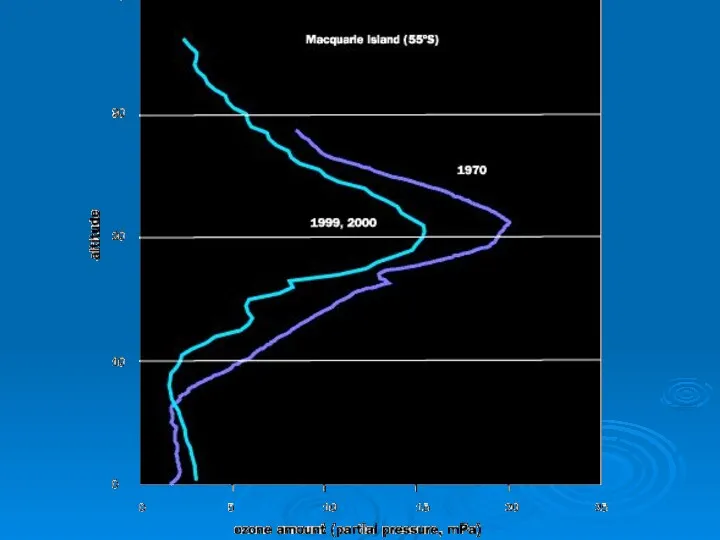
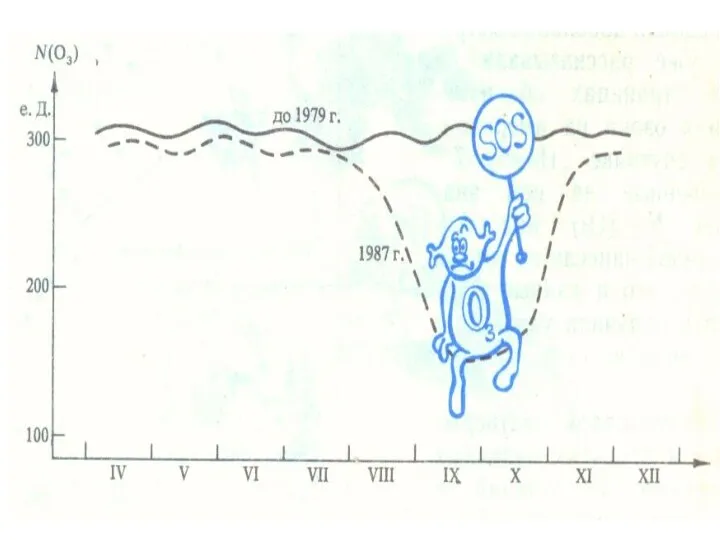
- 19. Озоновая дыра диаметром свыше 1000 км впервые была обнаружена в 1985 годуОзоновая дыра диаметром свыше 1000
- 20. Механизм образования «озоновых дыр» Антарктида со всех сторон окружена океаном и ветры могут беспрепятственно циркулировать вокруг
- 21. Механизм образования «озоновых дыр» В стратосфере при температуре ниже -100°С происходит конденсация азотной кислоты, появляющейся в
- 22. Механизм образования «озоновых дыр» В темноте антарктической зимы атомы хлора не сразу вступают в цепную реакцию
- 23. Механизм образования «озоновых дыр» Когда наступает весна, солнечная радиация разрушает накопившийся димер, хлор высвобождается и начинается
- 24. Использование ХФУ( хлорфторуглеродов) охладители в холодильных установках и кондиционерах. для производства поролонов и пенопластов - материалов,
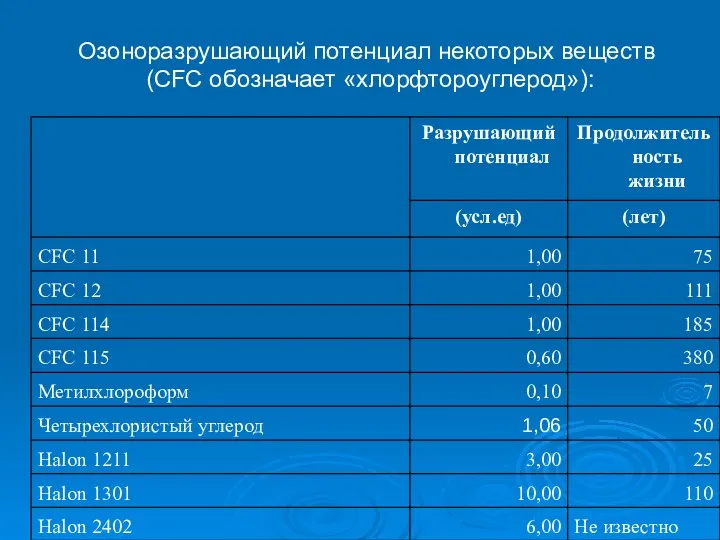
- 25. Озоноразрушающий потенциал некоторых веществ (CFC обозначает «хлорфтороуглерод»):
- 26. В 1987 года представители 24 стран в Монреале подписали соглашение, по которому обязались сократить вдвое использование
- 27. В Монреале была принята система, по которой озоноразрушающие вещества подразделялись по следующим критериям: способность разрушать озон
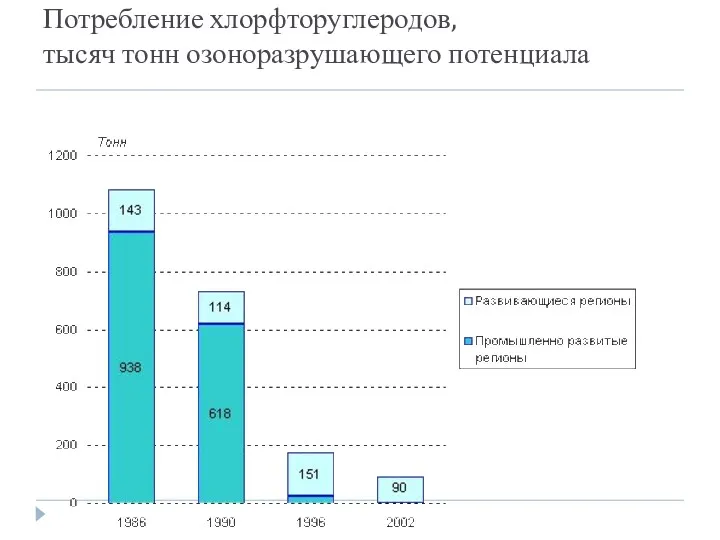
- 28. Потребление хлорфторуглеродов, тысяч тонн озоноразрушающего потенциала
- 29. Весной над Антарктидой одновременно с сильным понижением стратосферного озона наблюдается рост концентрации монооксида хлора ClO. По
- 30. Аномальное усиление активности вулкана Эребус в начале 80-х гг. XX в. стало ключевым фактором значительного увеличения
- 31. Существенное сокращение антарктической стратосферной озоновой дыры в 2010 году и в течение ряда предыдущих лет —
- 32. В ООН 16 сентября отмечается Международный день охраны озонового слоя. Он был установлен в 1994 году
- 33. Тропосфера Тропосфера – нижний, непосредственно соприкасающийся с земной поверхностью, слой атмосферы. Именно воздухом тропосферы дышат живые
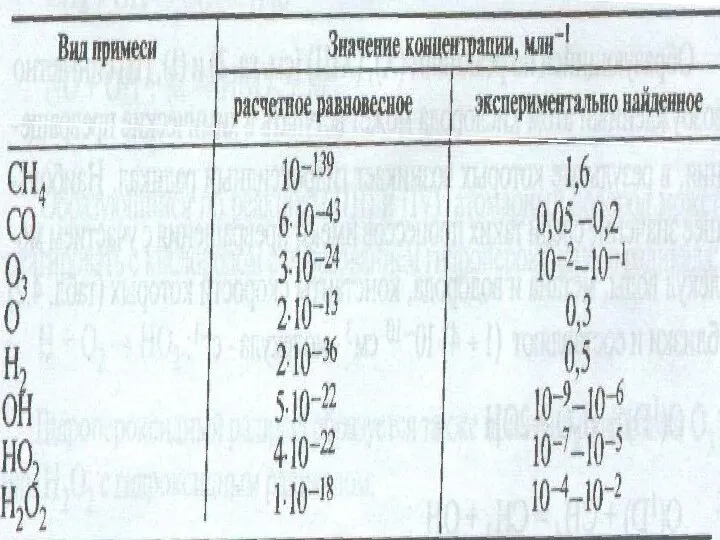
- 34. Концентрация примесей в тропосфере
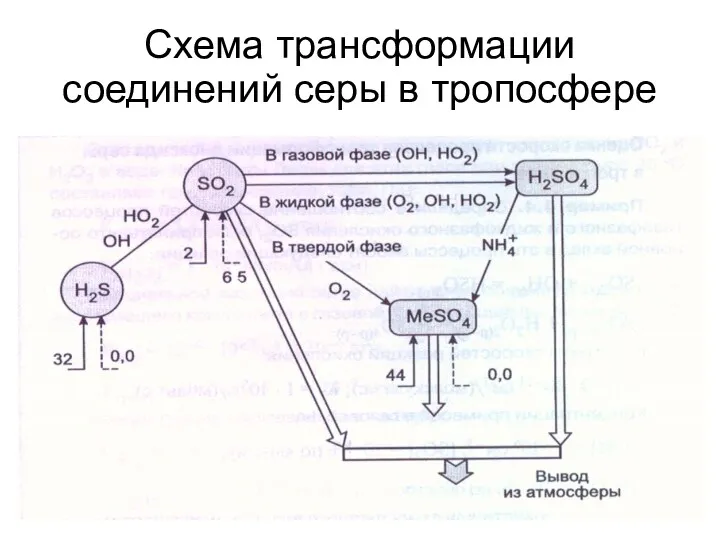
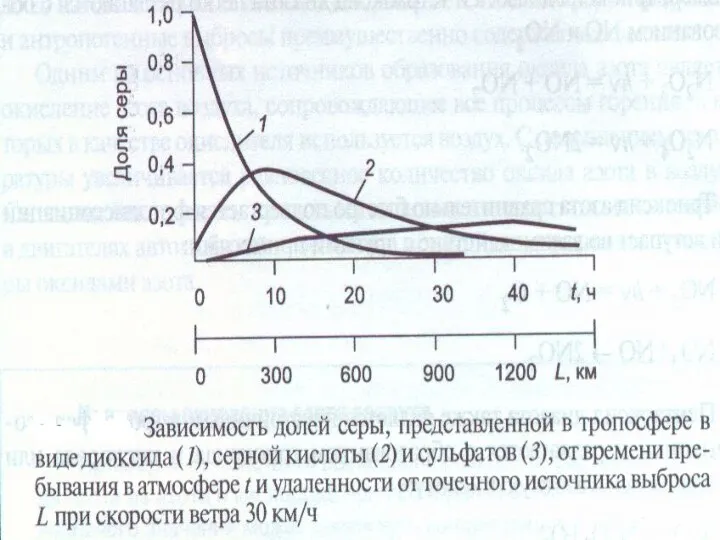
- 35. Схема трансформации соединений серы в тропосфере
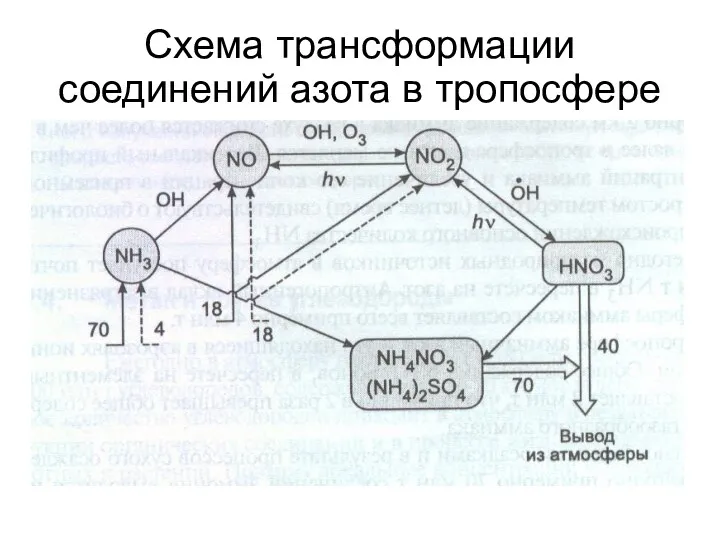
- 37. Схема трансформации соединений азота в тропосфере
- 38. Доля метана, выделяющегося из различных источников, %
- 40. Скачать презентацию



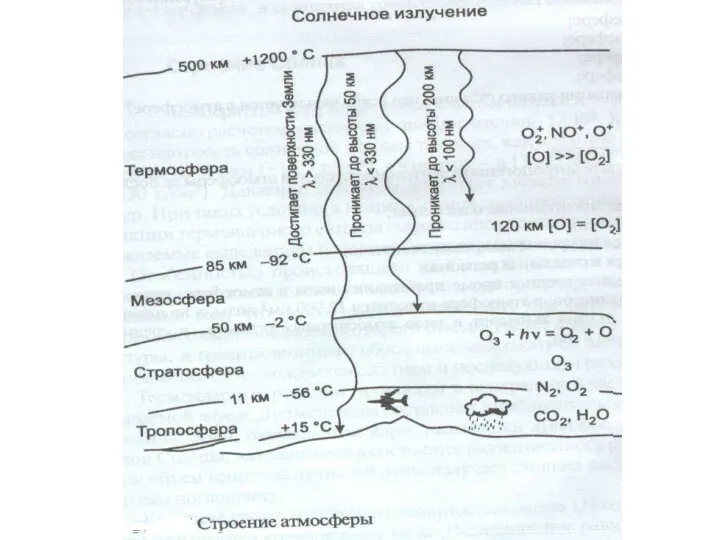






















 Земля- наш дом
Земля- наш дом Экологический паспорт предприятия. Кадастр отходов Московской области. Павловский Посад 2018
Экологический паспорт предприятия. Кадастр отходов Московской области. Павловский Посад 2018 Охрана атмосферного воздуха
Охрана атмосферного воздуха Алпар урта белем мәктәбе. Татарстанда 2013 нче ел экологик культура
Алпар урта белем мәктәбе. Татарстанда 2013 нче ел экологик культура Значення води у діяльності людини
Значення води у діяльності людини Состояние биосферы на рубеже тысячелетий. Концепция устойчивого развития
Состояние биосферы на рубеже тысячелетий. Концепция устойчивого развития Биосфера как глобальная экосистема. Экологические проблемы биосферы
Биосфера как глобальная экосистема. Экологические проблемы биосферы Государственное управление в сфере охраны окружающей среды и в рациональном использовании природных ресурсов
Государственное управление в сфере охраны окружающей среды и в рациональном использовании природных ресурсов обращение дикого животного к жителям планеты
обращение дикого животного к жителям планеты Баргузинский заповедник
Баргузинский заповедник Атмосфера. Гидросрера. Литосфера
Атмосфера. Гидросрера. Литосфера Забруднення навколишнього середовища
Забруднення навколишнього середовища Радиоактивное загрязнение почв и загрязнение тяжелыми металлами
Радиоактивное загрязнение почв и загрязнение тяжелыми металлами Пар, оны өңдеу ерекшеліктері, артықшылықтары мен кемшіліктері. (Дәріс 13)
Пар, оны өңдеу ерекшеліктері, артықшылықтары мен кемшіліктері. (Дәріс 13) Животные Красной Книги
Животные Красной Книги Externalitäten im öl-und Gasbereich
Externalitäten im öl-und Gasbereich Доклады Римского Клуба
Доклады Римского Клуба Decon-PIT
Decon-PIT The planet Earth
The planet Earth Концепция устойчивого развития
Концепция устойчивого развития Биосфера как глобальная экосистема
Биосфера как глобальная экосистема Қазақстанның экологиялық аймақтары
Қазақстанның экологиялық аймақтары Ідентифікація екологічних аспектів діяльності та оцінювання пов'язаних з ними впливів на навколишнє середовище
Ідентифікація екологічних аспектів діяльності та оцінювання пов'язаних з ними впливів на навколишнє середовище Красная книга
Красная книга Recycling
Recycling Әртүрлі халық шаруашылығының саласында радиоактивті индикатор әдісінің қолданылуы
Әртүрлі халық шаруашылығының саласында радиоактивті индикатор әдісінің қолданылуы Задание №3. Группа 176
Задание №3. Группа 176 Реформа ТКО
Реформа ТКО