Содержание
- 2. Особо опасные вещества, искусственно созданные человеком - ксенобиотики, экотоксиканты КСЕНОБИОТИКИ – любое чужеродное для данного организма
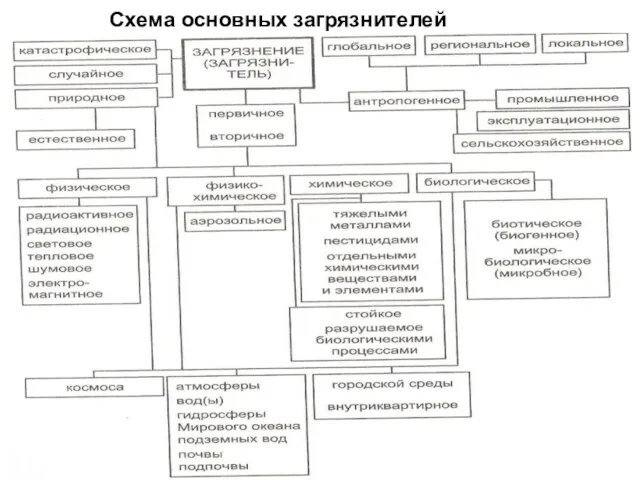
- 3. Схема основных загрязнителей
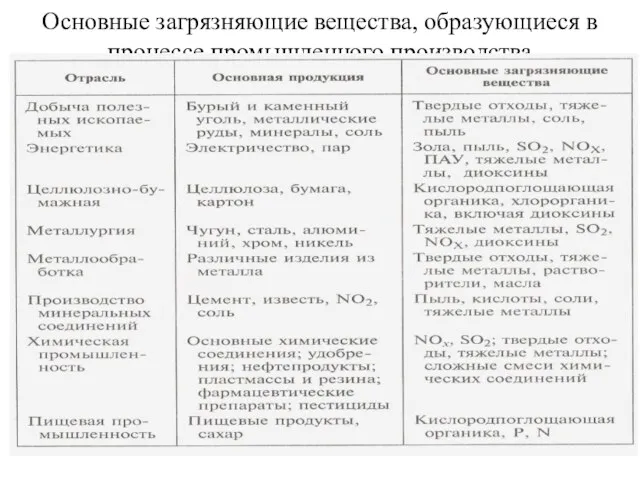
- 4. Основные загрязняющие вещества, образующиеся в процессе промышленного производства
- 5. Эта группа суперэкотоксикантов имеет широкий спектр токсического действия, в некоторых случаях они проявляют канцерогенные свойства. Хотя
- 6. Основные типы неорганических экотоксикантов, их источники и обусловленные ими стрессы
- 8. Основные типы органических экотоксикантов, их источники и обусловленные ими стрессы
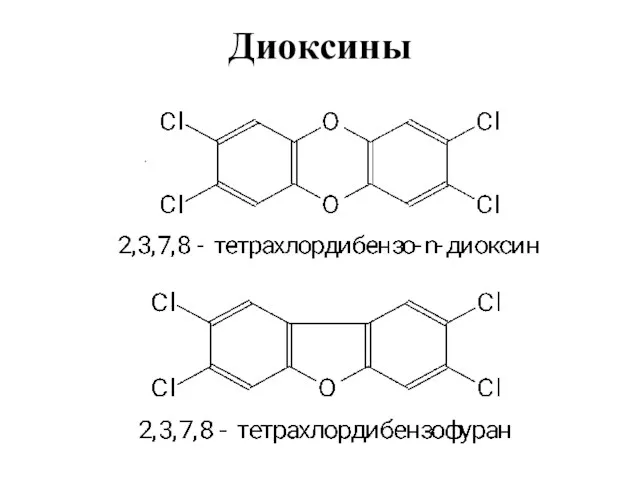
- 10. Диоксины .
- 11. Основные типы металлорганических экотоксикантов, их источники и обусловленные ими стрессы
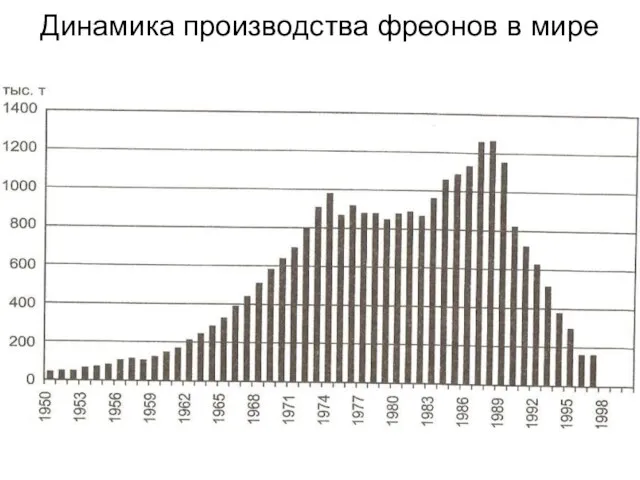
- 12. Динамика производства фреонов в мире
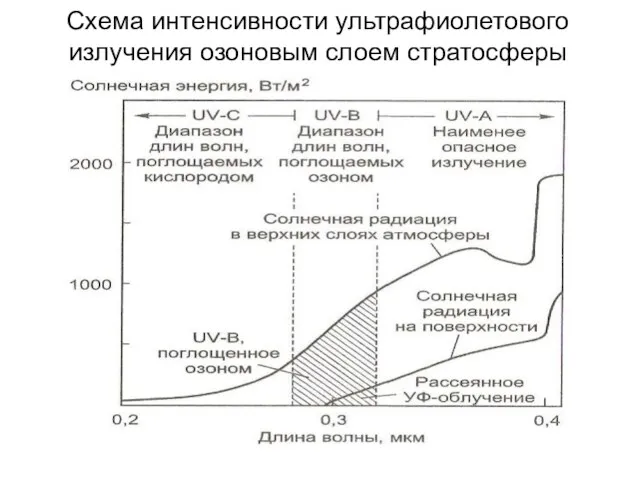
- 13. Схема интенсивности ультрафиолетового излучения озоновым слоем стратосферы
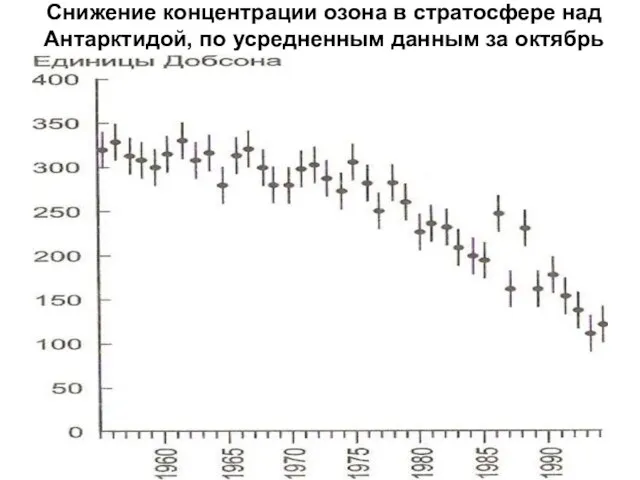
- 14. Снижение концентрации озона в стратосфере над Антарктидой, по усредненным данным за октябрь
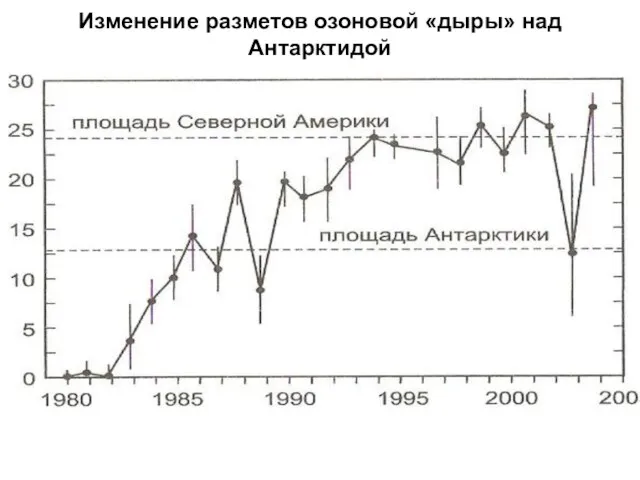
- 15. Изменение разметов озоновой «дыры» над Антарктидой
- 16. Прогноз влияния снижения концентрации озона в стратосфере на биоту
- 17. Озон ( О3 ) – аллотропная модификация кислорода. Общая масса озона в атмосфере оценивается примерно в
- 18. Ультрафиолетовое излучение с длиной волны 200 – 400 нм часто называют биологически активным ультрафиолетом (БАУ) и
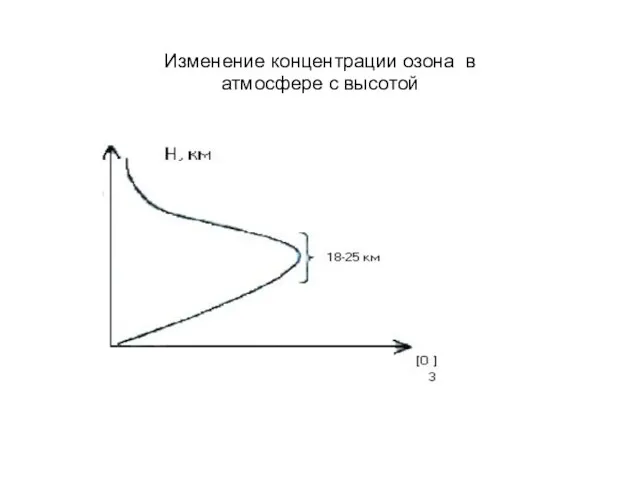
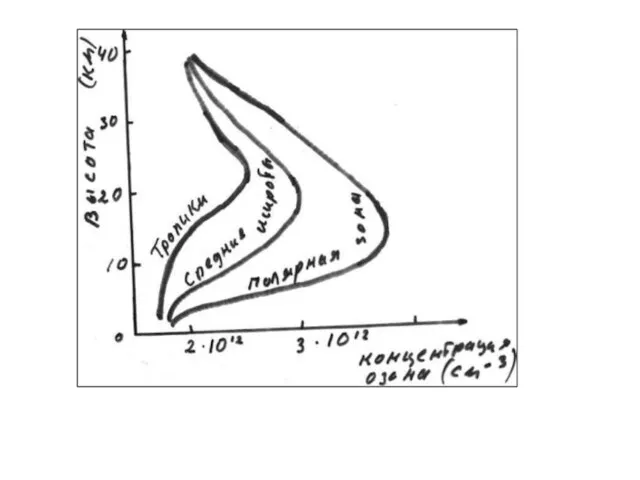
- 19. Изменение концентрации озона в атмосфере с высотой
- 22. О2 + O (3Р) + М = О3 + М* О2 + hν = О(1D) +
- 23. Процессы образования и гибели озона в атмосфере Водородный цикл НО + О3 = НО2 + О2
- 24. Процессы образования и гибели озона в атмосфере Водородный цикл НО + О3 = НО2 + О2
- 25. Процессы образования и гибели озона в атмосфере Водородный цикл НО + О3 = НО2 + О2
- 26. Процессы образования и гибели озона в атмосфере Водородный цикл НО + О3 = НО2 + О2
- 27. Обрыв цепных реакций разрушения озона СН4 + ОН = СН3 + Н2О ОН + НО2 =
- 28. “Озонная дыра” над Антарктидой Теоретически процесс был описан в начале 70 годов 20 века, экспериментальные доказательства
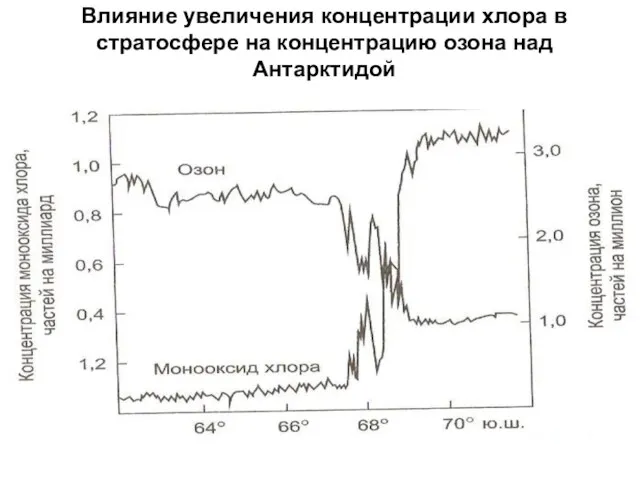
- 29. Влияние увеличения концентрации хлора в стратосфере на концентрацию озона над Антарктидой
- 32. Скачать презентацию



















 Охрана природы. Человек и природа
Охрана природы. Человек и природа Бытовой мусор в Японии. Проблемы и их решения
Бытовой мусор в Японии. Проблемы и их решения Загрязнение окружающей среды. Загрязнение воды. Твердые отходы
Загрязнение окружающей среды. Загрязнение воды. Твердые отходы Environmental Protection Organizations in Kazakhstan
Environmental Protection Organizations in Kazakhstan Методика отбора и анализа снеговых проб
Методика отбора и анализа снеговых проб Среды жизни на Земле и экологические факторы. 9 класс
Среды жизни на Земле и экологические факторы. 9 класс Забруднення водойм побутовими відходами
Забруднення водойм побутовими відходами Мембранные технологии очистки воды
Мембранные технологии очистки воды Проблема питьевой воды
Проблема питьевой воды Сирек кездесетін және жойылып бара жатқан түрлерді қорғау
Сирек кездесетін және жойылып бара жатқан түрлерді қорғау Первоцветы МАДОУ № 8
Первоцветы МАДОУ № 8 Остановим мусорное нашествие, или вторичное использование пластиковой бутылки
Остановим мусорное нашествие, или вторичное использование пластиковой бутылки Экологическая экспертиза. Лекция 3 ОВОС и экологическая экспертиза
Экологическая экспертиза. Лекция 3 ОВОС и экологическая экспертиза Пыль, как вредный фактор производственной среды
Пыль, как вредный фактор производственной среды Люди и мусор, накопленный за 7 дней
Люди и мусор, накопленный за 7 дней Global Environmental Problems, Environmentalisms, and the Age of Climate Change
Global Environmental Problems, Environmentalisms, and the Age of Climate Change Основные понятия экологии. Экология человека
Основные понятия экологии. Экология человека Мусор в океане и как от него избавиться
Мусор в океане и как от него избавиться Экология. Предмет и задачи. История формирования. Современное понимание структуры
Экология. Предмет и задачи. История формирования. Современное понимание структуры Жердің гидросферасы
Жердің гидросферасы Вторая жизнь мусора
Вторая жизнь мусора Охрана и рациональное использование животного мира
Охрана и рациональное использование животного мира Сормовский район: экологический аспект
Сормовский район: экологический аспект Биологические методы восстановления нефтезагрязненных земель
Биологические методы восстановления нефтезагрязненных земель Про воздух (2 класс)
Про воздух (2 класс) Переработка коммунальных отходов
Переработка коммунальных отходов Биогеоценозы созданные человеком. Агроценоз
Биогеоценозы созданные человеком. Агроценоз Как человек изменял природу
Как человек изменял природу