Содержание
- 2. 1. Количество теплоты и теплообмен Теплообмен - процесс передачи внутренней энергии от одного тела к другому
- 3. Работа и внутренняя энергия Внутреннюю энергию можно также изменить путем совершения работы. Передача внешними телами энергии
- 4. Работа термодинамической системы Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь её
- 5. Первое начало термодинамики В соответствии с законом сохранения энергии при любом способе перехода системы из одного
- 6. 2. Теплоемкость. Виды теплоемкостей Теплоёмкость тела - величина, равная количеству теплоты Q, которое нужно сообщить телу,
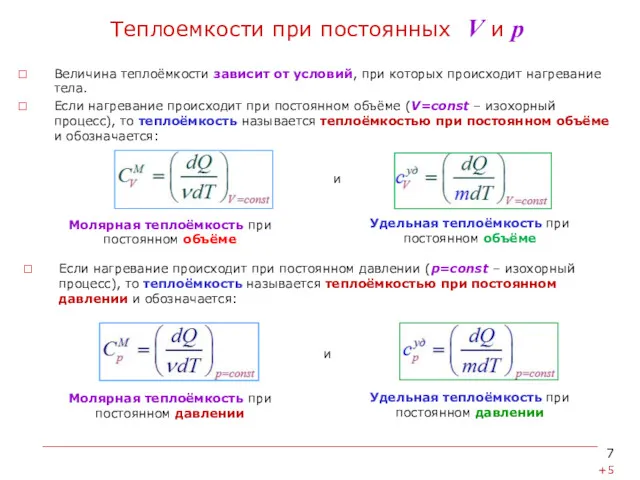
- 7. Теплоемкости при постоянных V и р Величина теплоёмкости зависит от условий, при которых происходит нагревание тела.
- 8. 3. Применение 1-го начала термодинамики в изопроцессах Если газ нагревается или охлаждается при постоянном объёме, то
- 9. Теплоемкости при изохорическом процессе Получим выражения для молярной и удельной теплоемкостей идеального газа при постоянном объеме.
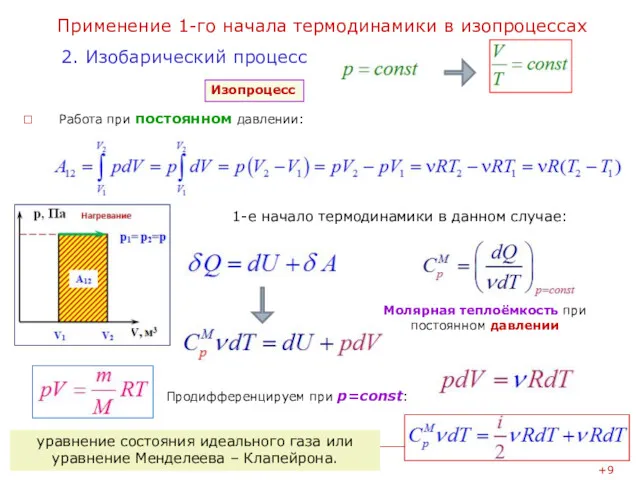
- 10. Применение 1-го начала термодинамики в изопроцессах Работа при постоянном давлении: 2. Изобарический процесс Изопроцесс 1-е начало
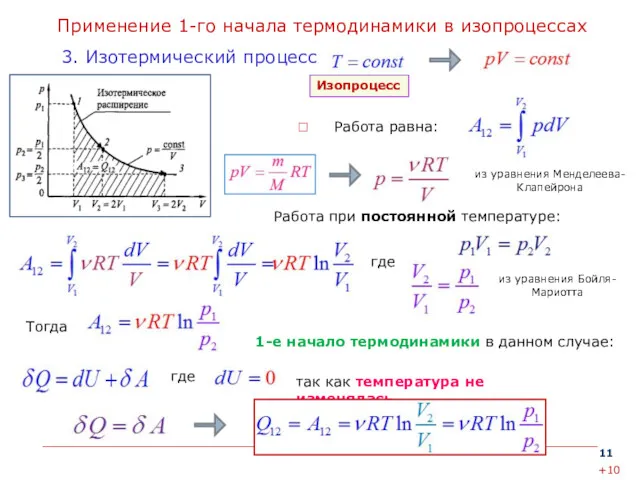
- 11. Применение 1-го начала термодинамики в изопроцессах Работа равна: 3. Изотермический процесс Изопроцесс 1-е начало термодинамики в
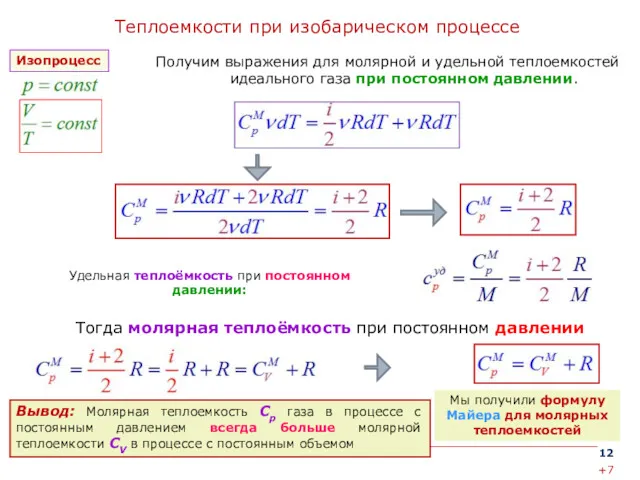
- 12. Теплоемкости при изобарическом процессе Получим выражения для молярной и удельной теплоемкостей идеального газа при постоянном давлении.
- 13. Подитожим формулы для изопроцессов
- 14. 4. Адиабатический процесс Адиабатический процесс - процесс , протекающий без теплообмена с окружающей средой. Подведённое к
- 15. 4. Адиабатический процесс -2 Зная формулу Майера, преобразуем отношение: Избавимся от логарифмов – то, что перед
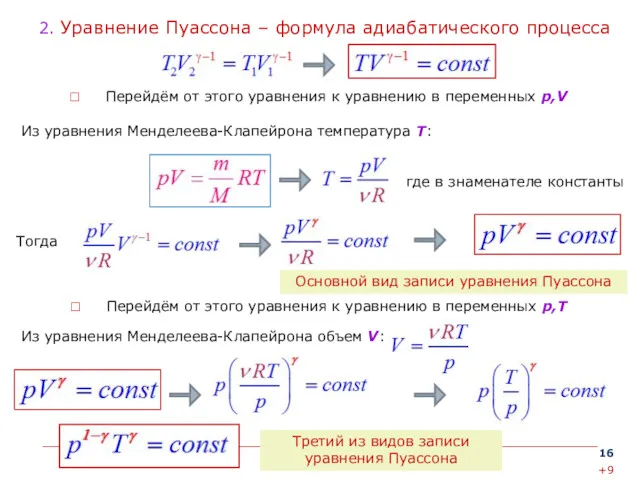
- 16. 2. Уравнение Пуассона – формула адиабатического процесса Перейдём от этого уравнения к уравнению в переменных p,V
- 17. Работа газа при адиабатическом процессе Адиабатический процесс - процесс , протекающий без теплообмена с окружающей средой.
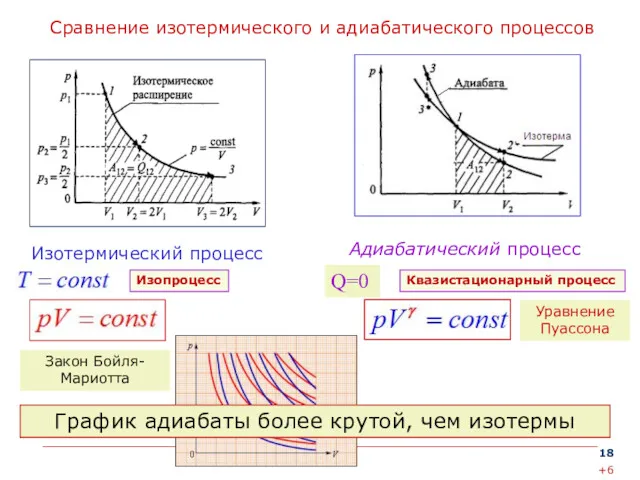
- 18. Сравнение изотермического и адиабатического процессов Адиабатический процесс Изотермический процесс Изопроцесс Уравнение Пуассона Закон Бойля-Мариотта Q=0 Квазистационарный
- 19. Подитожим для всех процессов
- 20. 3. Политропические (политропные) процессы Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы происходят при постоянной теплоёмкости. Политропический
- 21. Работа при политропическом (политропном) процессе Выразим давление p через объем V: Для случая, когда n ≠
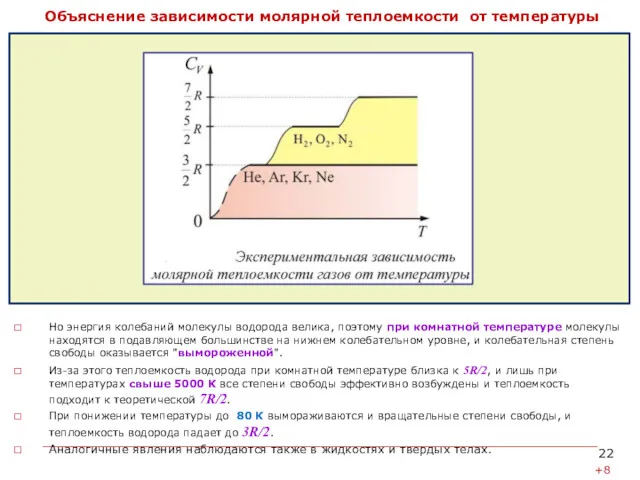
- 22. Объяснение зависимости молярной теплоемкости от температуры на основе квантовых представлений Согласно классической теореме о равнораспределении средняя
- 24. Скачать презентацию














 Опыты по рассеянию альфа-частиц. Резерфордовская модель атома. АФ1.9
Опыты по рассеянию альфа-частиц. Резерфордовская модель атома. АФ1.9 Действие жидкости и газа на погруженное в них тело. Архимедова сила
Действие жидкости и газа на погруженное в них тело. Архимедова сила Сварные детали машин. Особенности проектирования и изготовления сварных деталей машин в машиностроении
Сварные детали машин. Особенности проектирования и изготовления сварных деталей машин в машиностроении Варганова -(Еф) - Лиц.77 - презентация
Варганова -(Еф) - Лиц.77 - презентация Общая физика
Общая физика Напряжения и деформации при растяжении и сжатии в пределах упругости
Напряжения и деформации при растяжении и сжатии в пределах упругости Лазеры. Свойства лазерного излучения. Виды лазеров
Лазеры. Свойства лазерного излучения. Виды лазеров Строительная механика. Статически определимые плоские фермы. (Часть 1)
Строительная механика. Статически определимые плоские фермы. (Часть 1) ”Движение по окружности”
”Движение по окружности” Аэрогазодинамика. Плоские изоэнтропические течения газа (лекции 8, 9)
Аэрогазодинамика. Плоские изоэнтропические течения газа (лекции 8, 9) Что такое неньютоновская жидкость (8 класс)
Что такое неньютоновская жидкость (8 класс) Властивості поверхні рідини. Поверхневий натяг рідини
Властивості поверхні рідини. Поверхневий натяг рідини Решение задач по темам Архимедова сила, Условия плавания тел. 7 класс
Решение задач по темам Архимедова сила, Условия плавания тел. 7 класс Художественная обработка металла – пропильной металл
Художественная обработка металла – пропильной металл Современное оборудование кондитерского цеха
Современное оборудование кондитерского цеха Интерференция света
Интерференция света Термоэлектронная эмиссия
Термоэлектронная эмиссия Автоматика, телемеханика и связь на железнодорожном транспорте
Автоматика, телемеханика и связь на железнодорожном транспорте Природа света. Законы отражения и преломления света. Законы освещенности. Урок №22
Природа света. Законы отражения и преломления света. Законы освещенности. Урок №22 Приборы вакуумной электроники
Приборы вакуумной электроники Наша машина Голдберга
Наша машина Голдберга Мастер-класс Формирование мотивации к изучению предмета посредством использования информационно - коммуникационных технологий на уроках физики
Мастер-класс Формирование мотивации к изучению предмета посредством использования информационно - коммуникационных технологий на уроках физики Химия окружающей среды. Радиоактивные элементы в окружающей среде
Химия окружающей среды. Радиоактивные элементы в окружающей среде Деформация тела. Сила упругости. Закон Гука
Деформация тела. Сила упругости. Закон Гука Тензорезисторлар
Тензорезисторлар Алгоритм решения задач по теме Законы сохранения
Алгоритм решения задач по теме Законы сохранения Анализ сложной линейной электрической цепи постоянного тока
Анализ сложной линейной электрической цепи постоянного тока Линзы. Ход лучей в линзе
Линзы. Ход лучей в линзе