Содержание
- 2. ПЛАН ЗАНЯТИЯ Модель идеального газа. Микро- и макроскопические параметры Основное уравнение МКТ идеального газа. Связь давления
- 3. ПАРАМЕТРЫ ГАЗА Микроскопические параметры — параметры малых масштабов, характеризующие движение отдельной молекулы Масса молекулы, ее скорость,
- 4. Это означает, что в системе не меняются объем и давление, не происходит теплообмен, отсутствуют взаимные превращения
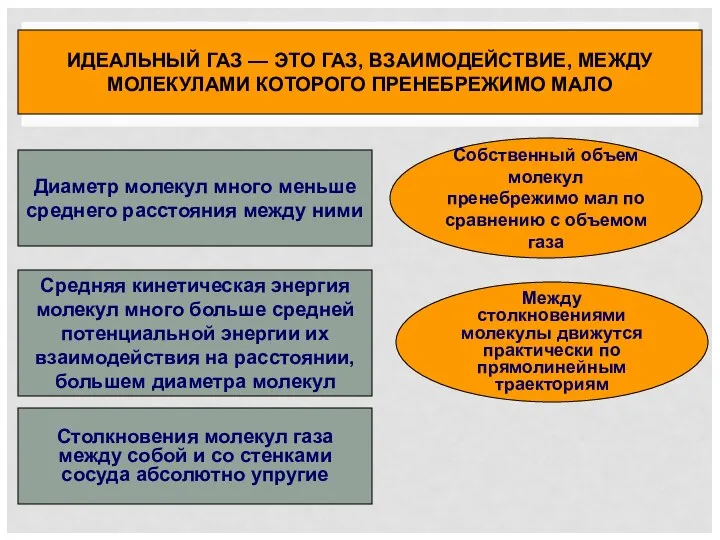
- 5. ИДЕАЛЬНЫЙ ГАЗ — ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ, МЕЖДУ МОЛЕКУЛАМИ КОТОРОГО ПРЕНЕБРЕЖИМО МАЛО Диаметр молекул много меньше среднего
- 6. Основное уравнение МКТ Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее
- 7. Температура характеризует состояние теплового равновесия системы тел Температура тела — мера средней кинетической энергии хаотического поступательного
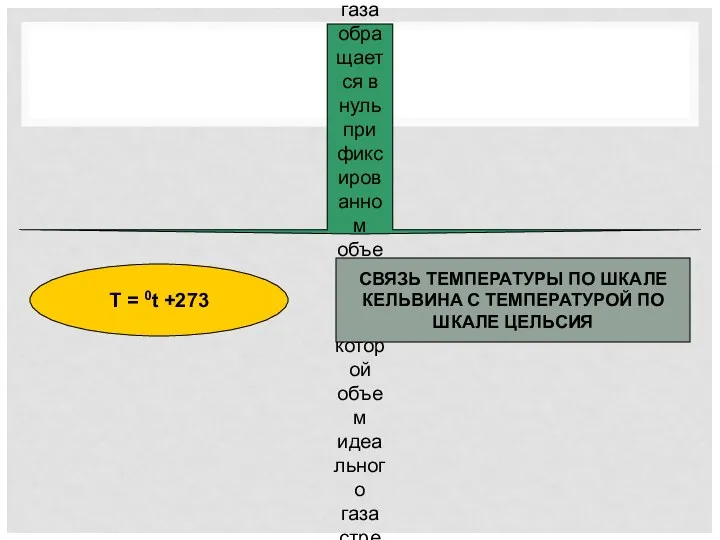
- 8. Абсолютный нуль температуры – предельная температура, при которой давление идеального газа обращается в нуль при фиксированном
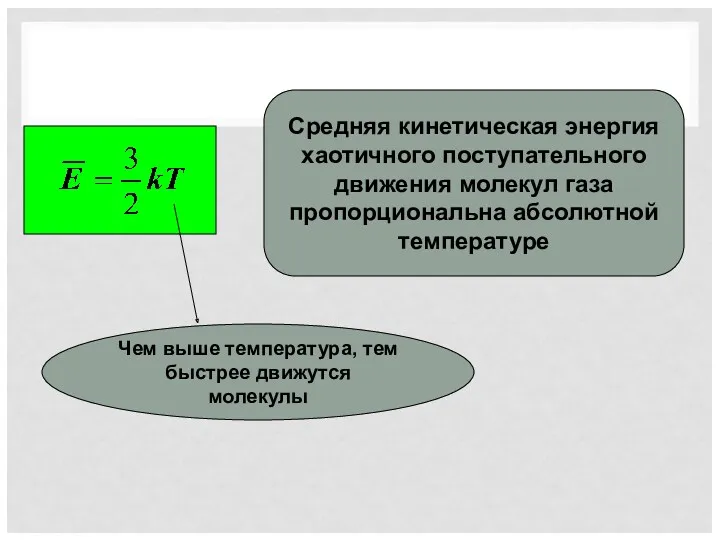
- 9. Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре
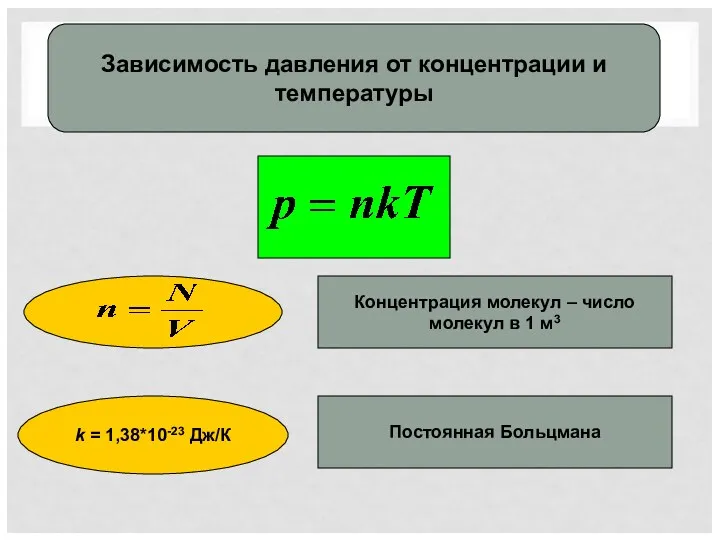
- 10. Зависимость давления от концентрации и температуры Концентрация молекул – число молекул в 1 м3 k =
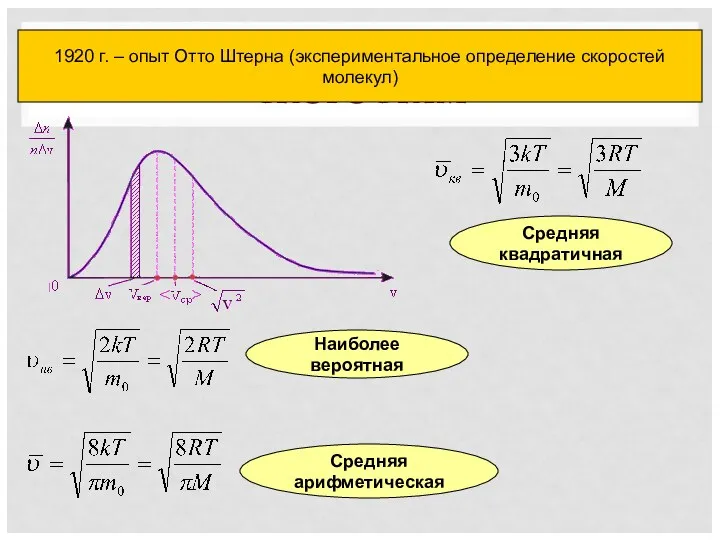
- 11. Наиболее вероятная Средняя арифметическая Средняя квадратичная РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ГАЗА ПО СКОРОСТЯМ 1920 г. – опыт Отто
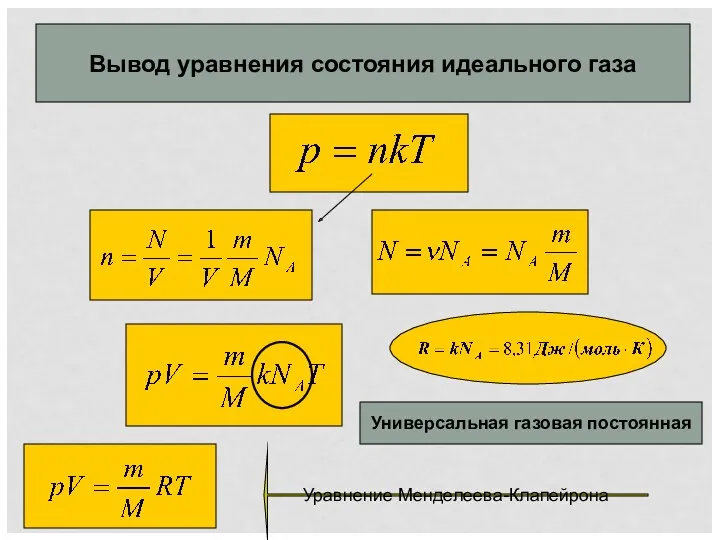
- 12. Вывод уравнения состояния идеального газа Универсальная газовая постоянная Уравнение Менделеева-Клапейрона
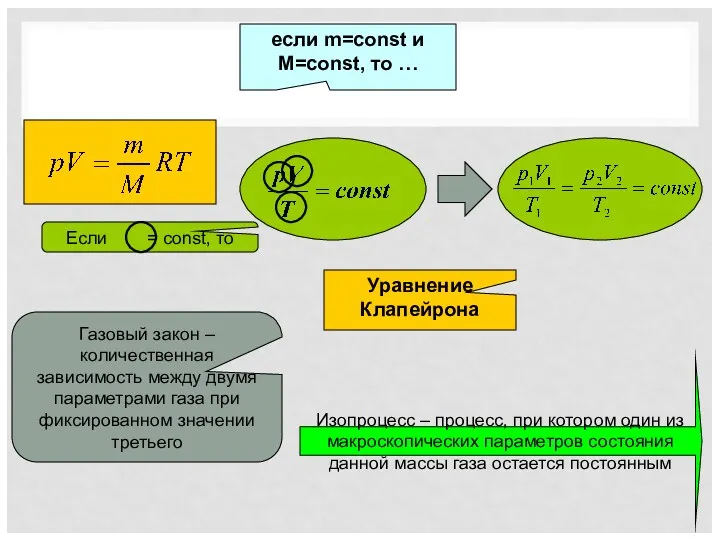
- 13. если m=const и M=const, то … Уравнение Клапейрона Газовый закон – количественная зависимость между двумя параметрами
- 14. Соотношение было открыто в 1662 г. Робертом Бойлем Переоткрыто в 1676 г. Эдмоном Мариоттом Если T=const
- 15. Дыхание можно объяснить так: межреберные мышцы и диафрагма изменяют объем грудной клетки. При ее расширении давление
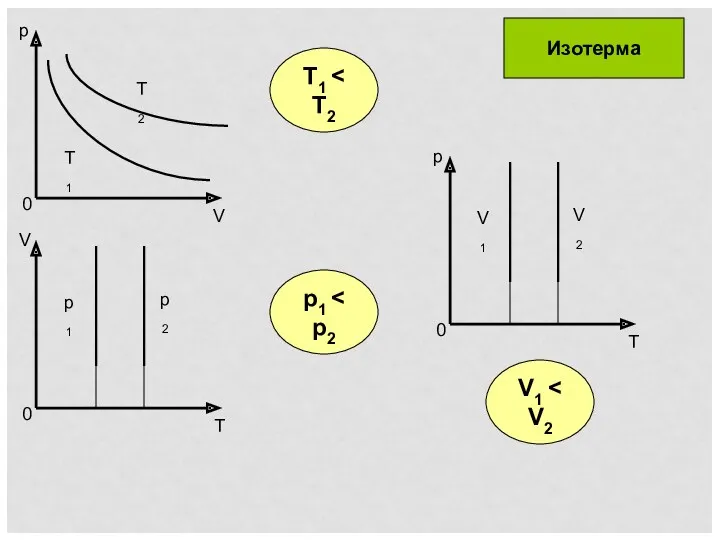
- 16. T1 p1 V1 Изотерма
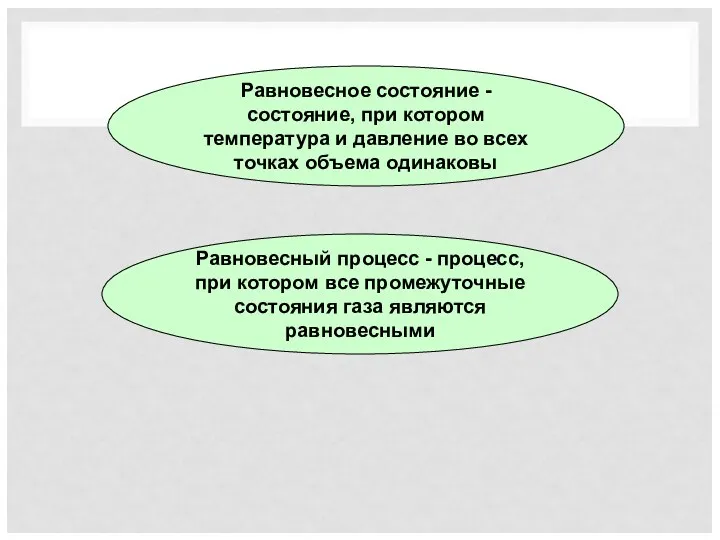
- 17. Равновесное состояние - состояние, при котором температура и давление во всех точках объема одинаковы Равновесный процесс
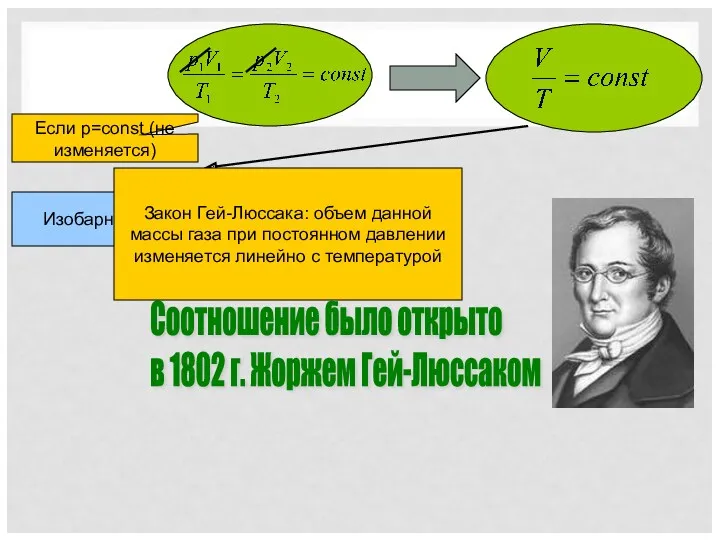
- 18. Соотношение было открыто в 1802 г. Жоржем Гей-Люссаком Если p=const (не изменяется) Изобарный процесс
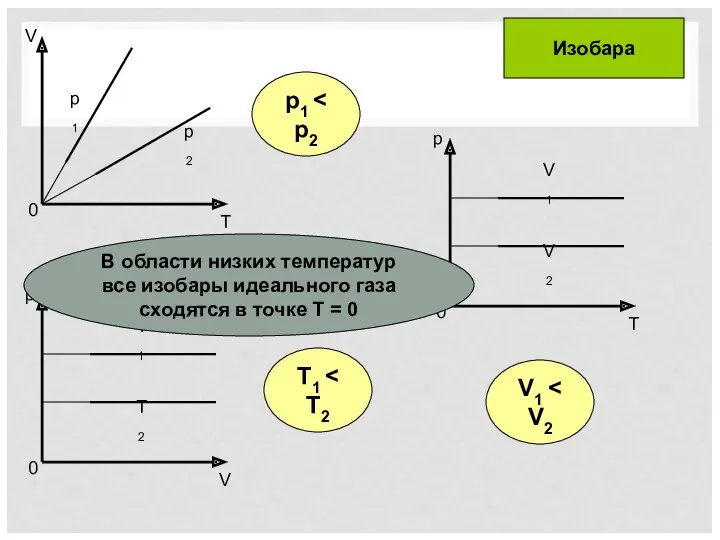
- 19. T1 p1 V1 Изобара В области низких температур все изобары идеального газа сходятся в точке Т
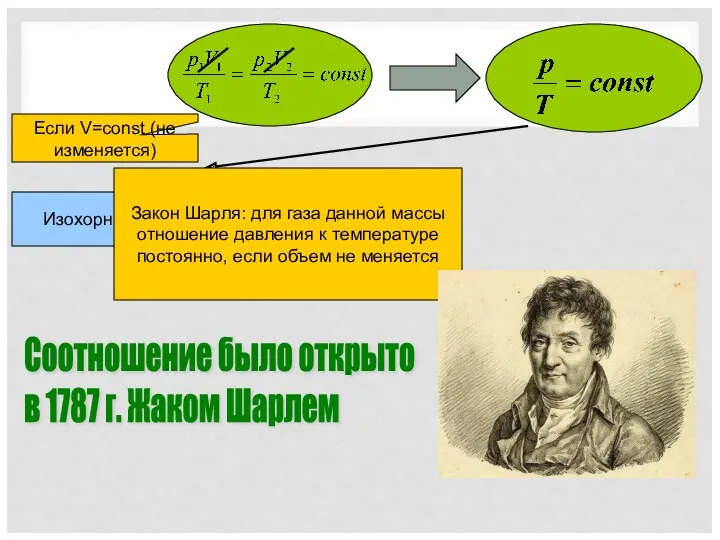
- 20. Соотношение было открыто в 1787 г. Жаком Шарлем Если V=const (не изменяется) Изохорный процесс
- 21. T1 p1 V1 Изохора Давление идеального газа при абсолютном нуле равно 0
- 23. Скачать презентацию








 Урок физике в 7 классе Решение задач на расчёт механической работы и мощности
Урок физике в 7 классе Решение задач на расчёт механической работы и мощности Истечение жидкости через отверстия и насадки
Истечение жидкости через отверстия и насадки урок-игра по физике по теме Плотность
урок-игра по физике по теме Плотность Сила трения. Тест
Сила трения. Тест Взаимодействие тел. Масса
Взаимодействие тел. Масса Лекция №6 (6 ). Поле системы элементарных излучателей
Лекция №6 (6 ). Поле системы элементарных излучателей Термоядерная реакция
Термоядерная реакция Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем
Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем Повторение курса физики. 8 класс
Повторение курса физики. 8 класс Анализ эксплуатационной надежности бурового вертлюга ВБ-80М
Анализ эксплуатационной надежности бурового вертлюга ВБ-80М Открытие электромагнитных колебаний. 11 класс
Открытие электромагнитных колебаний. 11 класс Точність обробки. (Лекция 3)
Точність обробки. (Лекция 3) Закон Кулона. Электрическое поле
Закон Кулона. Электрическое поле Молекулярная физика. Атом
Молекулярная физика. Атом Явление электромагнитной индукции
Явление электромагнитной индукции Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Цифровые сигналы
Цифровые сигналы МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР
МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР Электромагнитные явления. Своя игра
Электромагнитные явления. Своя игра Аэродинамические весы
Аэродинамические весы Движение под действием силы тяжести. Решение задач
Движение под действием силы тяжести. Решение задач Динамика вязкой жидкости
Динамика вязкой жидкости Расчеты на прочность при изгибе
Расчеты на прочность при изгибе Реактивное движение. Ракеты
Реактивное движение. Ракеты Соединения деталей. Виды изделий. Резьбовые соединения
Соединения деталей. Виды изделий. Резьбовые соединения Создание источника электричества из овощей и фруктов
Создание источника электричества из овощей и фруктов Момент инерции. Теорема Штейнера. Кинетическая энергия вращательного движения твердого тела. (Лекция 5)
Момент инерции. Теорема Штейнера. Кинетическая энергия вращательного движения твердого тела. (Лекция 5) Закон сохранения энергии в тепловых процессах.
Закон сохранения энергии в тепловых процессах.