Содержание
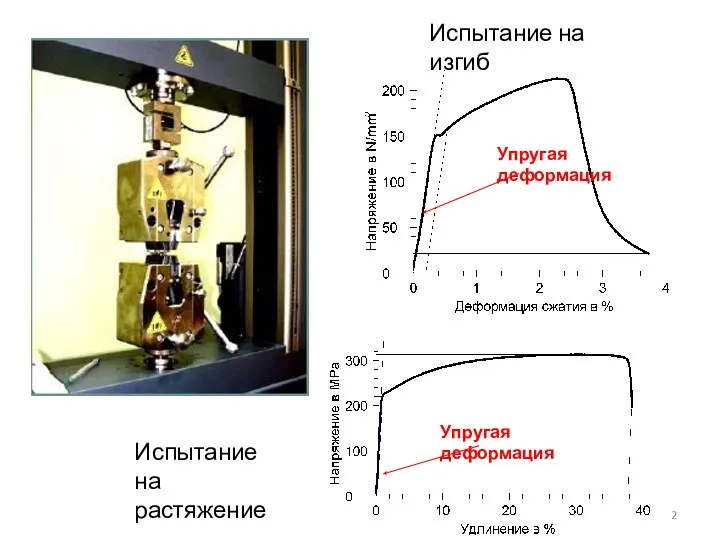
- 2. Испытание на изгиб Испытание на растяжение Упругая деформация Упругая деформация
- 3. Упругая деформация (з-н Гука) Относительное удлинение (сжатие) пропорционально приложенной силе F и коэффициенту растяжения (сжатия) E,
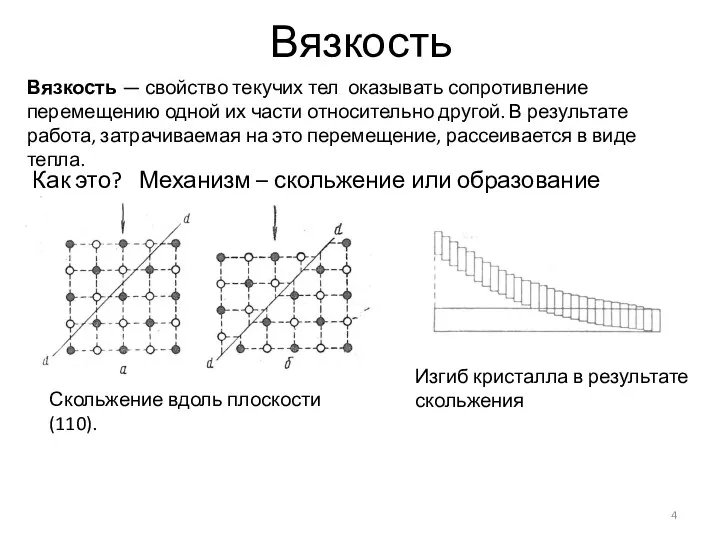
- 4. Вязкость Вязкость — свойство текучих тел оказывать сопротивление перемещению одной их части относительно другой. В результате
- 5. Излом Описание поверхности, образующийся при расколе минерала
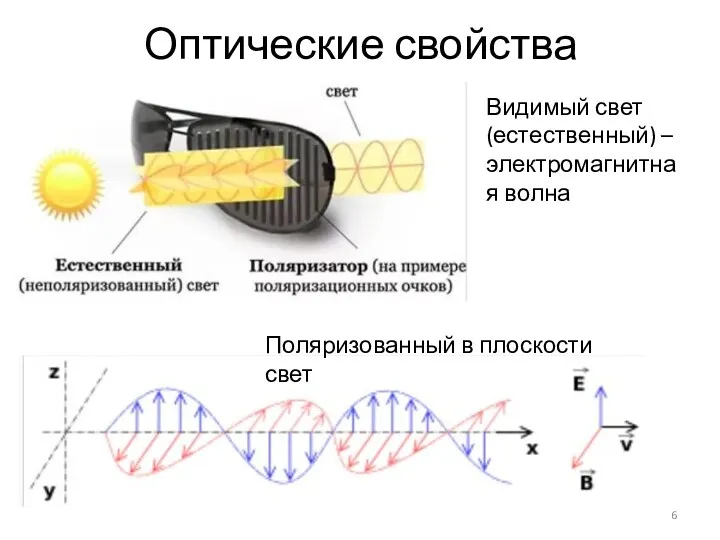
- 6. Оптические свойства Видимый свет (естественный) – электромагнитная волна Поляризованный в плоскости свет
- 8. Двупреломление Двойное лучепреломление — эффект расщепления в анизотропной среде луча света на две составляющие. Не наблюдается
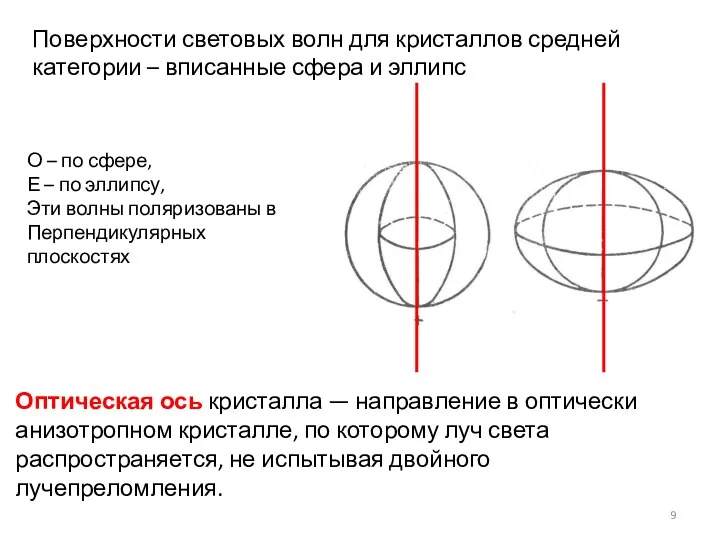
- 9. Поверхности световых волн для кристаллов средней категории – вписанные сфера и эллипс О – по сфере,
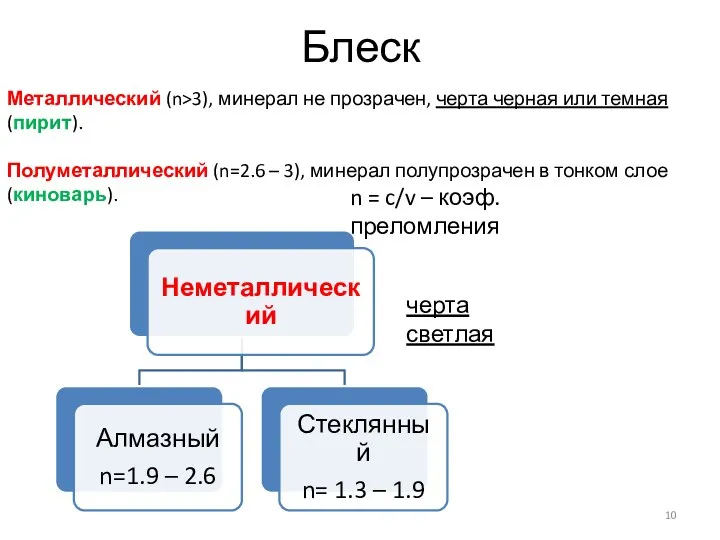
- 10. Блеск Металлический (n>3), минерал не прозрачен, черта черная или темная (пирит). Полуметаллический (n=2.6 – 3), минерал
- 11. Окраска Окраска — свойство предметов отражать, переизлучать и рассеивать свет, определяющее их визуальное восприятие человеком. Зависит
- 12. Плеохроизм — способность некоторых анизотропных кристаллов иметь различную окраску «на просвет» в различных направлениях. Связано с
- 13. Побежалость Цвета побежалости — радужные цвета, образующиеся на гладкой поверхности кристалла в результате формирования тонкой прозрачной
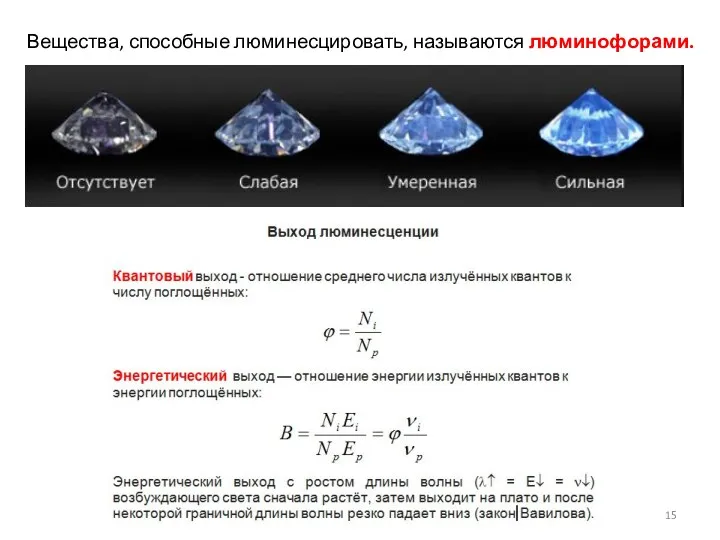
- 14. Люминесценция Люминесценция — нетепловое свечение вещества. Все явления свечения, не вызванные повышением температуры до степени накаливания
- 15. Вещества, способные люминесцировать, называются люминофорами.
- 17. Триболюминесценция — люминесценция, возникающая при разрушении кристаллических тел. Причины: возбуждение электрическими разрядами при раскалывании кристаллов; движением
- 18. Кристаллолюминесценция - это испускание света при кристаллизации ионных кристаллов (бромат стронция). Причина – возбуждение молекул при
- 20. Законы люминесценции
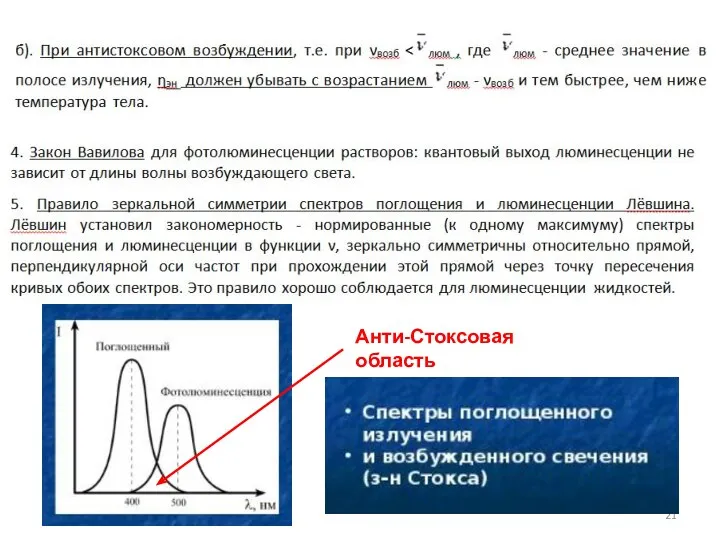
- 21. Анти-Стоксовая область
- 22. Типы воды в минералах Вода в составе минералов может быть связанной и свободной. Связанная, или кристаллизационная,
- 23. 1) Вода конституционная - входит непосредственно в структуру в виде существенных ее составляющих. а) в виде
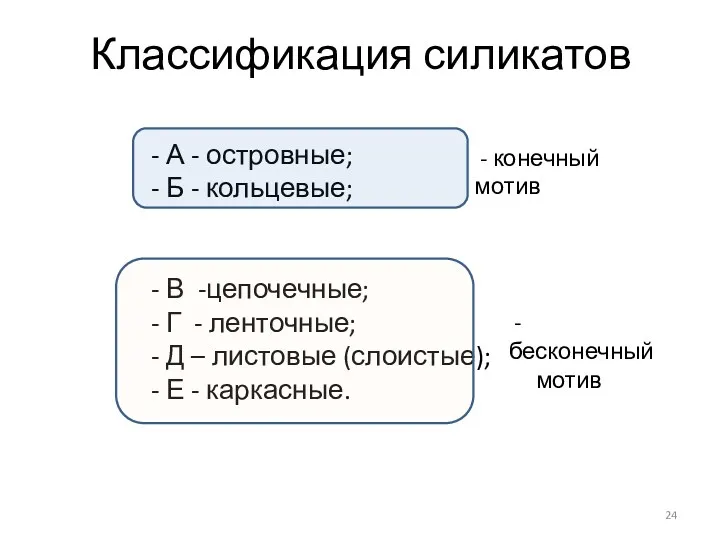
- 24. Классификация силикатов - А - островные; - Б - кольцевые; - В -цепочечные; - Г -
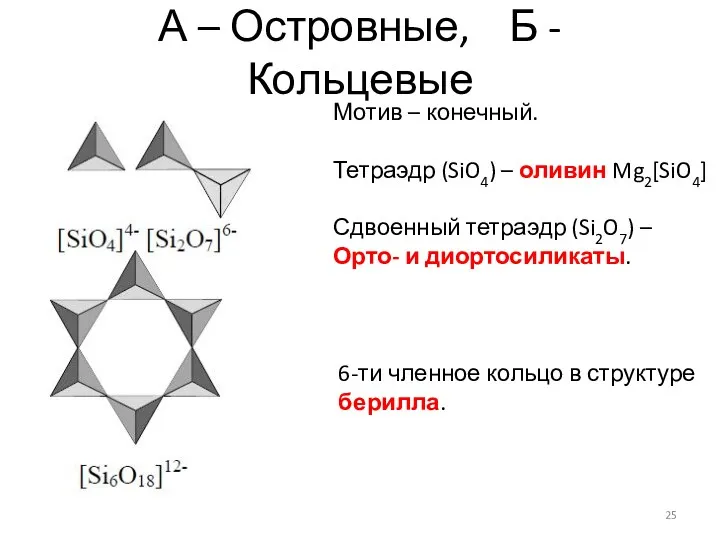
- 25. А – Островные, Б - Кольцевые Мотив – конечный. Тетраэдр (SiO4) – оливин Mg2[SiO4] Сдвоенный тетраэдр
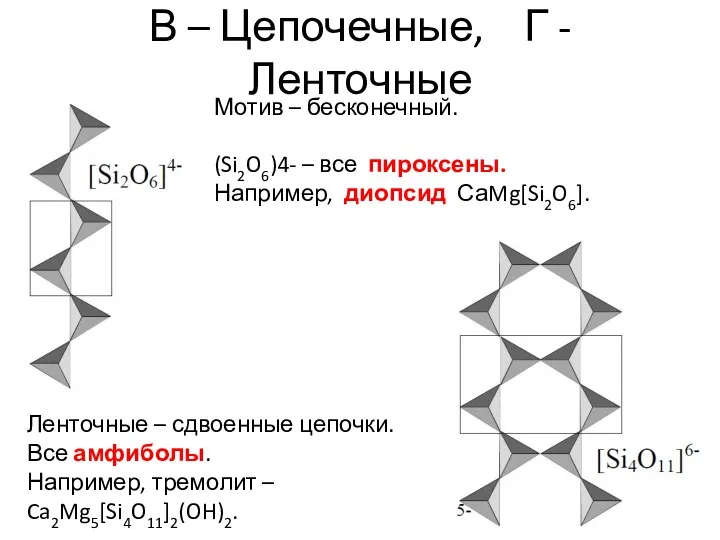
- 26. В – Цепочечные, Г - Ленточные Мотив – бесконечный. (Si2O6)4- – все пироксены. Например, диопсид СаMg[Si2O6].
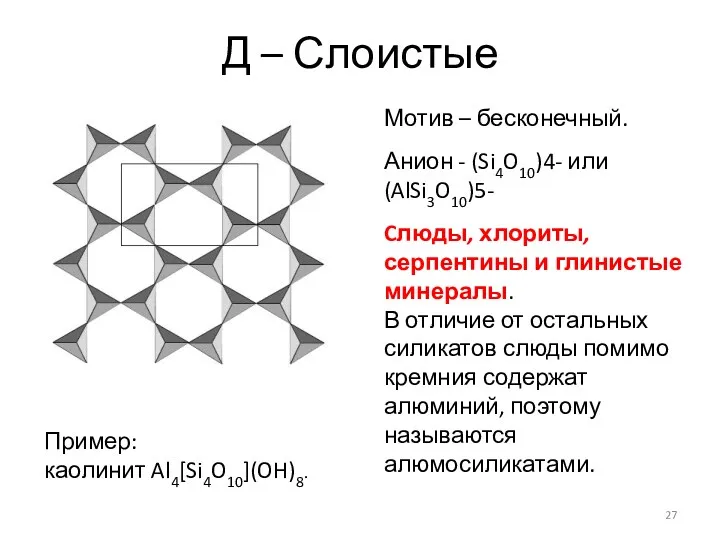
- 27. Д – Слоистые Мотив – бесконечный. Анион - (Si4O10)4- или (AlSi3O10)5- Cлюды, хлориты, серпентины и глинистые
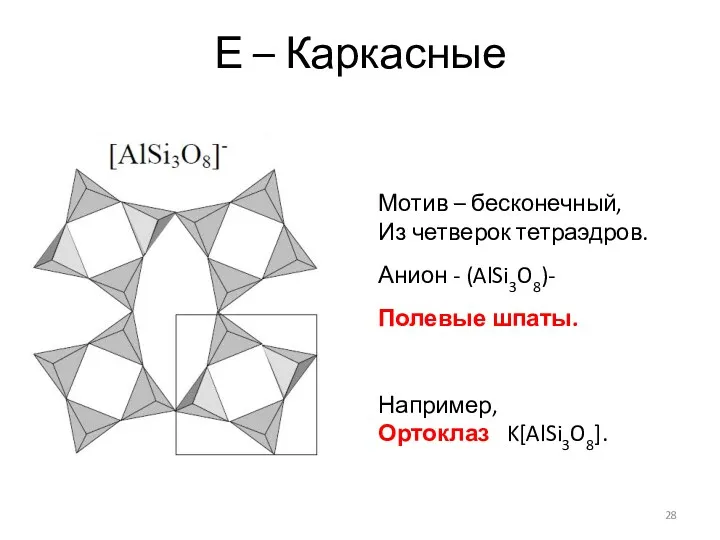
- 28. Е – Каркасные Мотив – бесконечный, Из четверок тетраэдров. Анион - (AlSi3O8)- Полевые шпаты. Например, Ортоклаз
- 30. Скачать презентацию















 Опыты по рассеянию альфа-частиц. Резерфордовская модель атома. АФ1.9
Опыты по рассеянию альфа-частиц. Резерфордовская модель атома. АФ1.9 Действие жидкости и газа на погруженное в них тело. Архимедова сила
Действие жидкости и газа на погруженное в них тело. Архимедова сила Сварные детали машин. Особенности проектирования и изготовления сварных деталей машин в машиностроении
Сварные детали машин. Особенности проектирования и изготовления сварных деталей машин в машиностроении Варганова -(Еф) - Лиц.77 - презентация
Варганова -(Еф) - Лиц.77 - презентация Общая физика
Общая физика Напряжения и деформации при растяжении и сжатии в пределах упругости
Напряжения и деформации при растяжении и сжатии в пределах упругости Лазеры. Свойства лазерного излучения. Виды лазеров
Лазеры. Свойства лазерного излучения. Виды лазеров Строительная механика. Статически определимые плоские фермы. (Часть 1)
Строительная механика. Статически определимые плоские фермы. (Часть 1) ”Движение по окружности”
”Движение по окружности” Аэрогазодинамика. Плоские изоэнтропические течения газа (лекции 8, 9)
Аэрогазодинамика. Плоские изоэнтропические течения газа (лекции 8, 9) Что такое неньютоновская жидкость (8 класс)
Что такое неньютоновская жидкость (8 класс) Властивості поверхні рідини. Поверхневий натяг рідини
Властивості поверхні рідини. Поверхневий натяг рідини Решение задач по темам Архимедова сила, Условия плавания тел. 7 класс
Решение задач по темам Архимедова сила, Условия плавания тел. 7 класс Художественная обработка металла – пропильной металл
Художественная обработка металла – пропильной металл Современное оборудование кондитерского цеха
Современное оборудование кондитерского цеха Интерференция света
Интерференция света Термоэлектронная эмиссия
Термоэлектронная эмиссия Автоматика, телемеханика и связь на железнодорожном транспорте
Автоматика, телемеханика и связь на железнодорожном транспорте Природа света. Законы отражения и преломления света. Законы освещенности. Урок №22
Природа света. Законы отражения и преломления света. Законы освещенности. Урок №22 Приборы вакуумной электроники
Приборы вакуумной электроники Наша машина Голдберга
Наша машина Голдберга Мастер-класс Формирование мотивации к изучению предмета посредством использования информационно - коммуникационных технологий на уроках физики
Мастер-класс Формирование мотивации к изучению предмета посредством использования информационно - коммуникационных технологий на уроках физики Химия окружающей среды. Радиоактивные элементы в окружающей среде
Химия окружающей среды. Радиоактивные элементы в окружающей среде Деформация тела. Сила упругости. Закон Гука
Деформация тела. Сила упругости. Закон Гука Тензорезисторлар
Тензорезисторлар Алгоритм решения задач по теме Законы сохранения
Алгоритм решения задач по теме Законы сохранения Анализ сложной линейной электрической цепи постоянного тока
Анализ сложной линейной электрической цепи постоянного тока Линзы. Ход лучей в линзе
Линзы. Ход лучей в линзе