Содержание
- 2. Дисперсные системы – гетерогенные системы с высокой степенью дисперсности (раздробленности) одной из фаз. Признаки: гетерогенность дисперсность
- 3. Классификация ДС по агрегатному состоянию фаз
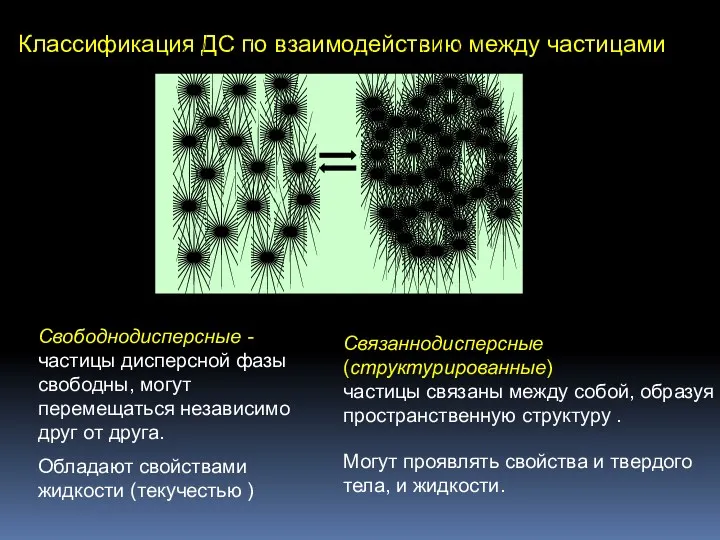
- 4. Классификация ДС по взаимодействию между частицами Свободнодисперсные - частицы дисперсной фазы свободны, могут перемещаться независимо друг
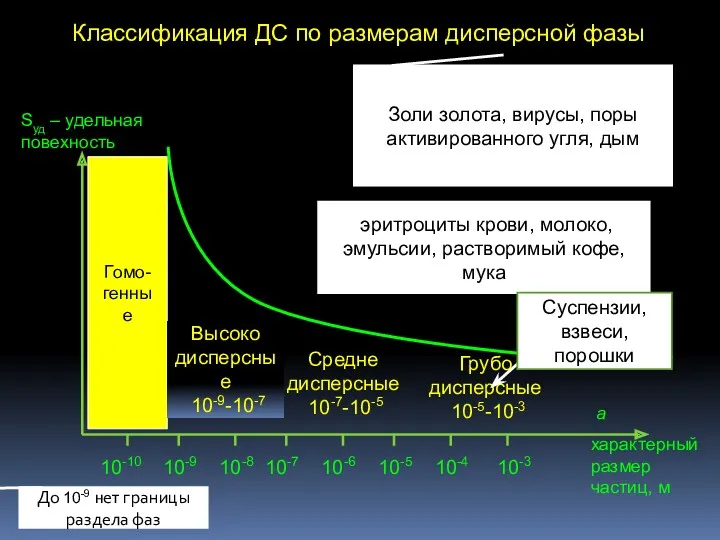
- 5. Классификация ДС по размерам дисперсной фазы 10-9 10-10 10-8 10-7 10-6 10-5 10-4 10-3 a характерный
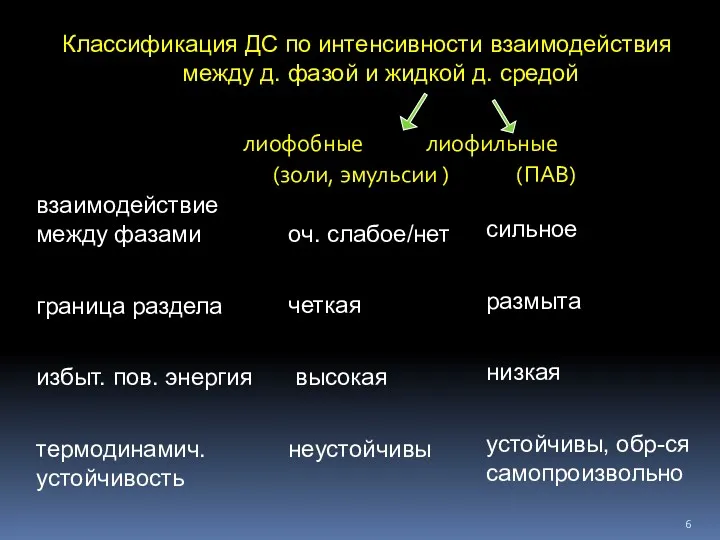
- 6. Классификация ДС по интенсивности взаимодействия между д. фазой и жидкой д. средой лиофобные лиофильные (золи, эмульсии
- 7. Характерные размеры - размеры дисперсной фазы, которые отражают раздробленность. трехмерные двумерные одномерные порошки нити пленки эмульсии
- 8. Дисперсность D — величина, обратная характерному размеру: размерность м-1. Удельная поверхность Sуд — площадь границы раздела
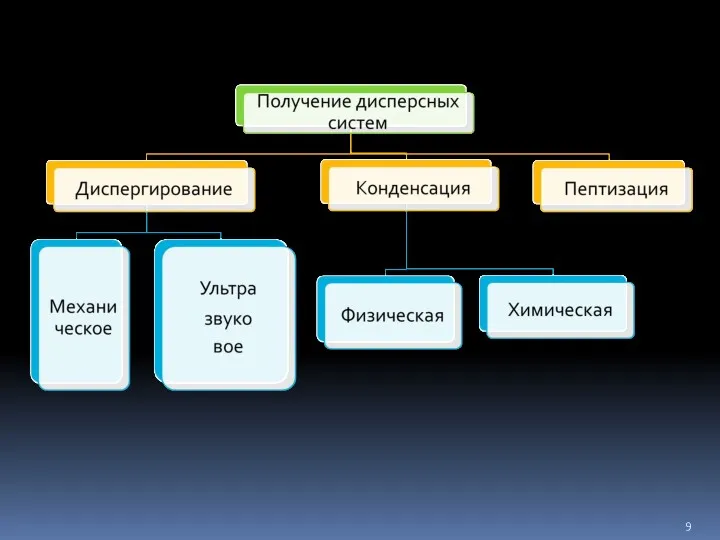
- 10. различные виды мельниц - помол до 1-10 мкм Механизм диспергирования Под действием деформирующих сил (давление, удар,
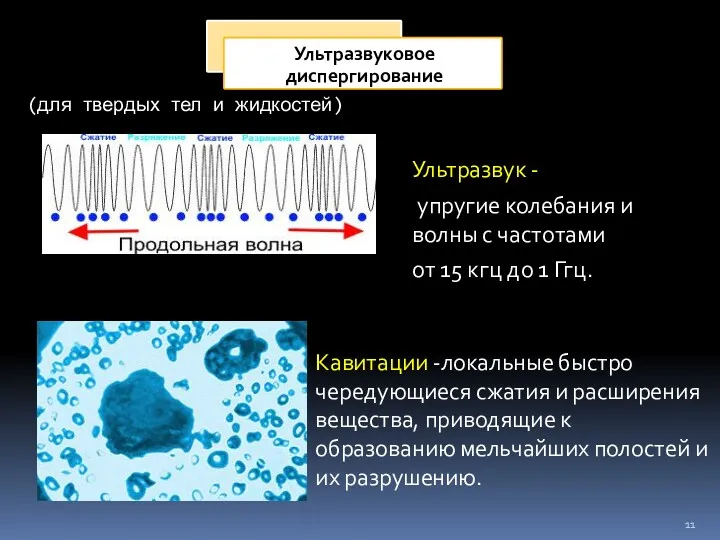
- 11. (для твердых тел и жидкостей) Кавитации -локальные быстро чередующиеся сжатия и расширения вещества, приводящие к образованию
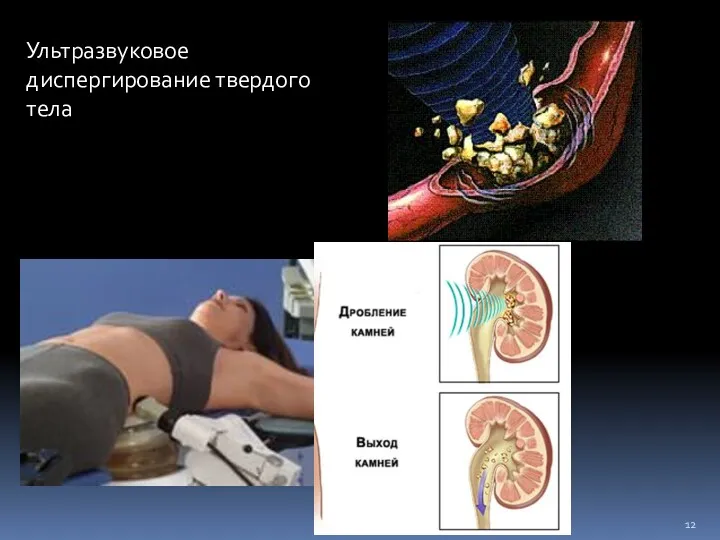
- 12. Ультразвуковое диспергирование твердого тела
- 13. Ультразвуковой ингалятор Ультразвуковое диспергирование жидкости
- 14. Методы конденсации – образование новой фазы из отдельных атомов или молекул Метод замены растворителя Конденсация из
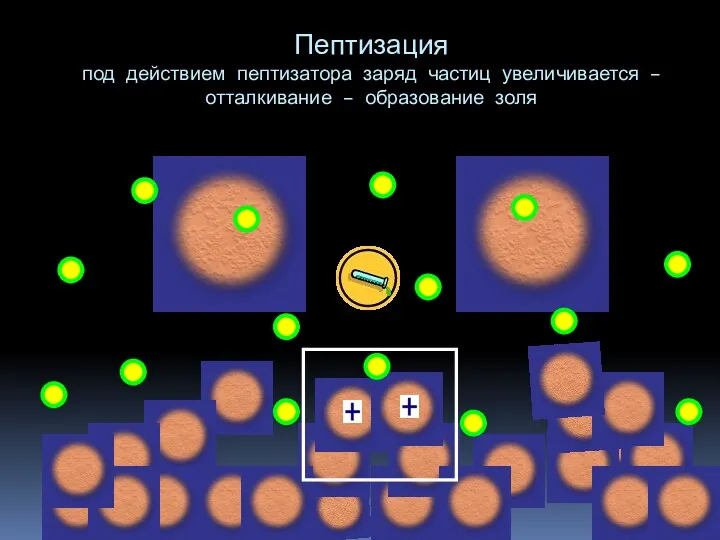
- 15. Пептизация — процесс перехода вещества из геля(осадка) в золь под влиянием диспергирующих веществ (пептизаторов). При пептизации
- 16. Пептизация под действием пептизатора заряд частиц увеличивается – отталкивание – образование золя
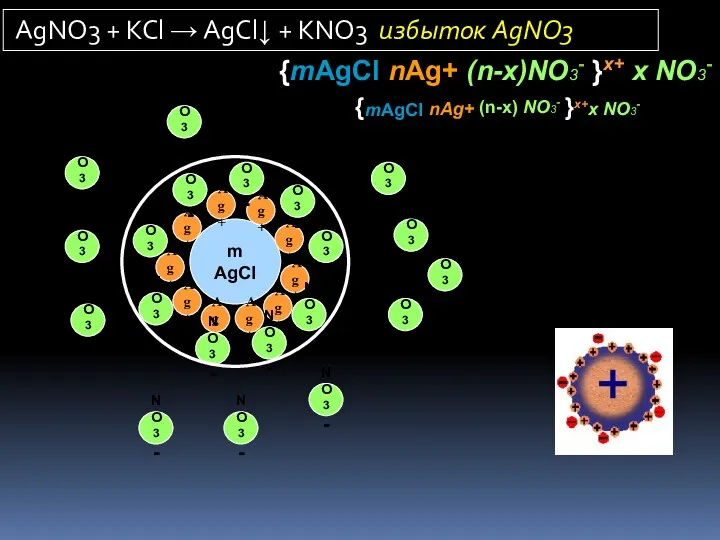
- 17. Золи - лиофобные высокодисперсные системы Т/Ж. как правило, получают методом химической конденсации. Реакции обмена, восстановления, окисления,
- 18. m AgCl Ag+ Ag+ Ag+ Ag+ Ag+ Ag+ Ag+ Ag+ Ag+ Ag+ NO3- NO3- NO3- NO3-
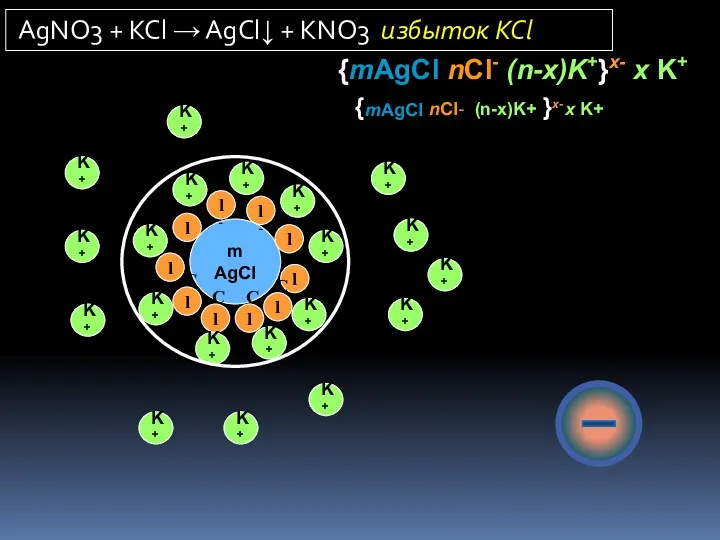
- 19. m AgCl Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- K+ K+ K+ K+
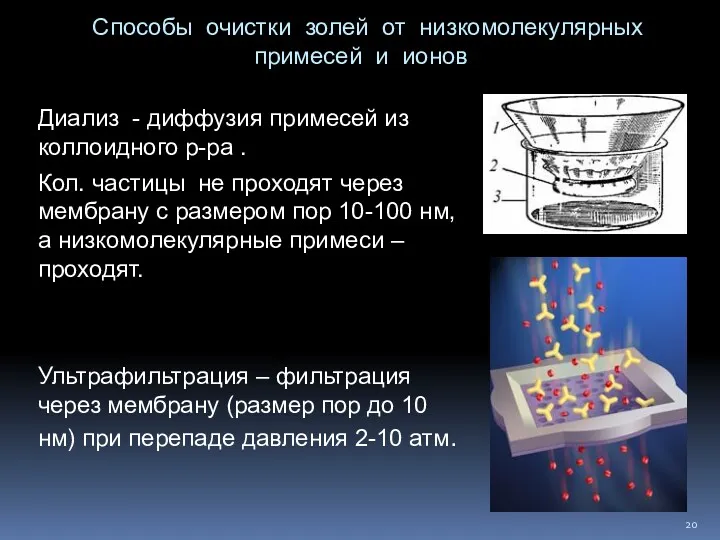
- 20. Способы очистки золей от низкомолекулярных примесей и ионов Диализ - диффузия примесей из коллоидного р-ра .
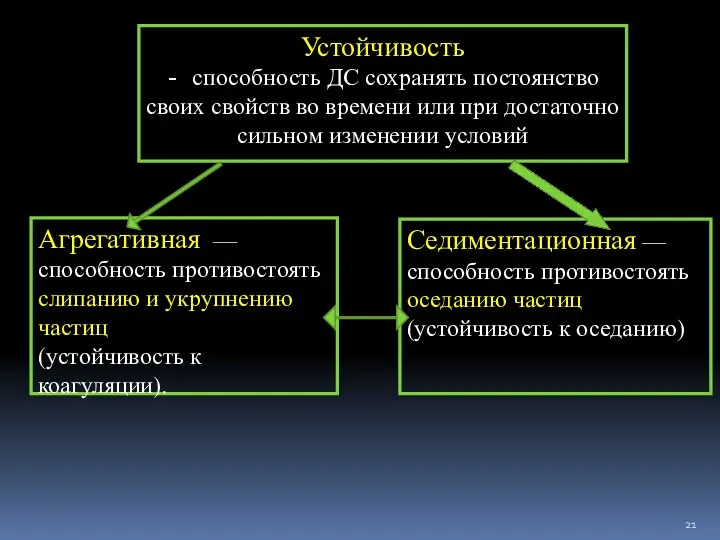
- 21. Устойчивость - способность ДС сохранять постоянство своих свойств во времени или при достаточно сильном изменении условий
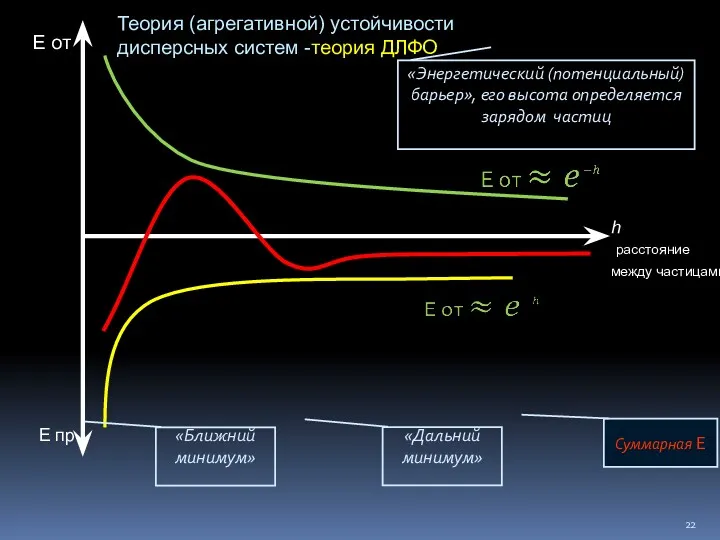
- 22. h расстояние между частицами Е от Е пр Суммарная Е «Ближний минимум» «Дальний минимум» «Энергетический (потенциальный)
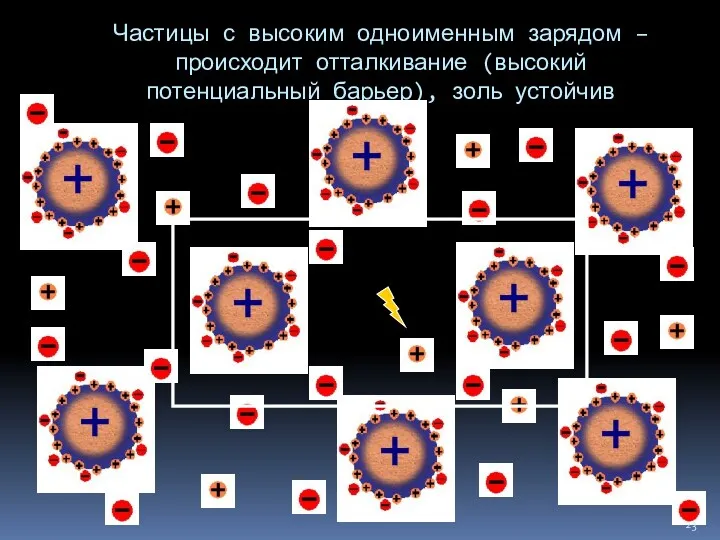
- 23. Частицы с высоким одноименным зарядом – происходит отталкивание (высокий потенциальный барьер), золь устойчив
- 24. Коагуляция - самопроизвольное укрупнение частиц твердой дисперсной фазы в золях (чаще - под действием электролита). Порог
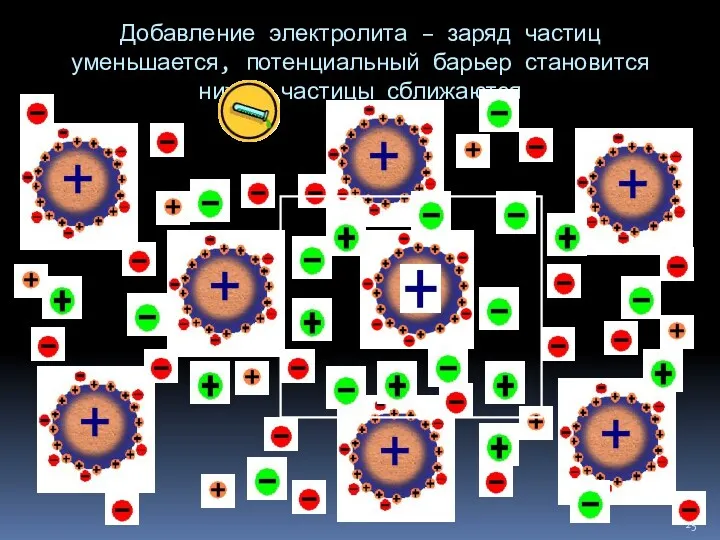
- 25. Добавление электролита – заряд частиц уменьшается, потенциальный барьер становится ниже, частицы сближаются
- 26. Частицы притягиваются - КОАГУЛЯЦИЯ
- 27. (изоэлектрическое состояние: {mAgI ∙nI – ∙ nK+}. Li+, Na+, K+, Rb+, Cs+, F–, Сl–, Вr–, NO3–,
- 28. 3. Коагуляция золей электролитами, содержащими многозарядный ион может произойти перезарядка золя {mAg · n I– ·(n
- 29. Правило Шульце — Гарди: коагулирующая способность иона тем больше, чем больше его заряд: Ск1: Ск2 :Ск3
- 30. Гетерокоагуляция – взаимодействие частиц, различных по заряду и величине. Взаимная коагуляция происходит при смешивании золей с
- 32. Скачать презентацию















 Электрическая цепь
Электрическая цепь Конденсаторы. Виды конденсаторов
Конденсаторы. Виды конденсаторов Урок по теме: Механическая энерия, 10 класс
Урок по теме: Механическая энерия, 10 класс Электрическое поле. Напряженность и потенциал электрического поля
Электрическое поле. Напряженность и потенциал электрического поля Закон электромагнитной индукции Фарадея
Закон электромагнитной индукции Фарадея Replacement of controller (Decos Ⅲc)
Replacement of controller (Decos Ⅲc) Спектроскопические методы. Импульсные методы исследования. Тема 2.3
Спектроскопические методы. Импульсные методы исследования. Тема 2.3 11 класс. Презентация по физике на тему Волновые явления.
11 класс. Презентация по физике на тему Волновые явления. Сложные и нестандартные задачи ЕГЭ по физике
Сложные и нестандартные задачи ЕГЭ по физике Басқару механизмдерінің техникалық қызмет көрсетуі
Басқару механизмдерінің техникалық қызмет көрсетуі Необслуживаемые автомобильные аккумуляторы
Необслуживаемые автомобильные аккумуляторы Сила трения
Сила трения Стискання газів. Рівняння Менделєєва-Клапейрона
Стискання газів. Рівняння Менделєєва-Клапейрона Машини та обладнання для тваринництва. Механізація доставки та роздавання кормів
Машини та обладнання для тваринництва. Механізація доставки та роздавання кормів Теория решения изобретательских задач. Законы развития технических систем
Теория решения изобретательских задач. Законы развития технических систем Параллельное соединение проводников.
Параллельное соединение проводников. Термодинамические свойства воды и водяного пара
Термодинамические свойства воды и водяного пара Адгезия және сулану. Дәріс 6
Адгезия және сулану. Дәріс 6 Взаємодія тіл. Імпульс. Закон збереження імпульсу
Взаємодія тіл. Імпульс. Закон збереження імпульсу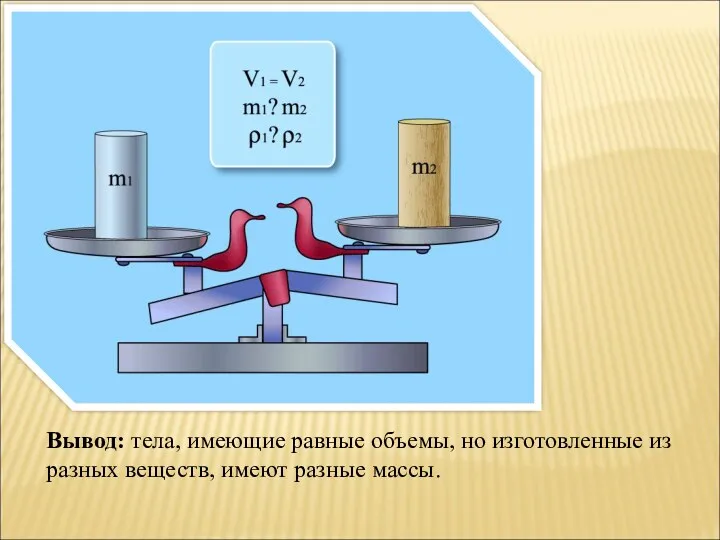 Презентация к уроку Плотность вещества
Презентация к уроку Плотность вещества Урок по теме Энергия топлива. Удельная теплота сгорания топлива
Урок по теме Энергия топлива. Удельная теплота сгорания топлива презентация: использование ядерной энергии 2
презентация: использование ядерной энергии 2 Входные устройства (ВУ) ГТД
Входные устройства (ВУ) ГТД Презентации 7 класс: ВВЕДЕНИЕ
Презентации 7 класс: ВВЕДЕНИЕ Техническое обслуживание и ремонт автомобильного транспорта
Техническое обслуживание и ремонт автомобильного транспорта Биологическое действие радиации. Закон радиоактивного распада. 9 класс
Биологическое действие радиации. Закон радиоактивного распада. 9 класс Система Motronic. Система управления двигателем
Система Motronic. Система управления двигателем Резьбовые соединения
Резьбовые соединения