Содержание
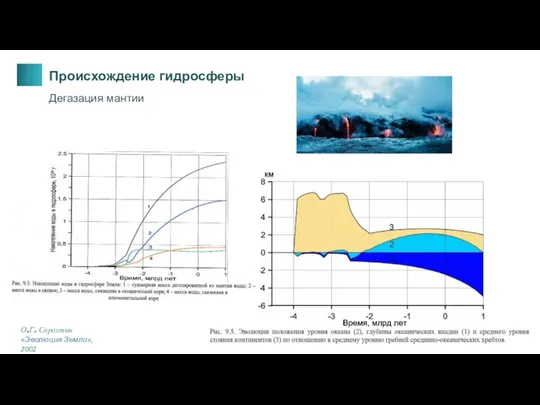
- 2. При дегазации мантии Земли (ювенильные воды) [Зюсс, 1902; Rubey, 1951] Непосредственно из межзвездного пыле-газового облака или
- 3. H He He C, O C Ne, Na, Mg Ne O, Mg O от Si до
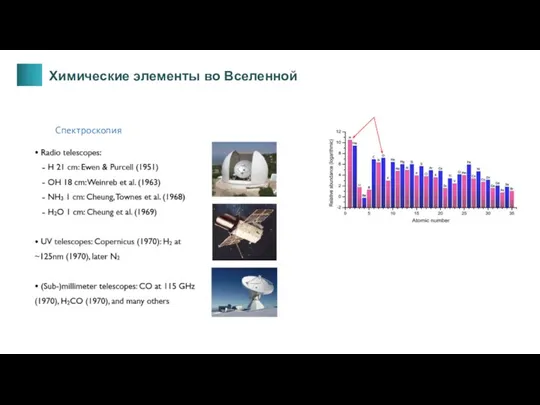
- 4. Химические элементы во Вселенной Спектроскопия
- 5. Вода во Вселенной В межзвездном пространстве (газ) В Солнечной системе (лед и жидкость) Марс Луна Уран,
- 6. О.Г. Сорохтин «Эволюция Земли», 2002 Происхождение гидросферы Дегазация мантии
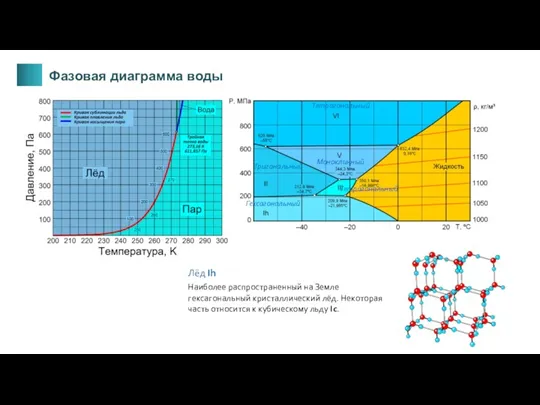
- 7. Кривые плавления, насыщения пара и сублимации; I – обычный лед; II - XV – структурные модификации
- 8. Гексагональный Моноклинный Тетрагональный Тригональный Тетрагональный Наиболее распространенный на Земле гексагональный кристаллический лёд. Некоторая часть относится к
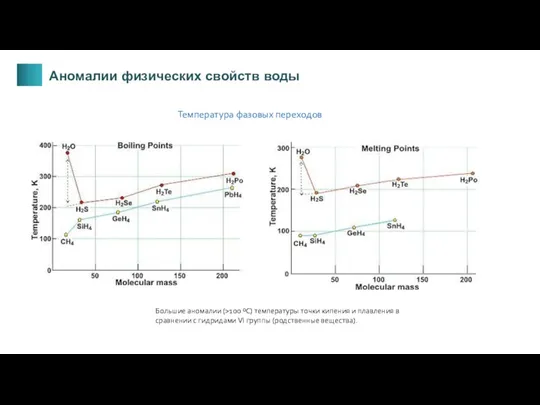
- 9. Температура фазовых переходов Большие аномалии (>100 ºС) температуры точки кипения и плавления в сравнении с гидридами
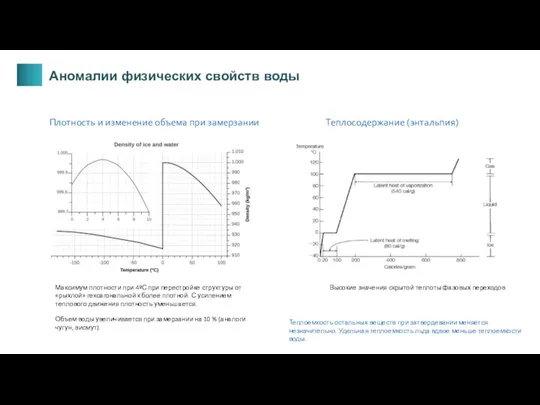
- 10. Плотность и изменение объема при замерзании Максимум плотности при 4ºС при перестройке структуры от «рыхлой» гексагональной
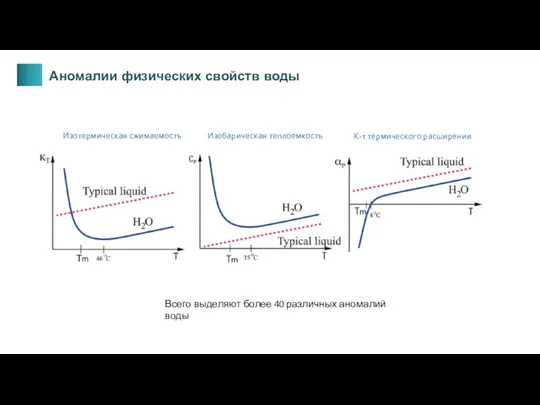
- 11. Изотермическая сжимаемость Изобарическая теплоемкость К-т термического расширения Всего выделяют более 40 различных аномалий воды Аномалии физических
- 12. С чем связано большое количество аномалий воды?
- 13. Содержание «тяжелой воды» H2O [Генри Кавендиш, 1781] Оксид водорода (гидроксид водорода, гидроксильная кислота)). Молекулярная масса 18,016.
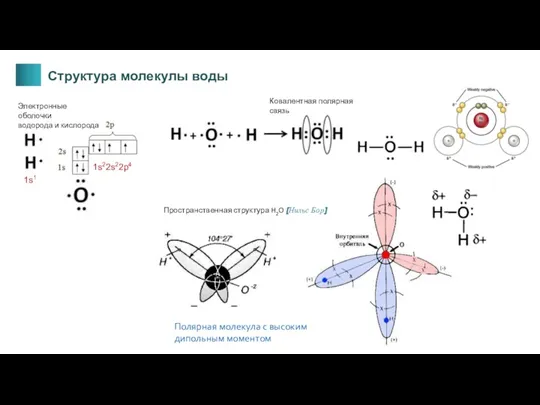
- 14. Полярная молекула с высоким дипольным моментом Пространственная структура H2O [Нильс Бор] Ковалентная полярная связь 1s1 1s22s22p4
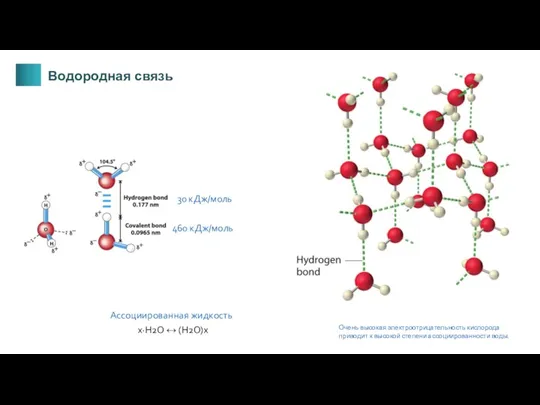
- 15. 30 кДж/моль 460 кДж/моль Ассоциированная жидкость x·H2O ↔ (H2O)x Очень высокая электроотрицательность кислорода приводит к высокой
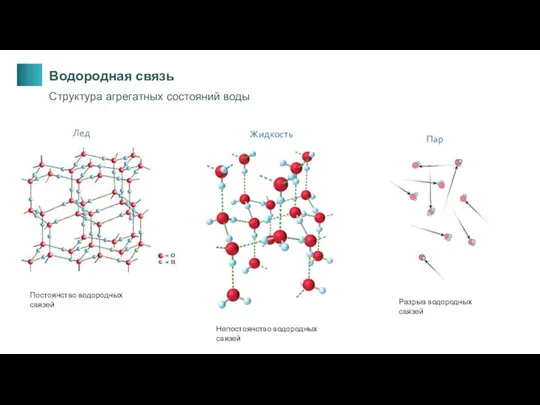
- 16. Пар Жидкость Лед Разрыв водородных связей Постоянство водородных связей Непостоянство водородных связей Водородная связь Структура агрегатных
- 17. Однородные Все участки воды однородны, не происходит разрывов водородных связей между молекулами, только «растяжение и изгиб»
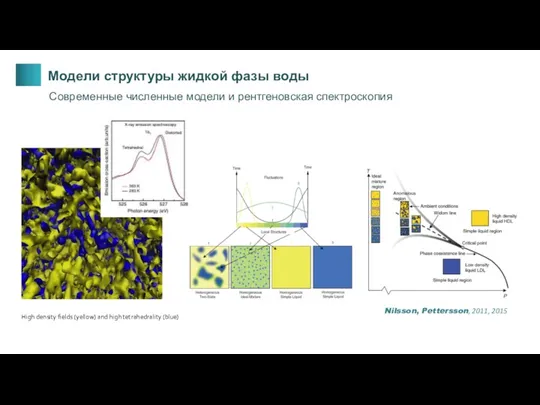
- 18. High density fields (yellow) and high tetrahedrality (blue) Nilsson, Pettersson, 2011, 2015 Модели структуры жидкой фазы
- 19. Роль аномалий физических свойств воды
- 21. Скачать презентацию
![При дегазации мантии Земли (ювенильные воды) [Зюсс, 1902; Rubey, 1951]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/266534/slide-1.jpg)




![Содержание «тяжелой воды» H2O [Генри Кавендиш, 1781] Оксид водорода (гидроксид](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/266534/slide-12.jpg)


 Материаловедение. Электромагнитные и теплофизические свойства материалов
Материаловедение. Электромагнитные и теплофизические свойства материалов Закон всемирного тяготения
Закон всемирного тяготения Презентация к уроку Квантовые постулаты Бора, 11 класс
Презентация к уроку Квантовые постулаты Бора, 11 класс Динамика вращательного движения твердого тела. Лекция 5
Динамика вращательного движения твердого тела. Лекция 5 Конспект лекций по курсу Лазерные измерительные системы
Конспект лекций по курсу Лазерные измерительные системы Изучение основ электричества и магнетизма
Изучение основ электричества и магнетизма Демонстрационный эксперимент по физике
Демонстрационный эксперимент по физике Квантовая физика
Квантовая физика Виды реактивных двигателей
Виды реактивных двигателей Структура пограничного слоя при продольном обтекании сотовой поверхности
Структура пограничного слоя при продольном обтекании сотовой поверхности Работа, теплота, первое начало в термодинамике. (Лекция 6)
Работа, теплота, первое начало в термодинамике. (Лекция 6) Радиометр радона и его дочерних продуктов распада РАМОН-02
Радиометр радона и его дочерних продуктов распада РАМОН-02 урок физики в 10 классе Теплопередача. Количество теплоты
урок физики в 10 классе Теплопередача. Количество теплоты Решение задач Закон Ома для участка цепи, последовательное и параллельное соединение проводников
Решение задач Закон Ома для участка цепи, последовательное и параллельное соединение проводников Механика твердого тела. Динамика вращений
Механика твердого тела. Динамика вращений Методическое пособие по теме Геометрическая оптика
Методическое пособие по теме Геометрическая оптика ОГЭ - 2016. Физика.
ОГЭ - 2016. Физика. к уроку физики Основные единицы измерения системы СИ
к уроку физики Основные единицы измерения системы СИ Простая физика сложных явлений
Простая физика сложных явлений Теория симметричного вибратора
Теория симметричного вибратора Вводный урок по физике в 7 классе.
Вводный урок по физике в 7 классе. Теорема Гаусса для диэлектриков
Теорема Гаусса для диэлектриков Явление диффузии в жидкостях
Явление диффузии в жидкостях Основы электростатики. (Лекция 7)
Основы электростатики. (Лекция 7) Оптоэлектроника
Оптоэлектроника Настоящее и будущее магнитов и ферромагнитной жидкости
Настоящее и будущее магнитов и ферромагнитной жидкости Движение в неинерциальной системе отсчета
Движение в неинерциальной системе отсчета Решение задач по физике. Подготовка к проверочной работе. 7 класс
Решение задач по физике. Подготовка к проверочной работе. 7 класс