Содержание
- 2. Основные вопросы: 1. Поверхностная энергия и поверхностное натяжение Адсорбция на поверхности жидкости (на подвижной границе раздела
- 3. Дисперсные системы – гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии). Поверхностные
- 4. Все поверхности раздела в зависимости от агрегатного состояния граничащих фаз делят на 2 типа: 1. Подвижные
- 5. В любом живом организме содержится огромное количество гетерогенных систем, на поверхности раздела которых происходят важнейшие биохимические
- 6. Например: -поверхность кожи взрослого человека около 1,5 м²; - площадь поверхности эритроцитов крови человека около 3500
- 7. Поверхностная энергия. Поверхностное натяжение.
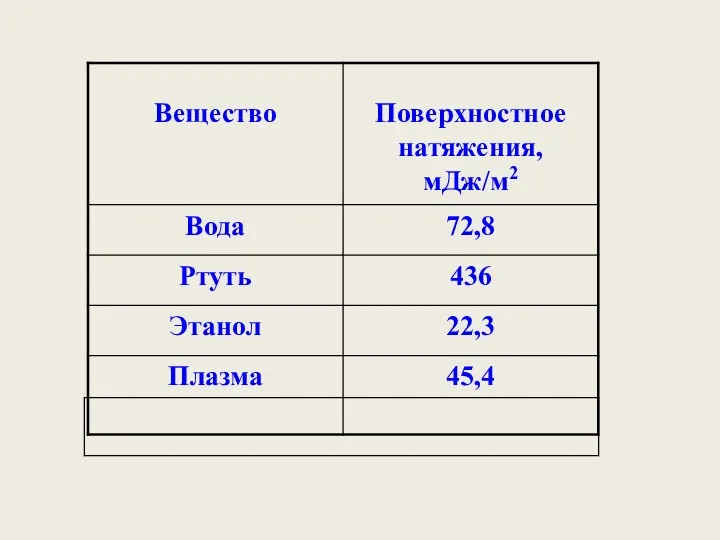
- 8. Gs–поверхностная энергия Гиббса, Дж; σ - коэффициент пропорциональности, назы- ваемый поверхностным натяжением, Дж/м2; S – площадь
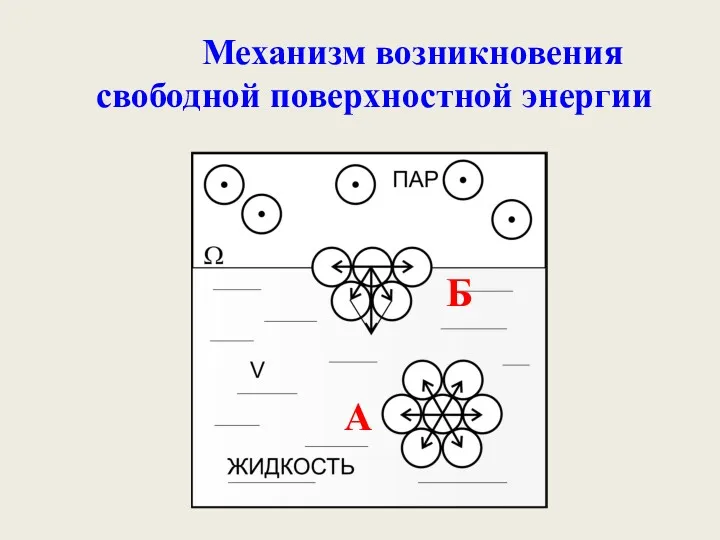
- 9. Механизм возникновения свободной поверхностной энергии А Б
- 10. Поверхностная энергия, отнесенная к единице площади поверхности, называется поверхностным натяжением.
- 12. Поверхностное натяжение зависит: 1. Природы жидкости; 2. Температуры; σ↓ , Т↑ 3. Давления; σ↓ , р↑
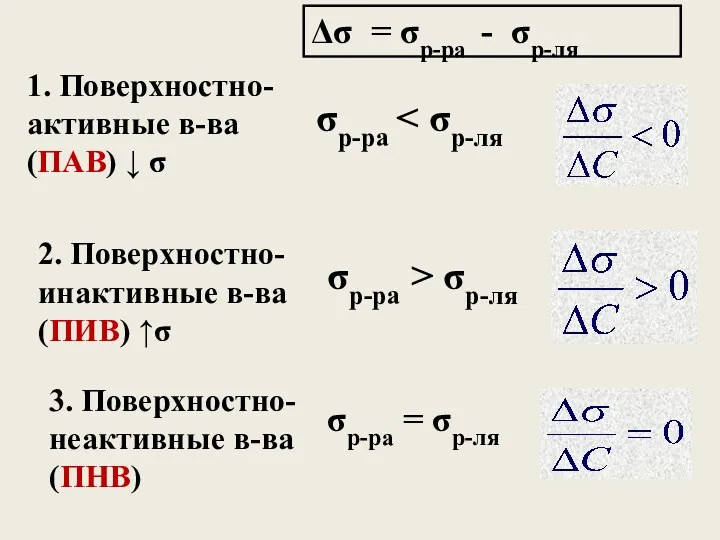
- 13. Поверхностная активность – это способность растворенных веществ изменять поверхностное натяжение растворителя. Δσ - изменение поверхностного натяжения,
- 14. 1. Поверхностно- активные в-ва (ПАВ) ↓ σ 2. Поверхностно- инактивные в-ва (ПИВ) ↑σ 3. Поверхностно- неактивные
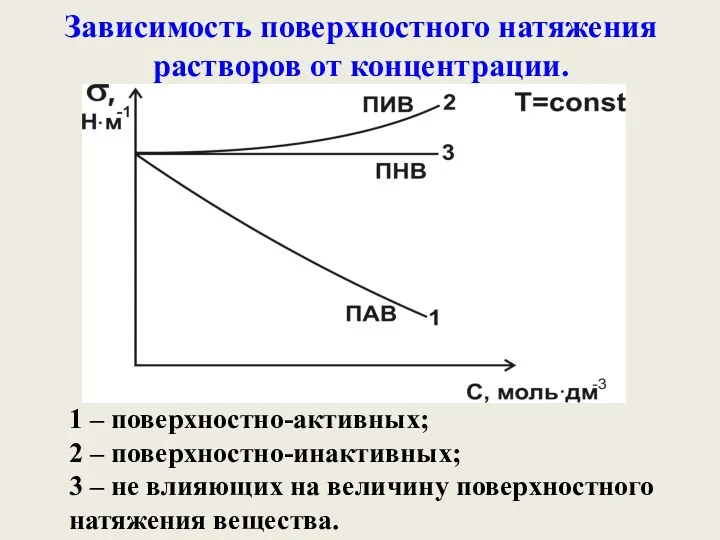
- 16. Зависимость поверхностного натяжения растворов от концентрации. 1 – поверхностно-активных; 2 – поверхностно-инактивных; 3 – не влияющих
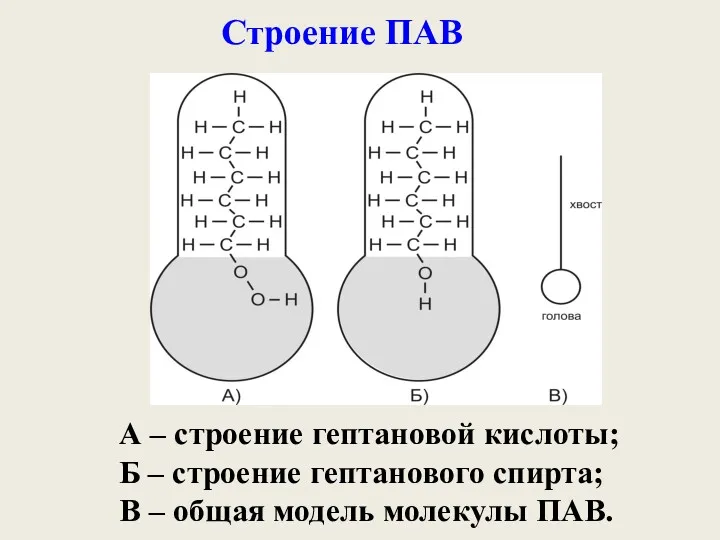
- 17. Строение ПАВ А – строение гептановой кислоты; Б – строение гептанового спирта; В – общая модель
- 18. Правило Дюкло – Траубе: Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в
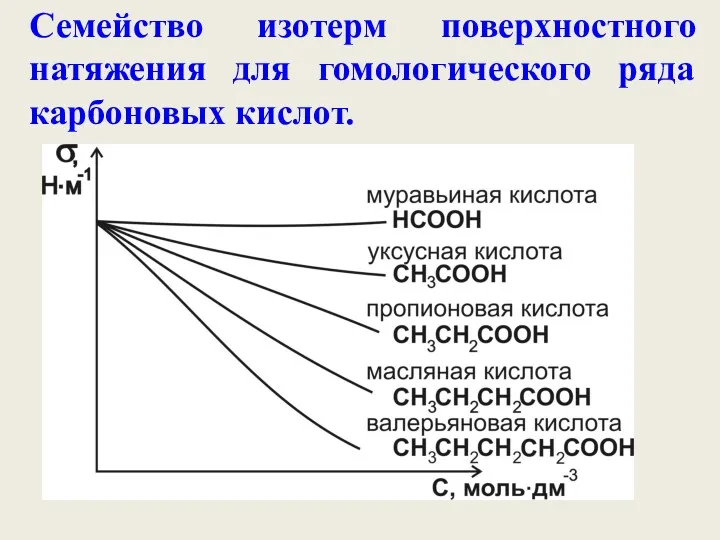
- 19. Семейство изотерм поверхностного натяжения для гомологического ряда карбоновых кислот.
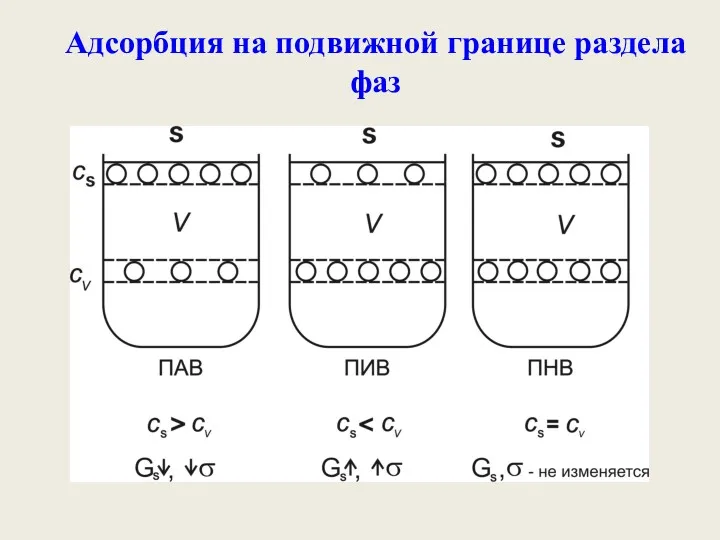
- 20. Адсорбция на подвижной границе раздела фаз
- 21. Адсорбция – самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз. ( Г ) моль/м2 или
- 22. Уравнение Гиббса. Г – адсорбция, моль/м2; С – равновесная концентрация растворенного вещества, моль/дм3; R – универсальная
- 23. Анализ уравнения Гиббса.
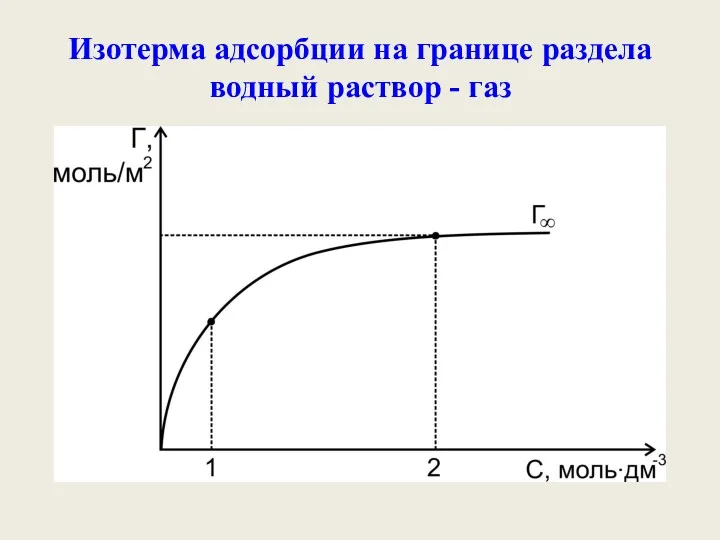
- 24. Изотерма адсорбции на границе раздела водный раствор - газ
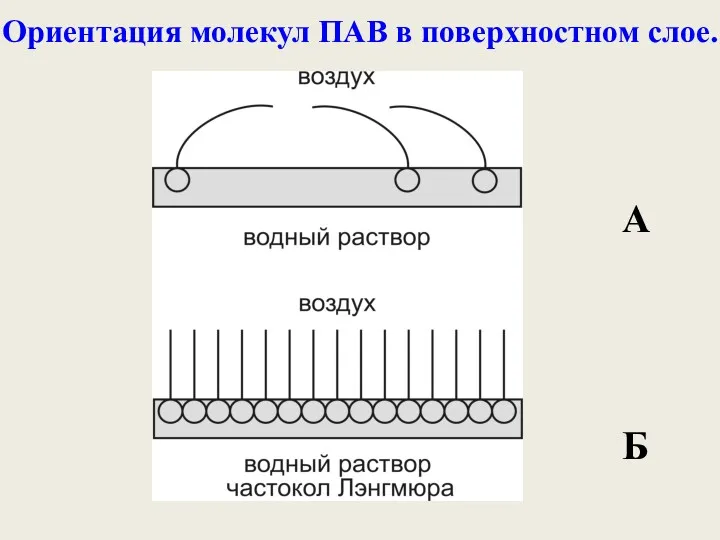
- 25. Ориентация молекул ПАВ в поверхностном слое. А Б
- 26. 1. Даниэль- Давсон (1937) (симметричная структура биологической мембраны). 2. Жидко-мозаично-твердо-каркасная модель (ассимитричное распределение белков в клеточных
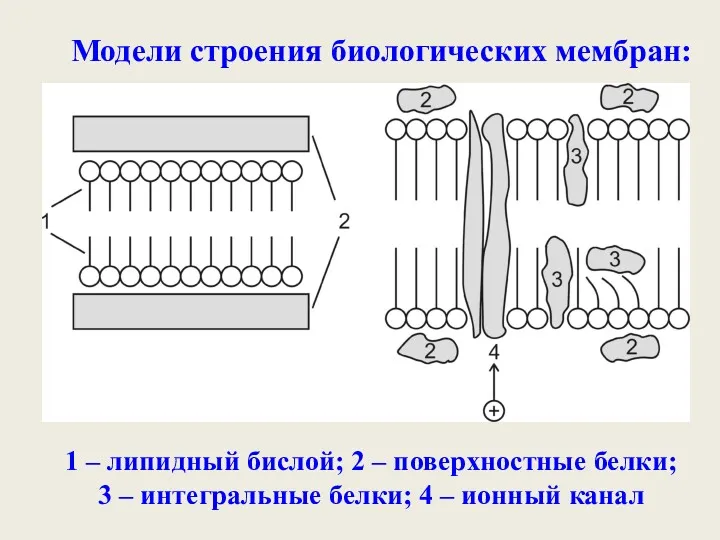
- 27. Модели строения биологических мембран: 1 – липидный бислой; 2 – поверхностные белки; 3 – интегральные белки;
- 28. Адсорбция на неподвижной поверхности Физическая адсорбция: Процесс самопроизвольный; за счет сил Ван-дер-Ваальса; обратимый; мало специфичный; энергия
- 29. Химическая адсорбция ( хемосорбция ): энергия связи 70-400 кДж/моль; специфична; необратима.
- 30. Адсорбция зависит: Природы адсорбента; Природы адсорбата; Температуры; ↑ Т, адсорбция ↓ Давления. ↑ Р (для газов),
- 31. Полярные адсорбенты: Al2O3 ∙ xH2O; силикагель SiO2 ∙ xH2O; крахмал; целлюлоза; Неполярные: Активированный уголь; графитированная сажа
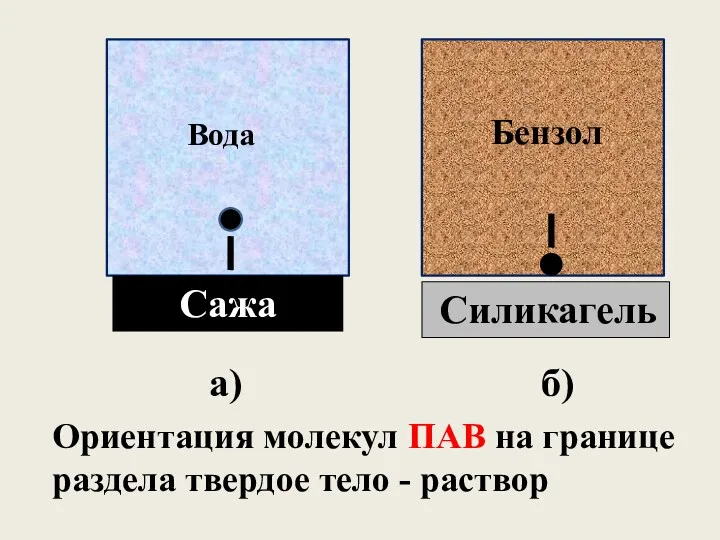
- 32. Сажа Силикагель Вода Бензол а) б) Ориентация молекул ПАВ на границе раздела твердое тело - раствор
- 33. Основными факторами, обуславливающими специфичность адсорбции сильных электролитов, являются: - Заряд иона; Z ↑; адсорбция ↑; -
- 34. Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+ NO3¯ > I¯> Br¯> Cl¯>
- 35. Теория мономолекулярной адсорбции Лэнгмюра (1915)
- 36. Уравнение адсорбции Лэнгмюра. Г – адсорбция, моль/м2; Г∞ – предельная адсорбция, моль/м2; С – равновесная концентрация
- 37. Характеристика уравнения Лэнгмюра: Имеет теоретическое обоснование; 2. Применимо для подвижной и неподвижной границ раздела фаз; 3.
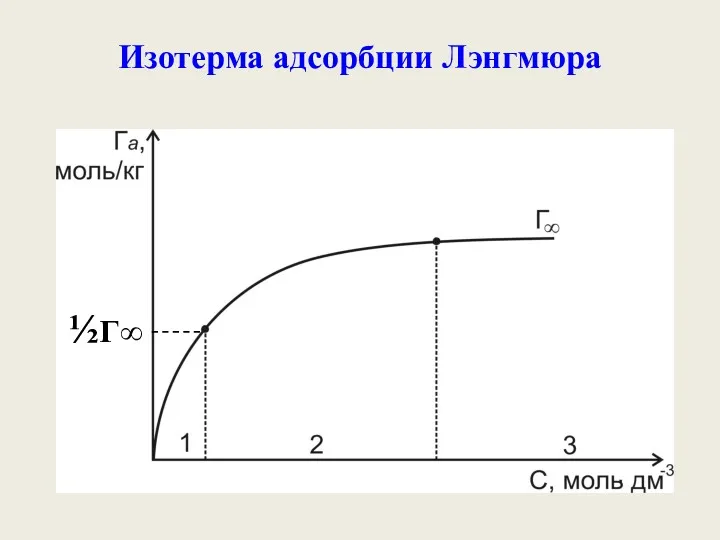
- 38. Изотерма адсорбции Лэнгмюра ½Г∞
- 39. Анализ уравнения Лэнгмюра.
- 40. Уравнение Фрейндлиха. К, 1/n – эмпирические постоянные, т.е. на основе экспериментальных данных; С – равновесная концентрация
- 41. Характеристика уравнения Фрейндлиха: Уравнение получено эмпирически (экспериментально); Применимо только для твердых поверхностей; Справедливо только для средних
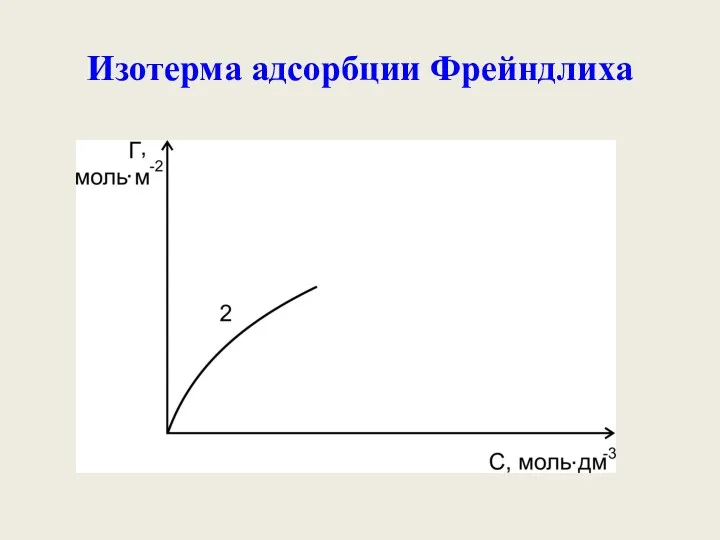
- 42. Изотерма адсорбции Фрейндлиха
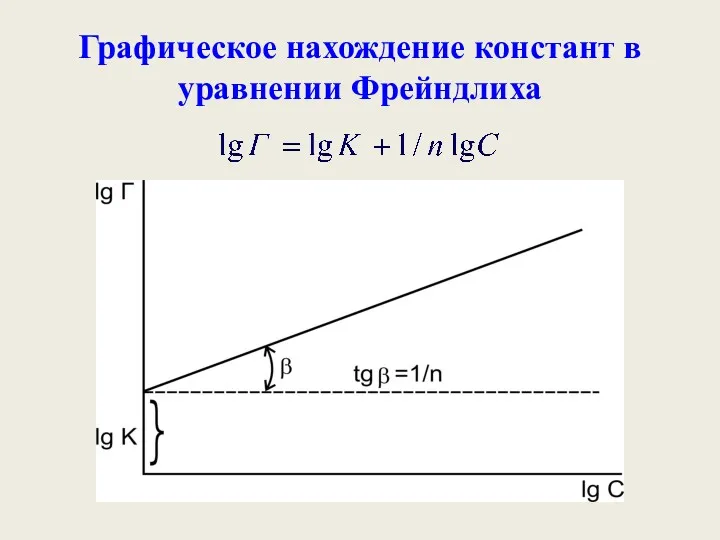
- 43. Графическое нахождение констант в уравнении Фрейндлиха
- 44. Полимолекулярная адсорбция. Теория БЭТ (С. Брунаэр, П. Эммет, Е. Теллер) (1935 – 1940 г.г.)
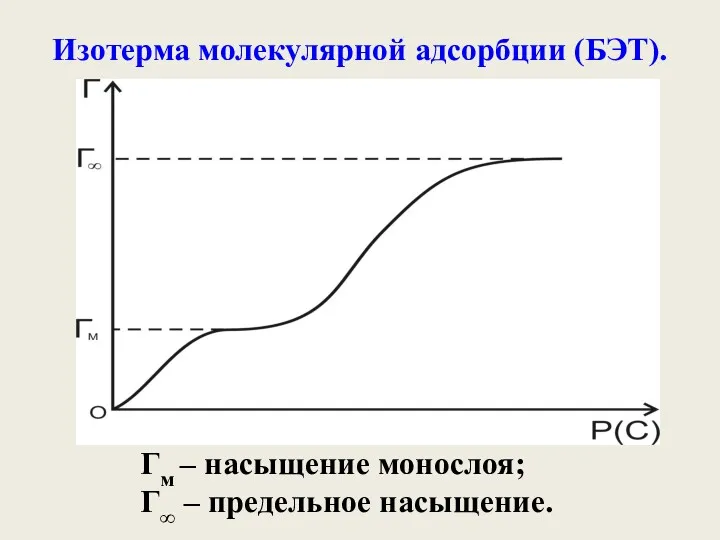
- 45. Изотерма молекулярной адсорбции (БЭТ). Гм – насыщение монослоя; Г∞ – предельное насыщение.
- 46. Схема строения адсорбционного слоя по теории БЭТ
- 47. Признаки объектов коллоидной химии
- 48. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц
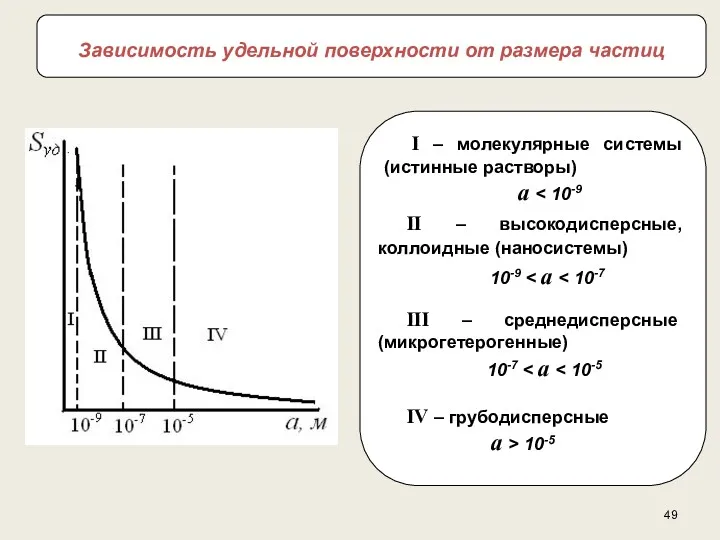
- 49. Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 III – среднедисперсные (микрогетерогенные)
- 50. Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность
- 51. Особенности коллоидных систем 2. Термодинамическая неустойчивость 3. Невоспроизводимость (индивидуальность) 4. Способность к структурообразованию
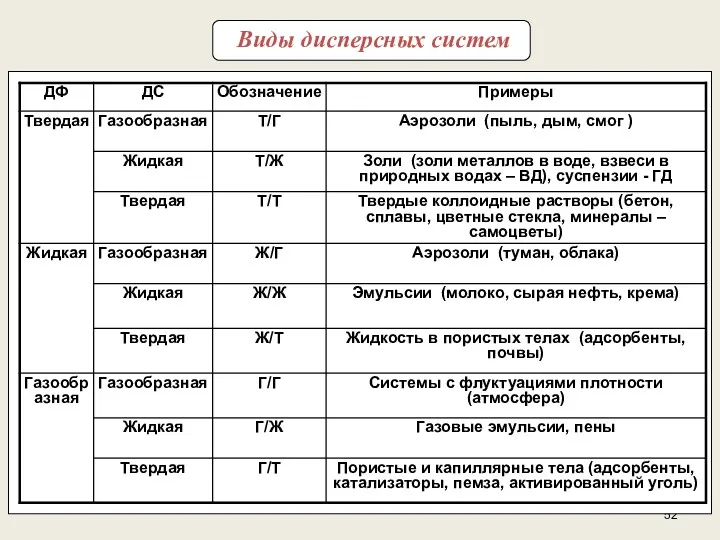
- 52. Виды дисперсных систем
- 53. Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние
- 54. Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.) Понизители твердости составляют 0,1 %
- 55. основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют
- 56. Стадии конденсации 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС).
- 57. Физические конденсационные методы
- 58. Химические конденсационные методы
- 60. 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:
- 61. 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение
- 62. Метод пептизации
- 63. Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью
- 64. Особенности коллоидных растворов Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света,
- 65. 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического
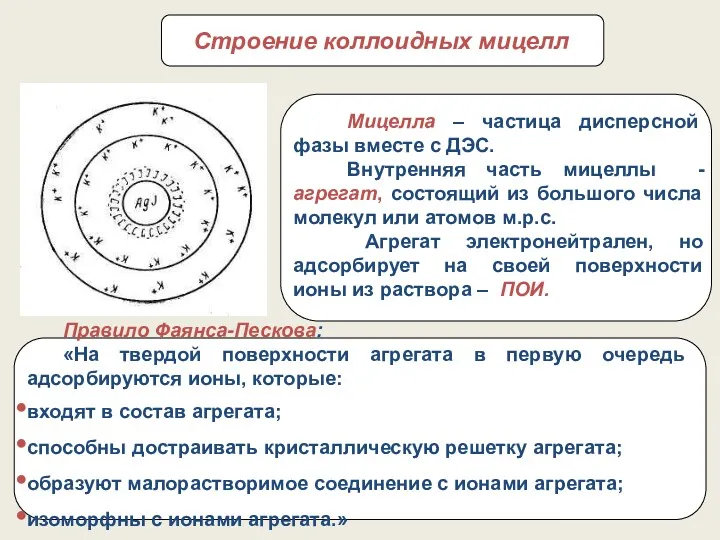
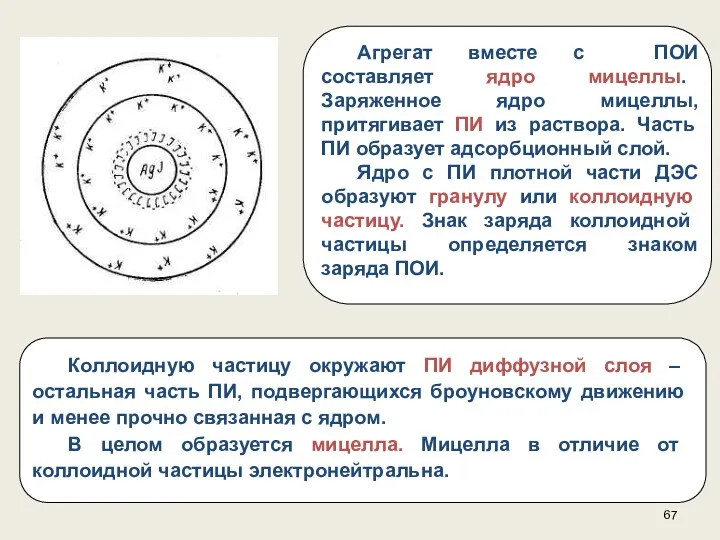
- 66. Строение коллоидных мицелл
- 68. Пример 1:
- 69. Устойчивость и коагуляция дисперсных систем
- 70. Коагуляция золей электролитами Все электролиты при определенной концентрации могут вызвать коагуляцию золя. Правило знака заряда: коагуляцию
- 71. Порог коагуляции (γ, Скр) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая
- 73. Скачать презентацию



















































 Презентация к уроку в 11 классе Лазеры
Презентация к уроку в 11 классе Лазеры Законы Сохранения в Механике
Законы Сохранения в Механике РБМК (реактор большой мощности канальный). Лекция 8
РБМК (реактор большой мощности канальный). Лекция 8 Классический метод расчета переходных процессов. Переходные процессы в цепях с r и L, r и C при постоянных напряжениях. Лекция 8
Классический метод расчета переходных процессов. Переходные процессы в цепях с r и L, r и C при постоянных напряжениях. Лекция 8 Простые механизмы
Простые механизмы Физические явления – основа разделения смесей в химии
Физические явления – основа разделения смесей в химии Измерительные приборы в физике
Измерительные приборы в физике Альтернативные виды топлива
Альтернативные виды топлива Элементы специальной теории относительности. Релятивистская кинематика
Элементы специальной теории относительности. Релятивистская кинематика Условные обозначения элементов цепи
Условные обозначения элементов цепи виды излучений. физика 11 класс
виды излучений. физика 11 класс Тюнинг системы цветомузыки автомобиля
Тюнинг системы цветомузыки автомобиля Аеродинамічні характеристики літака. Аеродинамічне компонування літака. (Лекція 7.4.1)
Аеродинамічні характеристики літака. Аеродинамічне компонування літака. (Лекція 7.4.1) Прибор расходомер
Прибор расходомер Исследование структуры и электронного состояния оптически активных центров в алмазе, связанных с вхождением кремния и германия
Исследование структуры и электронного состояния оптически активных центров в алмазе, связанных с вхождением кремния и германия Инсоляция. Актуальность проблемы инсоляции в крупных городах
Инсоляция. Актуальность проблемы инсоляции в крупных городах Проводниковые материалы и изделия
Проводниковые материалы и изделия Детали машин (часть 1)
Детали машин (часть 1) Судовые электроэнергетические системы. Содержание программы ГИА
Судовые электроэнергетические системы. Содержание программы ГИА Урок для учащихся 8 класса Изображения, даваемые линзой
Урок для учащихся 8 класса Изображения, даваемые линзой Магнітостатика. Магнітне поле. Вектор магнітної індукції. (Лекція 12)
Магнітостатика. Магнітне поле. Вектор магнітної індукції. (Лекція 12) Дифракциялық тор және оның спектрлік сипаттамасы. Майкельсон эшелоны. Көп өлшемді құрылымдағы дифракция
Дифракциялық тор және оның спектрлік сипаттамасы. Майкельсон эшелоны. Көп өлшемді құрылымдағы дифракция Обобщающий урок по физике 8 класс Тепловые явления.Агрегатные состояния вещества
Обобщающий урок по физике 8 класс Тепловые явления.Агрегатные состояния вещества Механика и свойства жидкостей. (Лекция 3)
Механика и свойства жидкостей. (Лекция 3) Давление в жидкости и газе. Закон Паскаля
Давление в жидкости и газе. Закон Паскаля Статическое электричество
Статическое электричество Основні способи отримання низьких та наднизьких температур
Основні способи отримання низьких та наднизьких температур Кинетическая энергия
Кинетическая энергия