Содержание
- 2. Каталитические процессы Общие сведения о каталитических процессах
- 3. Каталитические процессы Ряд химических превращений требует инициирования, для возможности протекания превращений с заметной скоростью. Таким инициатором
- 4. Определение катализатора Катализатор — это вещество (индивидуальное химические соединение или их смесь), присутствие которого в смеси
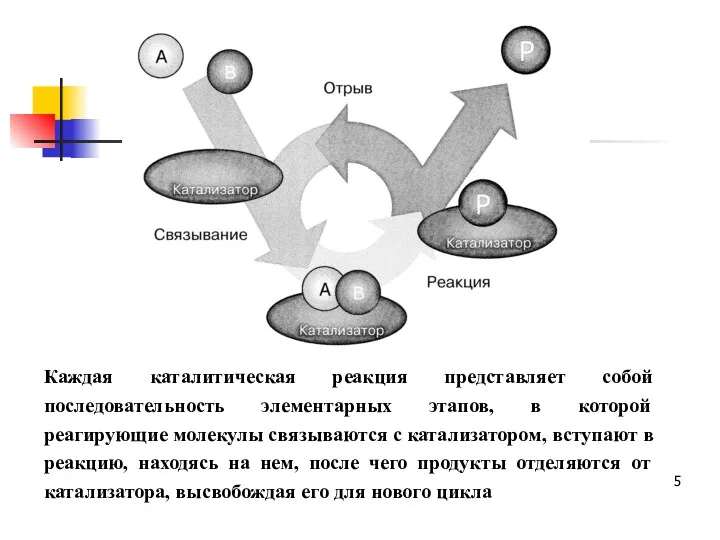
- 5. Каждая каталитическая реакция представляет собой последовательность элементарных этапов, в которой реагирующие молекулы связываются с катализатором, вступают
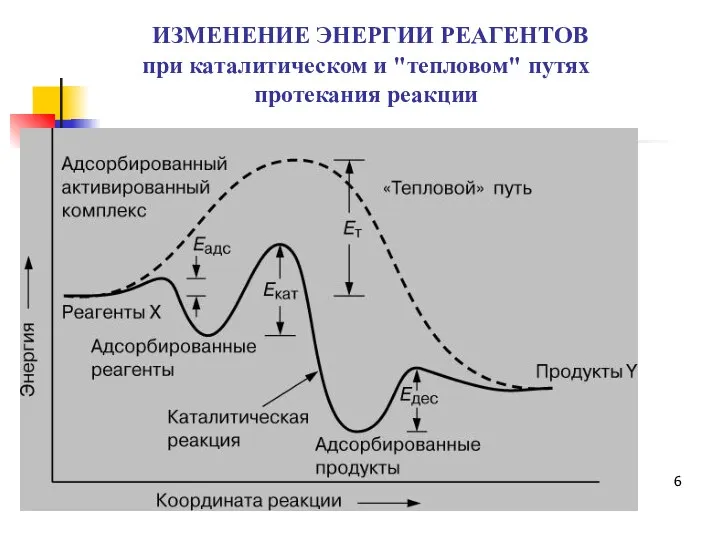
- 6. ИЗМЕНЕНИЕ ЭНЕРГИИ РЕАГЕНТОВ при каталитическом и "тепловом" путях протекания реакции
- 7. Выводы из энергетической диаграммы Катализатор предлагает альтернативный путь для реакции, который, очевидно, более сложен, но энергетически
- 8. Катализ является не только методом ускорения реакций, но и методом управления ими для направленного осуществления тех
- 9. Классификация катализаторов по фазовым признакам каталитические реакции : гомогенные, гетерогенные микрогетерогенные (ферментативные).
- 10. Типы каталитических систем гомогенная, когда реакционная смесь и катализатор находятся или в жидком или в газообразном
- 11. Процесс, в котором осуществляется гомогенная или ферментативная каталитическая реакция, – однофазный процесс, и к нему применимы
- 12. ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЙ ХИМИЧЕСКИЙ ПРОЦЕСС В гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах (например, катализатор
- 13. НЕПОРИСТОЕ ЗЕРНО КАТАЛИЗАТОРА Для быстрой реакции развивать внутреннюю поверхность нет необходимости. Например, окисление аммиака протекает на
- 14. Общие сведения Непористые катализаторы часто используются когда реакция быстрая и развивать внутреннюю поверхность не имеет смысла.
- 15. Схема процесса такая же, как в модели "сжимающаяся сфера", за одним исключением − твердое тело не
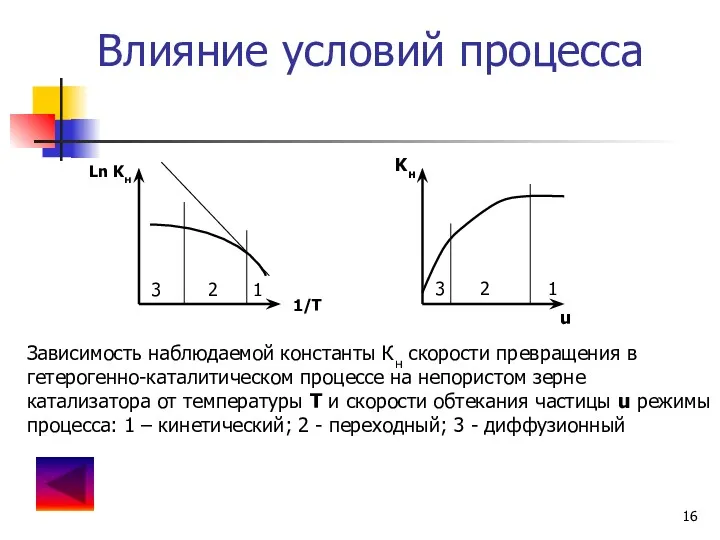
- 16. Влияние условий процесса Ln Kн 1/T Kн u 1 2 3 1 2 3 Зависимость наблюдаемой
- 17. ПРОЦЕСС В ПОРИСТОМ ЗЕРНЕ КАТАЛИЗАТОРА Пористую структуру характеризуют следующими измеряемыми параметрами: Sуд − удельная внутренняя поверхность,
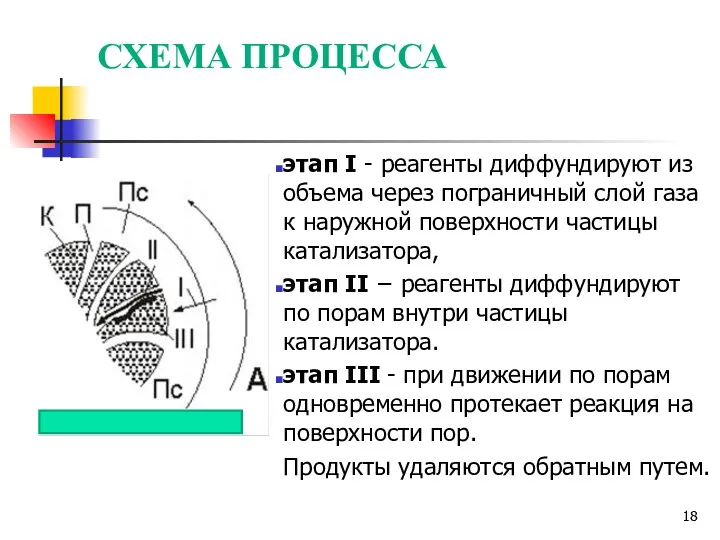
- 18. СХЕМА ПРОЦЕССА этап I - реагенты диффундируют из объема через пограничный слой газа к наружной поверхности
- 19. Пористое зерно катализатора представим как однородную сплошную среду. В ней протекает реакция со скоростью превращения W.
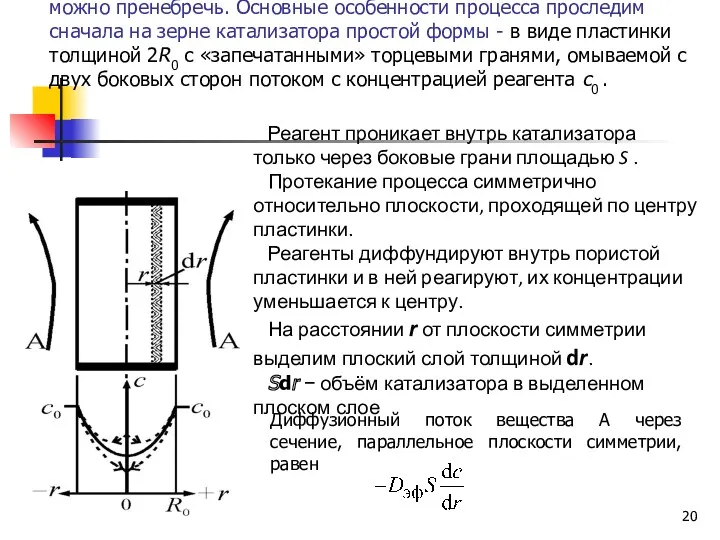
- 20. Рассмотрим процесс при интенсивном внешнем переносе, когда им можно пренебречь. Основные особенности процесса проследим сначала на
- 21. Изменение этого потока, проходящего через выделенный слой, обусловлено исчезновением в этом слое вещества А в результате
- 22. Анализ процесса в пористом зерне катализатора для реакции первого порядка: W(c) = −kc Введём: безразмерный радиус
- 23. общее решение после интегрирования линейного дифференциального уравнения с постоянными коэффициентами
- 24. Наблюдаемая скорость превращения - средне интегральная по пластинке скорость реакции:
- 26. наблюдаемая константа скорости Концентрация компонента уменьшается вглубь зерна катализатора, и потому Wн меньше, чем скорость при
- 27. Отношение наблюдаемой скорости превращения Wн в зерне катализатора к скорости при условиях на поверхности W(С0) называется
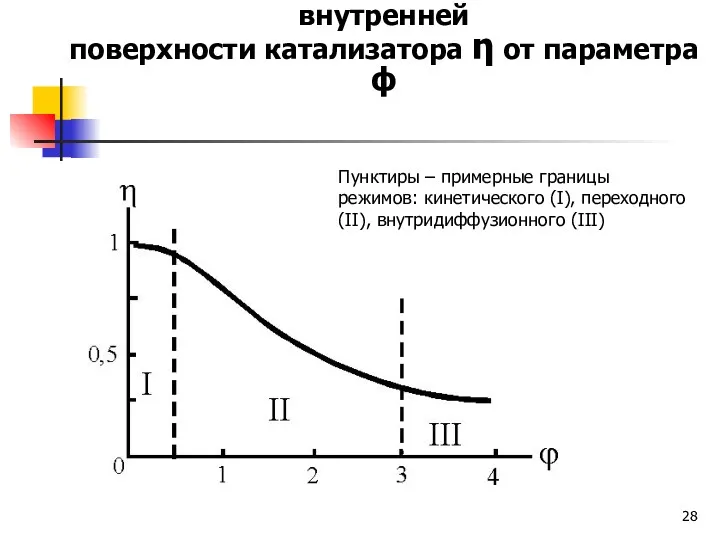
- 28. Зависимость степени использования внутренней поверхности катализатора η от параметра ϕ Пунктиры – примерные границы режимов: кинетического
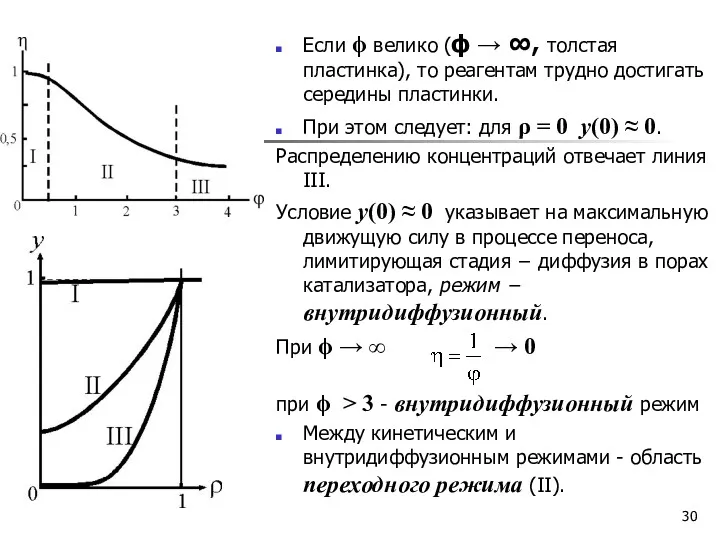
- 29. Режимы процесса Распределение относительной концентрации y по толщине зерна катализатора в кинетическом (I), переходном (II) и
- 30. Если ϕ велико (ϕ → ∞, толстая пластинка), то реагентам трудно достигать середины пластинки. При этом
- 31. Влияние температуры на наблюдаемую скорость превращения Wн(Т) зависимость от температуры: от температуры зависит константа скорости реакции
- 32. Зависимость константы скорости реакции k (пунктир) и наблюдаемой константы скорости превращения Кн в пористом зерне катализатора
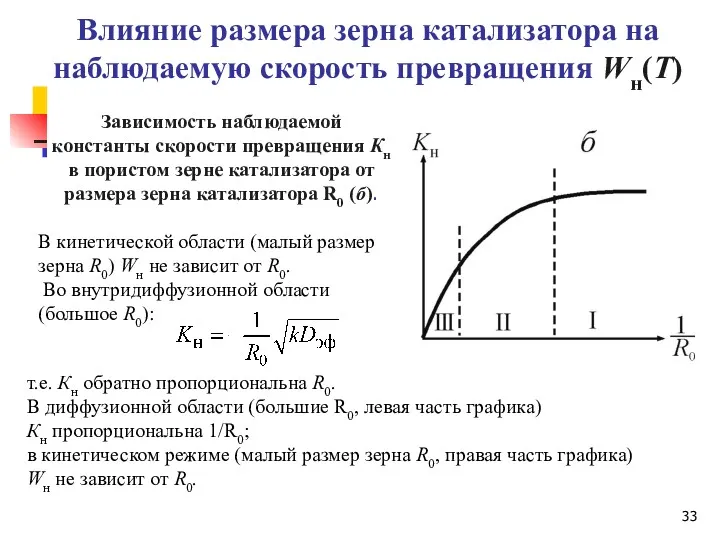
- 33. В кинетической области (малый размер зерна R0) Wн не зависит от R0. Во внутридиффузионной области (большое
- 34. Влияние формы зерна катализатора на наблюдаемую скорость превращения Wн(Т) В кинетической области концентрация вещества внутри зерна
- 35. Введем: приведенный размер зерна − отношение его объёма Vз к наружной поверхности Sз и приведенный параметр
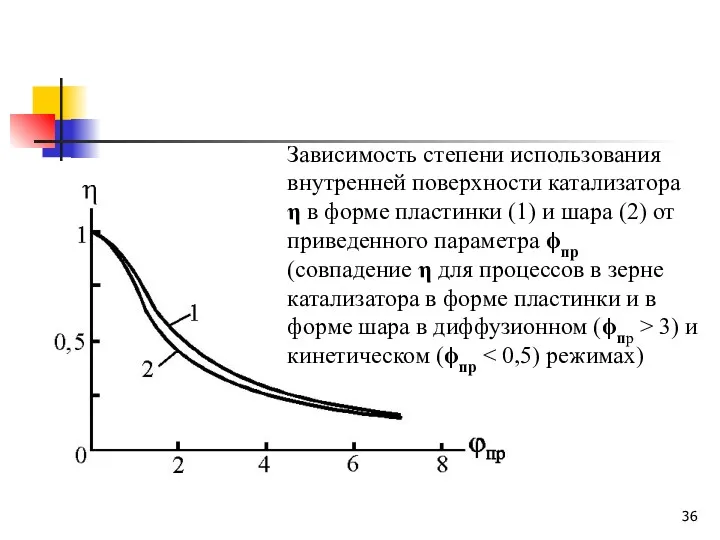
- 36. Зависимость степени использования внутренней поверхности катализатора η в форме пластинки (1) и шара (2) от приведенного
- 38. Скачать презентацию


























 Тормозная рычажная передача электровоза ВЛ 80
Тормозная рычажная передача электровоза ВЛ 80 Презентация к уроку Сила. Явления тяготения. Сила тяжести.
Презентация к уроку Сила. Явления тяготения. Сила тяжести. Мир в магнитах. При поддержке туристической компании Колесница
Мир в магнитах. При поддержке туристической компании Колесница Интерактивный учебный курс по изучению темы Оптика
Интерактивный учебный курс по изучению темы Оптика ТРИЗ Электричество
ТРИЗ Электричество Голография
Голография Открытый урок по физике в 9 кл на тему:Перемещение. Система отсчета
Открытый урок по физике в 9 кл на тему:Перемещение. Система отсчета Блок
Блок Центральное регулирование тепловой нагрузки
Центральное регулирование тепловой нагрузки Электромагнитные переходные процессы
Электромагнитные переходные процессы Последовательное и параллельное соединения проводников. Урок 37
Последовательное и параллельное соединения проводников. Урок 37 Игра – путешествие по теме Движение и взаимодействие тел
Игра – путешествие по теме Движение и взаимодействие тел Напівпровідники
Напівпровідники Электромагнитные колебания. Основные понятия
Электромагнитные колебания. Основные понятия Электрический ток в различных средах
Электрический ток в различных средах Лазеры. Light Amplification by Stimulated Emission of Radiation
Лазеры. Light Amplification by Stimulated Emission of Radiation Электромагнетизм. Электр және магнит өрістері
Электромагнетизм. Электр және магнит өрістері Уравнения бокового движения самолета (лекция № 8)
Уравнения бокового движения самолета (лекция № 8) Атмосфера
Атмосфера Интерференция света. Когерентность
Интерференция света. Когерентность Законы динамики (законы Ньютона). Лекция 5
Законы динамики (законы Ньютона). Лекция 5 Тепловые свойства горных пород
Тепловые свойства горных пород Закон Ома для участка цепи, последовательное и параллельное соединение проводников. Решение задач
Закон Ома для участка цепи, последовательное и параллельное соединение проводников. Решение задач Основы теплопередачи
Основы теплопередачи Электрическое поле. Напряженность электрического поля (10 класс)
Электрическое поле. Напряженность электрического поля (10 класс) Взаимодействие тел. Масса тела.
Взаимодействие тел. Масса тела. Почему радуга разноцветная (окружающий мир, 1 класс)
Почему радуга разноцветная (окружающий мир, 1 класс) Обобщающий урок-игра по физике Один за всех, все за одного Правила игры Первый конкурс Второй конкурс Третий конкурс Четвертый конкурс Пятый конкурс Шестой конкурс Седьмой конкурс Восьмой конкурс Подведение итогов Источники
Обобщающий урок-игра по физике Один за всех, все за одного Правила игры Первый конкурс Второй конкурс Третий конкурс Четвертый конкурс Пятый конкурс Шестой конкурс Седьмой конкурс Восьмой конкурс Подведение итогов Источники