Содержание
- 2. Химическая кинетика – раздел физической химии, в котором химические превращения веществ изучаются как процессы, протекающие во
- 3. Прямая задача – определение скоростей химических реакций и концентраций участников этих реакций в любой момент времени
- 4. ХИМИЧЕСКАЯ КИНЕТИКА Химическая реакция – процесс, при котором происходит разрыв существующих связей и образование новых Необходимо:
- 5. Молекулярность, определяется числом частиц (молекул, атомов, ионов), принимающих участие в элементарном акте химической реакции Мономолекулярные реакции
- 6. Скорость гетерогенной реакции ХИМИЧЕСКАЯ КИНЕТИКА Скорость химической реакции определяется числом соударений (элементарных актов химической реакции), приводящих
- 7. ХИМИЧЕСКАЯ КИНЕТИКА 2 H2O2 = 2 H2O + O2 α C(H2O2), моль/л τ, с А Средняя
- 8. Скорость химической реакции зависит от ХИМИЧЕСКАЯ КИНЕТИКА Природы реагирующих веществ Концентрации реагирующих веществ Температуры Наличия катализатора
- 9. ХИМИЧЕСКАЯ КИНЕТИКА (К. Гульдберг, П.Вааге, 1867 г. Норвегия) скорость химической реакции при постоянной температуре прямо пропорциональна
- 10. Константа скорости химической реакции НЕ ЗАВИСИТ от концентраций (парциальных давлений) участников реакции ХИМИЧЕСКАЯ КИНЕТИКА и ЗАВИСИТ
- 11. ХИМИЧЕСКОЕ И ФАЗОВОЕ РАВНОВЕСИЕ Химическое равновесие - состояние системы, в котором скорость прямой реакции (v1) равна
- 12. Молекулярность определяется по числу молекул одновременное соударение которых приводит к химическому взаимодействию ХИМИЧЕСКАЯ КИНЕТИКА Порядок реакции
- 13. Порядок реакции устанавливается экспериментально при обработке данных кинетических исследований и основан на решении кинетического уравнения ХИМИЧЕСКАЯ
- 14. Необратимые реакции 0-ого порядка А → В n = 0 где k - константа скорости необратимой
- 15. Необратимые реакции 0-ого порядка А → В ХИМИЧЕСКАЯ КИНЕТИКА Графическое определение константы скорости необратимой реакции 0-го
- 16. Необратимые реакции 0-ого порядка ХИМИЧЕСКАЯ КИНЕТИКА Время (период) полупревращения (полураспада) - время, в течение которого концентрация
- 17. ХИМИЧЕСКАЯ КИНЕТИКА интегрируем k τ, c Необратимые реакции 1-ого порядка А → В n = 1
- 18. Порядок реакции устанавливается экспериментально при обработке данных кинетических исследований и основан на решении кинетического уравнения ХИМИЧЕСКАЯ
- 19. ХИМИЧЕСКАЯ КИНЕТИКА правило Вант-Гоффа γ - температурный коэффициент скорости реакции Якоб Хендрик Вант-Гофф При повышении температуры
- 20. Зависимость скорости химической реакции от температуры ХИМИЧЕСКАЯ КИНЕТИКА Допущения Аррениуса - реагировать могут не все молекулы,
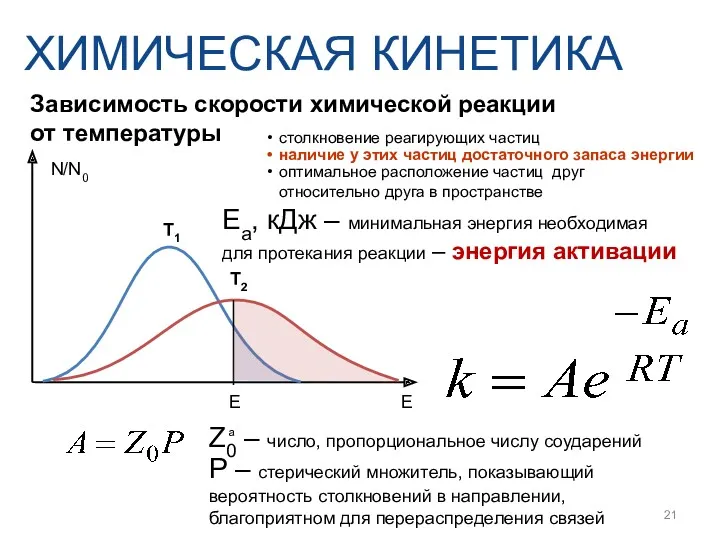
- 21. Зависимость скорости химической реакции от температуры ХИМИЧЕСКАЯ КИНЕТИКА Eа, кДж – минимальная энергия необходимая для протекания
- 22. Аналитический метод Определение энергии активации ХИМИЧЕСКАЯ КИНЕТИКА
- 23. Графический метод Определение энергии активации ХИМИЧЕСКАЯ КИНЕТИКА
- 24. ХИМИЧЕСКАЯ КИНЕТИКА Катализатор – вещество, увеличивающее скорость химической реакции и не расходующееся в процессе взаимодействия Гомогенный
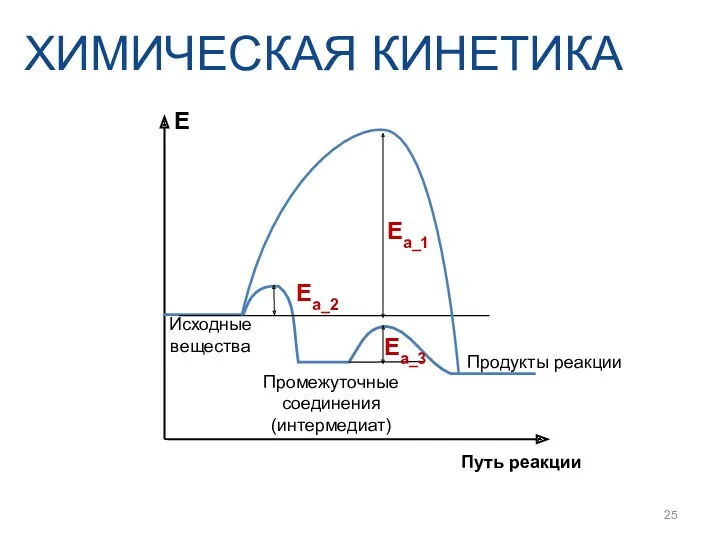
- 25. ХИМИЧЕСКАЯ КИНЕТИКА Ea_1 Ea_3 Ea_2 E Путь реакции Продукты реакции Промежуточные соединения (интермедиат) Исходные вещества
- 26. ХИМИЧЕСКАЯ КИНЕТИКА Сложные реакции - химические реакции, протекающие более чем в одну стадию Общая скорость таких
- 27. ХИМИЧЕСКАЯ КИНЕТИКА Классификация сложных реакций Последовательные реакции сложные реакции, протекающие таким образом, что вещества, образующиеся в
- 28. ХИМИЧЕСКАЯ КИНЕТИКА Классификация сложных реакций Цепные реакции реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся
- 29. ХИМИЧЕСКАЯ КИНЕТИКА Классификация сложных реакций Б.П. Белоусов А.М. Жаботинский Этого не может быть, потому что этого
- 30. ХИМИЧЕСКАЯ КИНЕТИКА Кинетика твердофазных реакций Механизм разрыва связи Связь между двумя атомами может разрываться по Гомолитическому
- 32. Скачать презентацию



























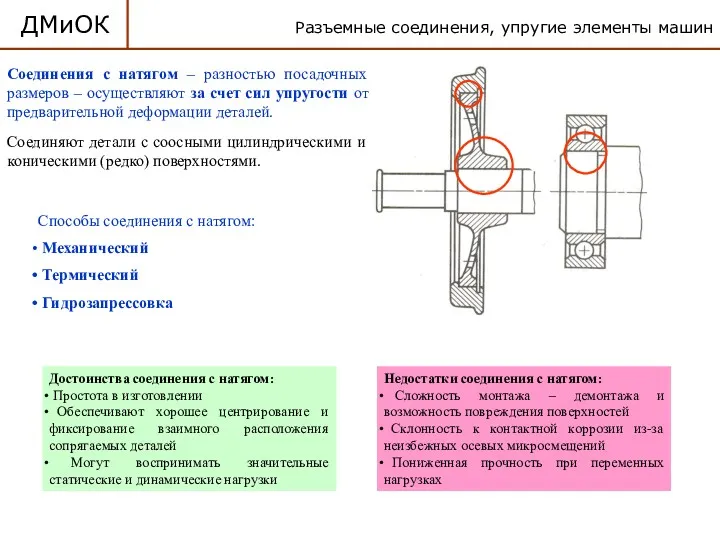 Детали машин и основы конструирования. Разъемные соединения, упругие элементы машин. Соединения с натягом. (Лекция 15)
Детали машин и основы конструирования. Разъемные соединения, упругие элементы машин. Соединения с натягом. (Лекция 15) Радиографические методы
Радиографические методы Станция управления приводов ШГН СКАД-0-УЗЭП. Устройство, диагностика и ремонт
Станция управления приводов ШГН СКАД-0-УЗЭП. Устройство, диагностика и ремонт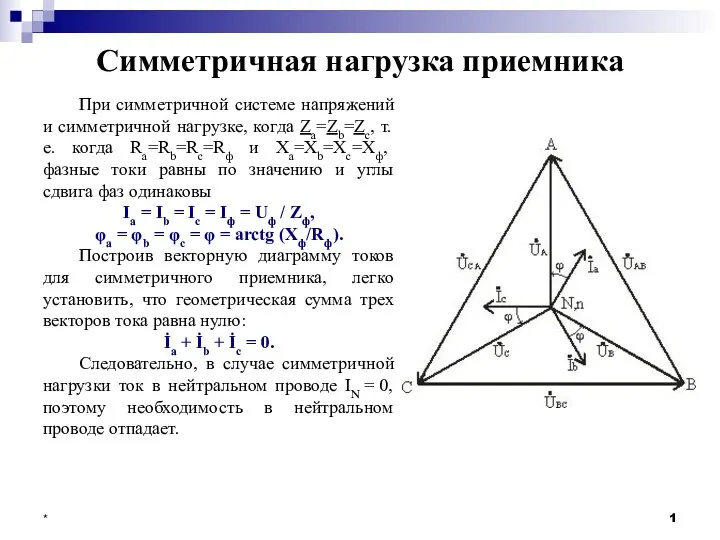 Симметричная нагрузка приемника
Симметричная нагрузка приемника Система наддува в двигателях внутреннего сгорания. Тема 2.16
Система наддува в двигателях внутреннего сгорания. Тема 2.16 Солнечные батареи
Солнечные батареи Управление и характеристики машин
Управление и характеристики машин Тепловые двигатели. Проблемы использования тепловых двигателей
Тепловые двигатели. Проблемы использования тепловых двигателей кейс-технологии на уроках математике
кейс-технологии на уроках математике Топливные форсунки автомобиля
Топливные форсунки автомобиля Термодинамические основы работы тепловых машин (теплотехника)
Термодинамические основы работы тепловых машин (теплотехника) Навигация и лоция
Навигация и лоция Электромагнетизм
Электромагнетизм Теория относительности Эйнштейна
Теория относительности Эйнштейна Kosmicheskoe-izluchenie
Kosmicheskoe-izluchenie Типы волоконной оптики, способы изготовления и применения
Типы волоконной оптики, способы изготовления и применения Жаңбырлатқыш машиналар қондырғылар
Жаңбырлатқыш машиналар қондырғылар Электромагнитная картина мира
Электромагнитная картина мира Решение задач по теме Давление
Решение задач по теме Давление Термоэлектрические и термомагнитные явления. Диффузионный ток
Термоэлектрические и термомагнитные явления. Диффузионный ток Шкала Фаренгейта
Шкала Фаренгейта Электрическая цепь и ее элементы
Электрическая цепь и ее элементы Колебательное движение
Колебательное движение Пара сил и момент силы относительно точки
Пара сил и момент силы относительно точки Энергия. Закон сохранения энергии
Энергия. Закон сохранения энергии Здравствуй,физика!
Здравствуй,физика! Постоянные магниты 9 класс.
Постоянные магниты 9 класс. Урок по теме Излучение 8 класс
Урок по теме Излучение 8 класс