Содержание
- 2. Термодинамика — наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты
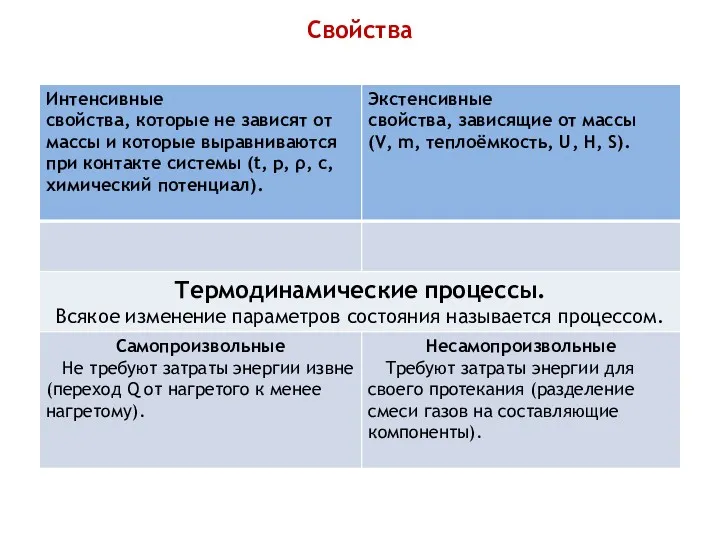
- 4. Свойства
- 5. I закон термодинамики
- 6. Выражения первого закона термодинамики для изохорного и изобарного процессов. Стандартной теплотой образования называется тепловой эффект реакции
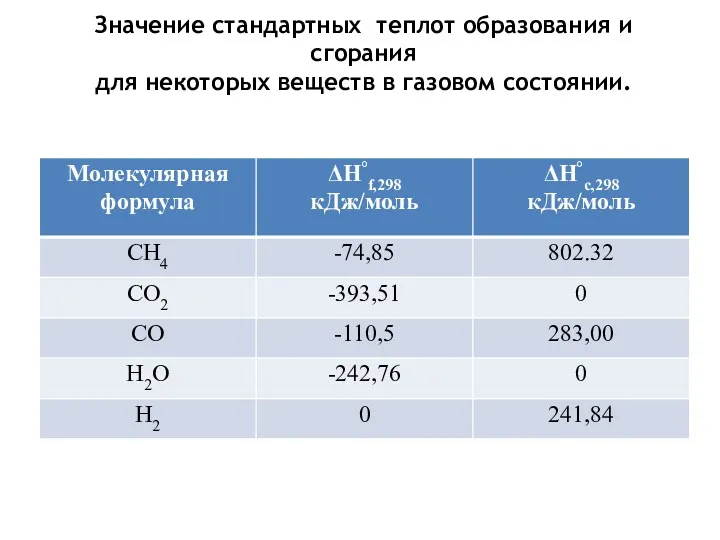
- 7. Значение стандартных теплот образования и сгорания для некоторых веществ в газовом состоянии.
- 8. Закон Гесса
- 9. II закон термодинамики
- 10. Энтропия Энтропия S - термодиамическая функция показывающая изменение рассеивания энергии при переходе системы из одного состояния
- 11. Свободная энергия Гиббса
- 12. Реакции, для которых ∆G ∆G>0 – эндергонические. В организме человека протекают и эндергонические реакции, но обязательным
- 13. Спасибо за Внимание!
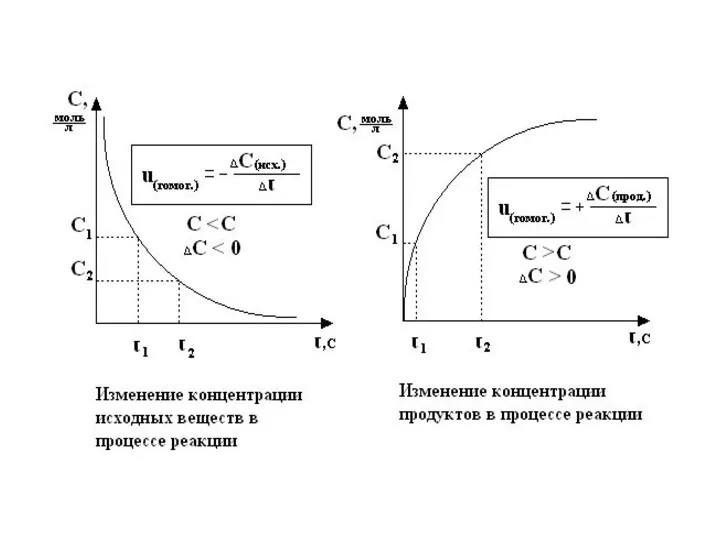
- 14. Основы химической кинетики Химическая кинетика изучает скорость реакции. Скорость гомогенной реакции определяется количеством вещества, вступившего в
- 16. Скорость химической реакции зависит от: Концентрации реагирующих веществ Температуры Природы (энергии активации) реагирующих веществ Давления (реакции
- 17. ЗДМ - ЗАКОН ДЕЙСТВИЯ МАСС (1867):
- 18. Молекулярность — это минимальное число различных частиц, участвующих в элементарном акте химического взаимодействия. СН4 → С
- 19. ПРАВИЛО ВАНТ - ГОФФА (1884):
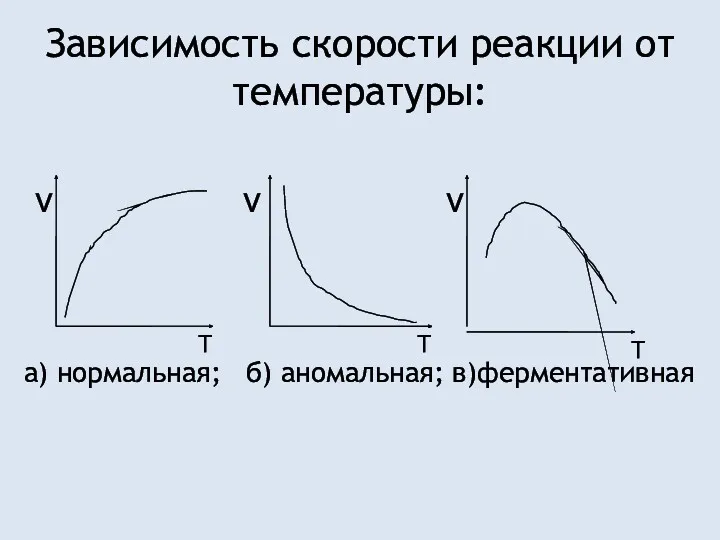
- 20. Зависимость скорости реакции от температуры: а) нормальная; б) аномальная; в)ферментативная Т ν ν Т ν Т
- 21. УРАВНЕНИЕ АРРЕНИУСА (1889):
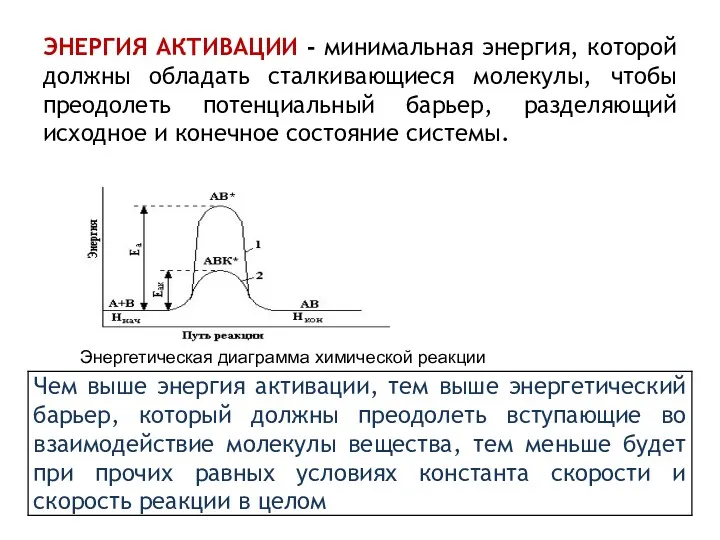
- 22. ЭНЕРГИЯ АКТИВАЦИИ - минимальная энергия, которой должны обладать сталкивающиеся молекулы, чтобы преодолеть потенциальный барьер, разделяющий исходное
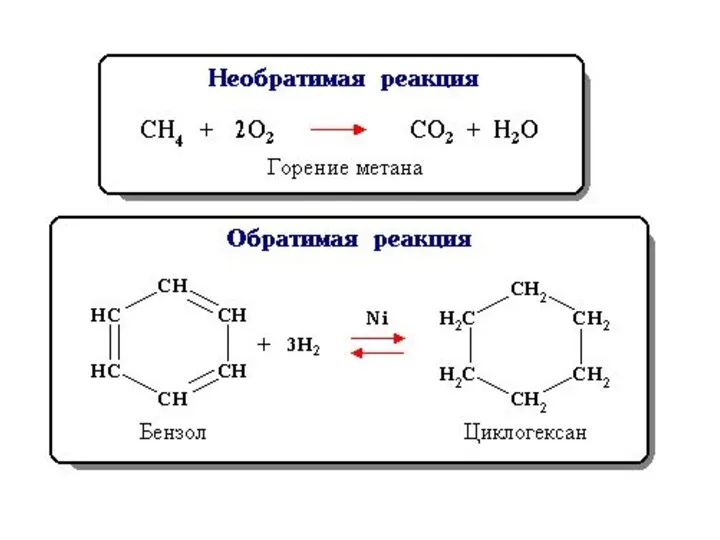
- 24. Химическое равновесие Состояние равновесия характерно для обратимых химических реакций. Обратимая реакция - химическая реакция, которая при
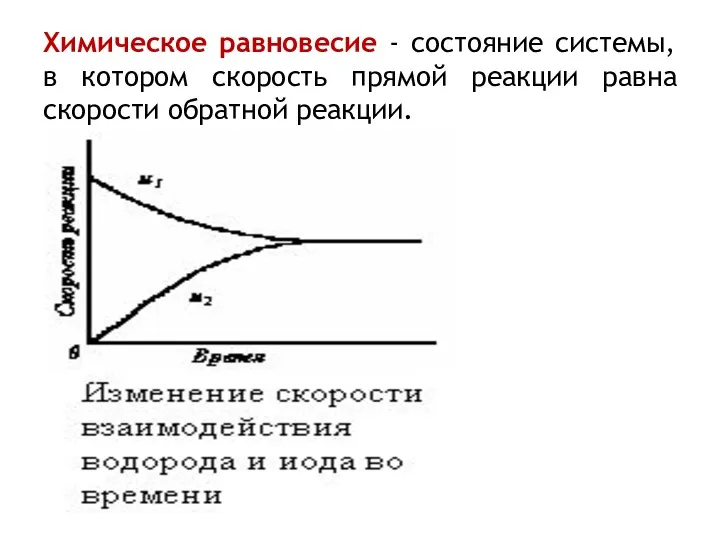
- 26. Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
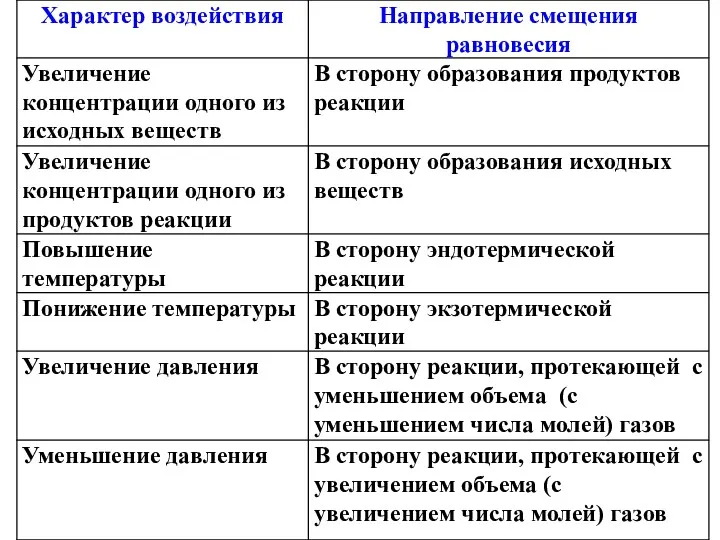
- 28. Смещение химического равновесия Принцип Ле-Шателье Если на систему, находящуюся в состоянии равновесия, оказать какое – либо
- 31. Скачать презентацию




















 Современные тепловые двигатели
Современные тепловые двигатели Constant Jerk Trajectory Generator
Constant Jerk Trajectory Generator Мастер класс по использованию сингапурской системы для учителей физики Татарстан
Мастер класс по использованию сингапурской системы для учителей физики Татарстан Механізм газорозподілу. (Лекція 3.2)
Механізм газорозподілу. (Лекція 3.2) Геометрическа оптика
Геометрическа оптика Легированные стали
Легированные стали Силы в природе (7 класс)
Силы в природе (7 класс) Дисперсия. Важнейшие выводы теории Максвелла
Дисперсия. Важнейшие выводы теории Максвелла Урок по физике Сила трения
Урок по физике Сила трения Практические навыки матроса. Основы МППСС. Лекция 3
Практические навыки матроса. Основы МППСС. Лекция 3 Výpočet tepla
Výpočet tepla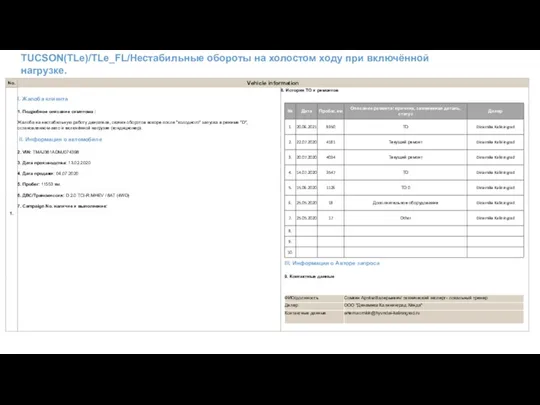 Нестабильные обороты на холостом ходу при включённой нагрузке
Нестабильные обороты на холостом ходу при включённой нагрузке Воздухоплавание. Первый воздушный полёт
Воздухоплавание. Первый воздушный полёт Потенциальная и кинетическая энергия
Потенциальная и кинетическая энергия Агрегатные состояния веществ
Агрегатные состояния веществ Коммерческий транспорт Groupe PSA - Opel Vivaro
Коммерческий транспорт Groupe PSA - Opel Vivaro Хромов_В_И_ПМ-101_радиация
Хромов_В_И_ПМ-101_радиация Электр станцияларының электр жабдықтары: аккумуляторлық, конденсаторлық қондырғылар
Электр станцияларының электр жабдықтары: аккумуляторлық, конденсаторлық қондырғылар Тепловое действие тока. Закон Джоуля–Ленца
Тепловое действие тока. Закон Джоуля–Ленца Презентация к уроку Что изучает физика. Физические явления (7 класс)
Презентация к уроку Что изучает физика. Физические явления (7 класс) презентация импульс тела закон сохранения импульса
презентация импульс тела закон сохранения импульса Урок физики в 7 классе на тему: Агрегатные состояния вещества
Урок физики в 7 классе на тему: Агрегатные состояния вещества Состав ядра. Ядерные силы
Состав ядра. Ядерные силы Нагревание воздуха и его температура
Нагревание воздуха и его температура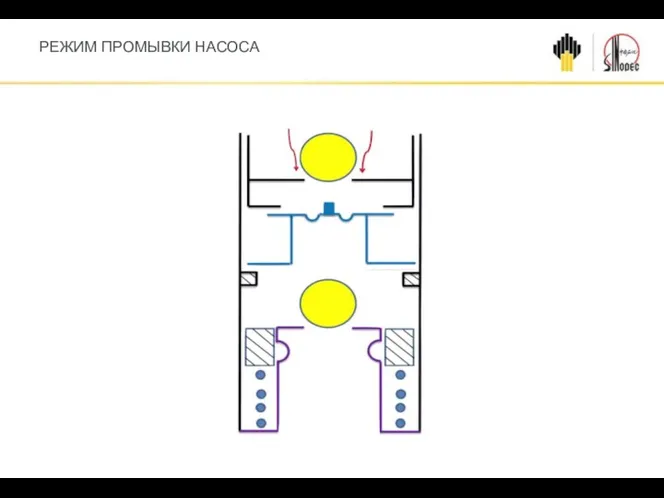 Режим промывки насоса
Режим промывки насоса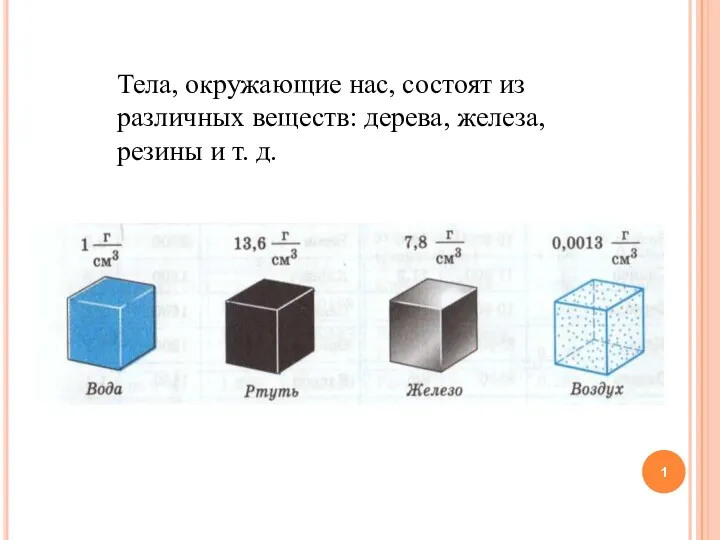 Понятие плотности тела (вещества)
Понятие плотности тела (вещества) Презентация Вес тела
Презентация Вес тела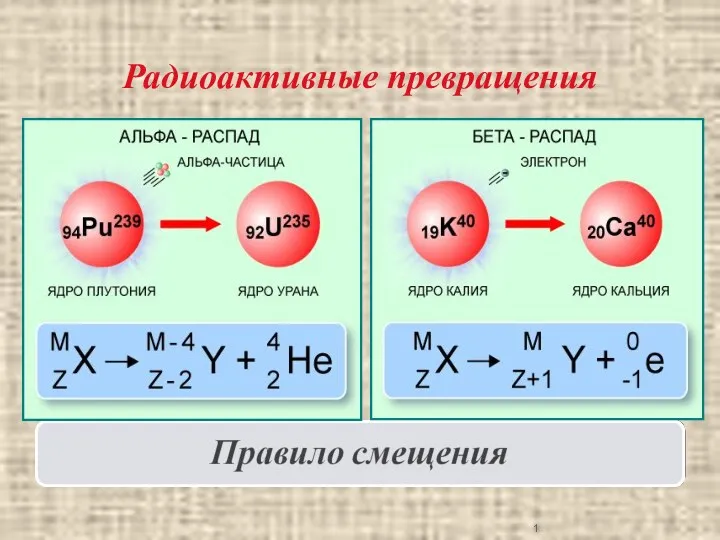 ИЗОТОПЫ
ИЗОТОПЫ