Содержание
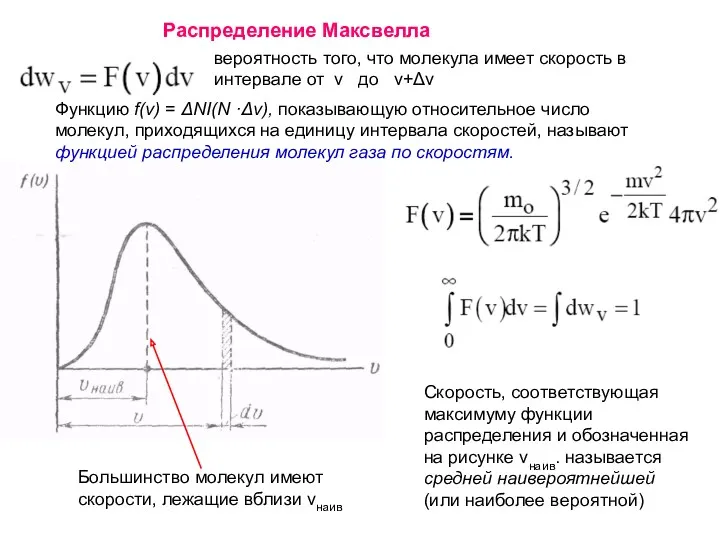
- 2. Функцию f(v) = ΔNI(N ·Δv), показывающую относительное число молекул, приходящихся на единицу интервала скоростей, называют функцией
- 3. Уравнение состояния идеального газа Пусть в объеме V при давлении р и температуре Т находятся N
- 4. при данном р и Т V ~ М ~ N ~ N, тогда k – коффициент
- 5. Сравним уравнение с основным уравнением кинетической теории газов выражение для средней квадратичной скорости молекул в зависимости
- 6. Переход идеального газа из неравновесных состояний в равновесное происходит благодаря так называемым явлениям переноса — 1)диффузии,
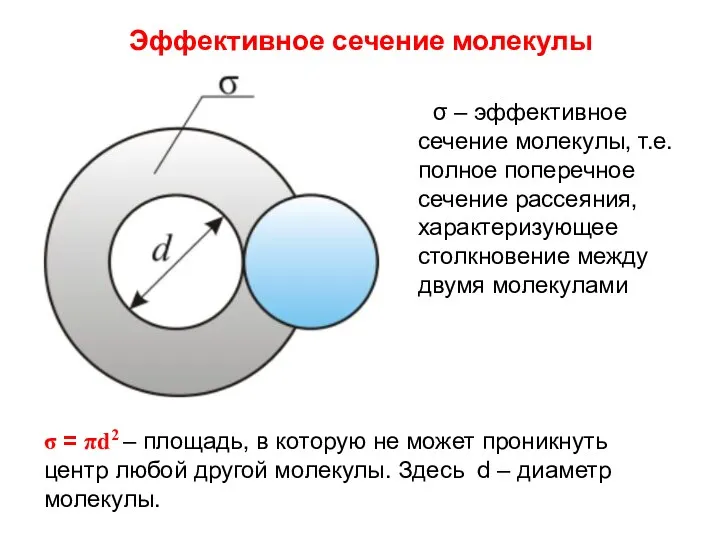
- 7. Эффективное сечение молекулы σ – эффективное сечение молекулы, т.е. полное поперечное сечение рассеяния, характеризующее столкновение между
- 8. Найдем среднее число столкновений, испытываемых одной молекулой в единицу времени. Представим молекулу в виде шара диаметром
- 9. Число столкновений в единицу времени n – число частиц в единице объема длина свободного пробега равна
- 10. Явления переноса в газах Молекулы газа при хаотическом движении, взаимодействуют друг с другом, перемещаются на значительные
- 11. l В каждом объеме n·S·l молекул. В направлении ┴ площадке S перемещается 1/6 (n·S·l) молекул слева
- 12. Реальный газ
- 13. Измерения показывают, что соотношения, полученные в предыдущей главе для идеального газа, в частности — уравнение равновесного
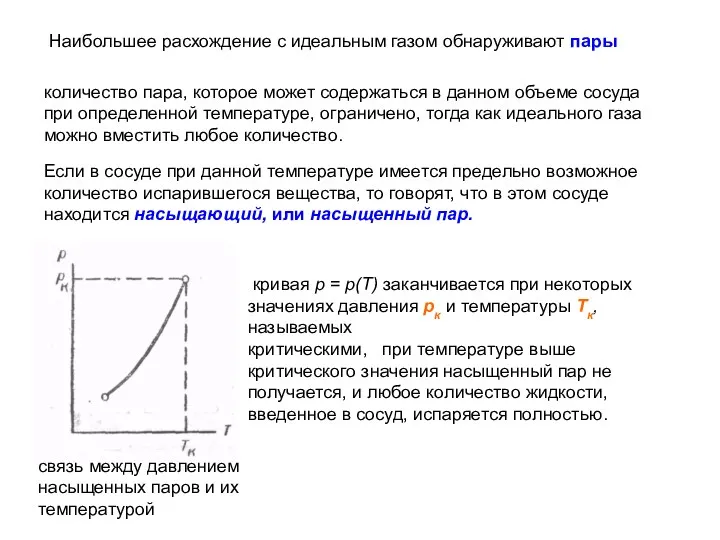
- 14. Наибольшее расхождение с идеальным газом обнаруживают пары количество пара, которое может содержаться в данном объеме сосуда
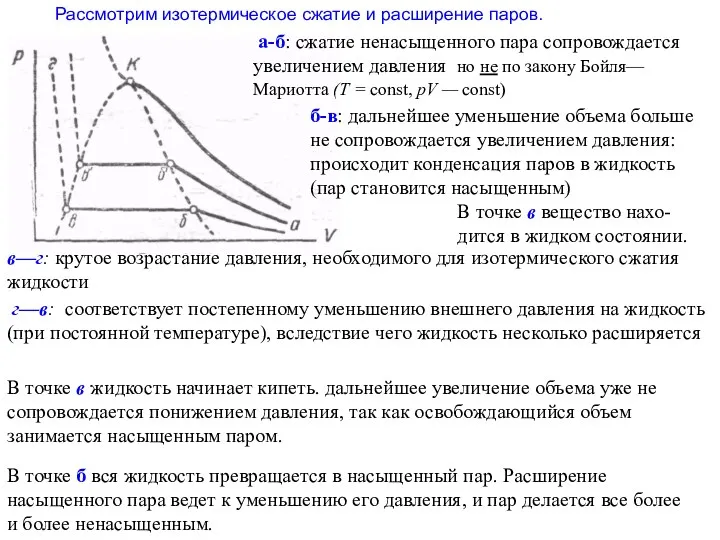
- 15. Рассмотрим изотермическое сжатие и расширение паров. а-б: сжатие ненасыщенного пара сопровождается увеличением давления но не по
- 16. Если провести изотермическое сжатие того же количества пара при более высокой температуре, то состояние насыщения наступает
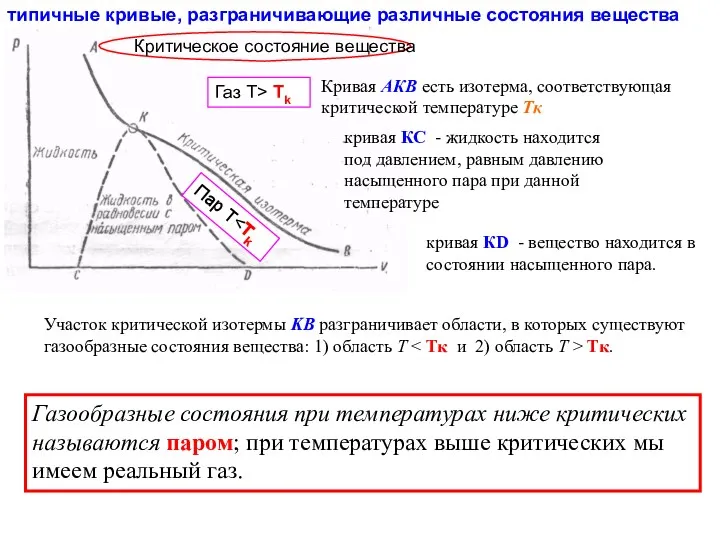
- 17. типичные кривые, разграничивающие различные состояния вещества Участок критической изотермы KB разграничивает области, в которых существуют газообразные
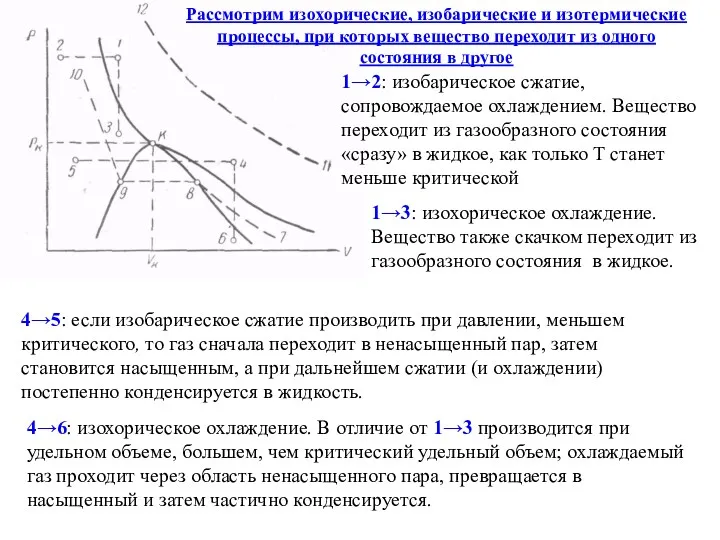
- 18. Рассмотрим изохорические, изобарические и изотермические процессы, при которых вещество переходит из одного состояния в другое 1→2:
- 19. 7→8 →9 →10: изотермический процесс. 7 имеется ненасыщенный пар 8 насыщенное состояние, в которое путем сжатия
- 20. Уравнение Ван-дер-Ваальса. При выводе уравнения состояния идеального газа, которое для 1 моля имеет вид pV=RT были
- 21. «поправки», внесенные в уравнение состояния идеального газа: а/V2 – величина, учитывающая взаимодействие молекул и обратно пропорциональным
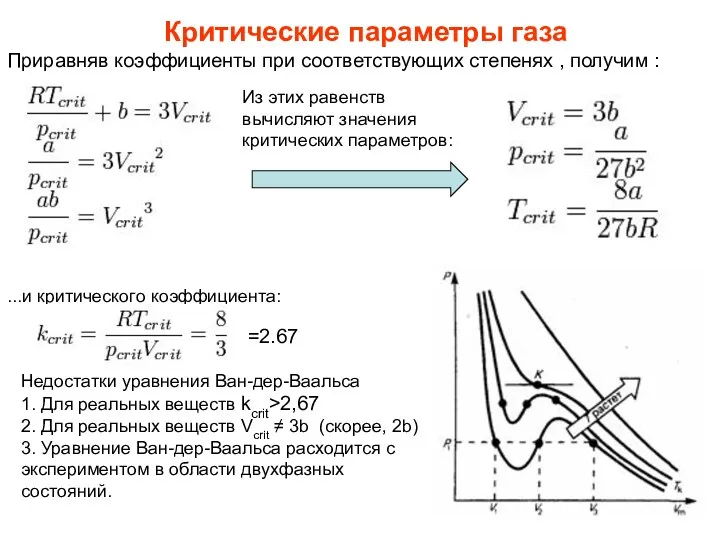
- 22. Критические параметры газа Критическими параметрами газа называются значения его макропараметров (давления, объёма и температуры) в критической
- 23. Приравняв коэффициенты при соответствующих степенях , получим : Критические параметры газа Из этих равенств вычисляют значения
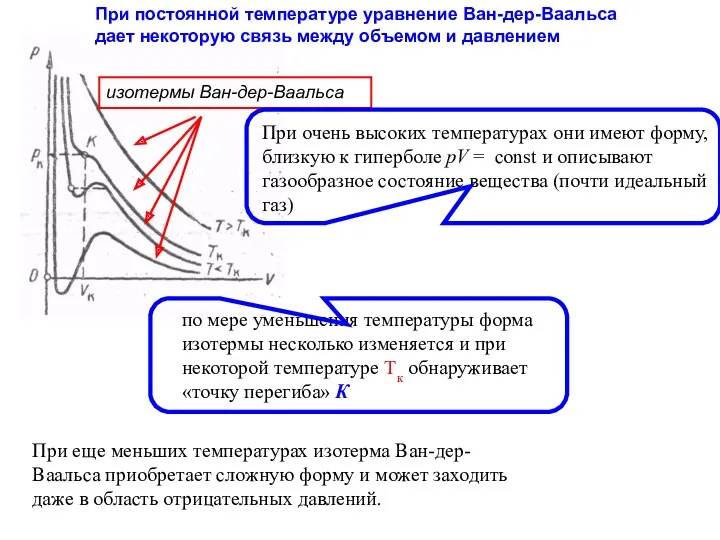
- 24. При постоянной температуре уравнение Ван-дер-Ваальса дает некоторую связь между объемом и давлением изотермы Ван-дер-Ваальса При очень
- 25. изотермы, соответствующие низким температурам Измерения показывают, что изотермы реального вещества приближаются к изотермам Ван-дер-Ваальса на участках
- 27. Скачать презентацию
















 Стиральные машины SPA STEAM
Стиральные машины SPA STEAM Основные неисправности ходовой части. Техническое обслуживание рамы и подвески
Основные неисправности ходовой части. Техническое обслуживание рамы и подвески презент....ЭЛЕКТРОДИНАМИКА,,,
презент....ЭЛЕКТРОДИНАМИКА,,, А.С. Попов – изобретатель радио
А.С. Попов – изобретатель радио Динамика материальной точки и абсолютно твердого тела
Динамика материальной точки и абсолютно твердого тела Физика, как наука о природе повторение. Масса. Плотность. Урок 1
Физика, как наука о природе повторение. Масса. Плотность. Урок 1 Простые механизмы. Рычаг
Простые механизмы. Рычаг Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар
Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар Применение ЭОР в образовательном процессе
Применение ЭОР в образовательном процессе Колебательные цепи при гармонических воздействиях. Лекция 5
Колебательные цепи при гармонических воздействиях. Лекция 5 Текущий ремонт разъединителя РНДЗ-1-35/1000
Текущий ремонт разъединителя РНДЗ-1-35/1000 Электростатика. Электродинамика
Электростатика. Электродинамика Применение аккумуляторов
Применение аккумуляторов Техническое обслуживание и ремонт автотранспорта. Устройство автомобилей
Техническое обслуживание и ремонт автотранспорта. Устройство автомобилей Дифракция света. Лекция 3
Дифракция света. Лекция 3 Динамика материальной точки. Законы Ньютона
Динамика материальной точки. Законы Ньютона Проводниковые материалы
Проводниковые материалы Влияние музыки на рост растений
Влияние музыки на рост растений Техногенные опасности. Статическое электричество. Лазерное излучение
Техногенные опасности. Статическое электричество. Лазерное излучение Методическая разработка по физике (9 класс) по теме: Решение задач по теме Закон всемирного тяготения. ИСЗ
Методическая разработка по физике (9 класс) по теме: Решение задач по теме Закон всемирного тяготения. ИСЗ Дефектування і комплектування
Дефектування і комплектування Гидродинамические передачи. (Лекция 15-16)
Гидродинамические передачи. (Лекция 15-16) Oscillatory motion. Simple harmonic motion. The simple pendulum. Damped harmonic oscillations. (Lecture 1)
Oscillatory motion. Simple harmonic motion. The simple pendulum. Damped harmonic oscillations. (Lecture 1) Термоядерный синтез
Термоядерный синтез Паровая турбина. КПД теплового двигателя
Паровая турбина. КПД теплового двигателя Дозиметрия ионизирующих излучений. Лекция 2
Дозиметрия ионизирующих излучений. Лекция 2 История ядерного реактора
История ядерного реактора Кристаллические и аморфные тела
Кристаллические и аморфные тела