Содержание
- 2. Основоположники химической кинетики Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry) van 't Hoff; 1852, — 1911,
- 3. Э́ЙРИНГ (Eyring) Генри (1901-1981), американский физикохимик. Область изучения - квантовая химиия и химическая кинетика. Один из
- 4. Введение в кинетику Стехиометрия. Химическую реакцию принято записывать в форме стехиометрического уравнения. Последнее представляет собой простейшее
- 5. Молекулярность Число молекул реагентов, участвующих в простой реакции, состоящей из одного элементарного акта, называется молекулярностью. Большинство
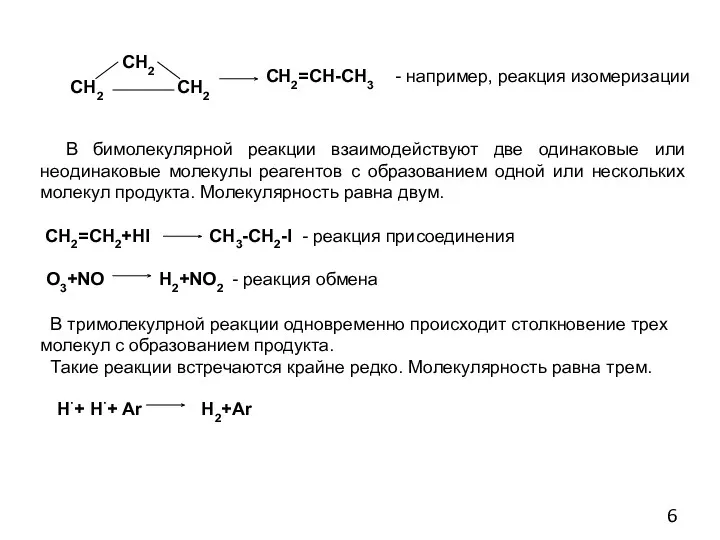
- 6. СН2 СН2 СН2 СН2=СН-СН3 - например, реакция изомеризации В бимолекулярной реакции взаимодействуют две одинаковые или неодинаковые
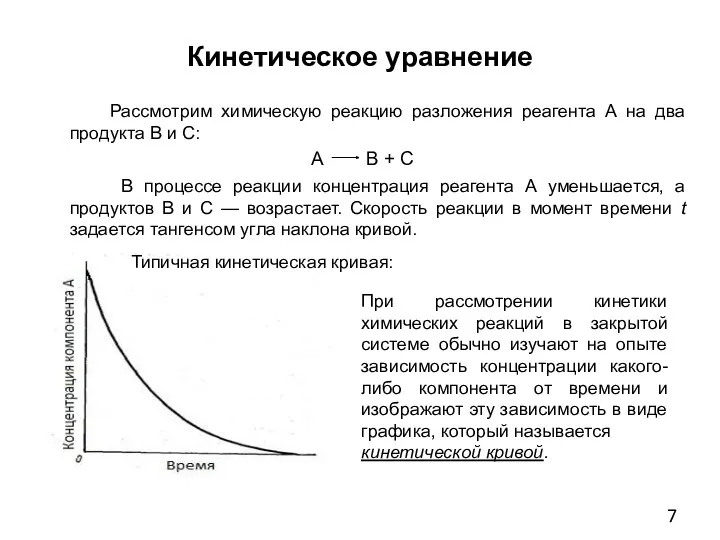
- 7. Кинетическое уравнение Рассмотрим химическую реакцию разложения реагента A на два продукта В и С: А В
- 8. ; Скорость реакции равна скорости уменьшения концентрации реагента А во времени. Кроме того, скорость реакции определяется
- 9. Кинетические методы обработки экспериментальных данных Существуют два метода обработки экспериментальных данных, полученных в ходе измерения –
- 10. Порядок реакции Если зависимость скорости реакции от концентрации реагирующих веществ записывается в виде , то величины
- 11. Если скорость пропорциональна квадрату концентрации реагента А, реакция называется реакцией второго порядка, так как
- 12. Константа скорости Константа скорости химического процесса – это множитель в кинетическом уравнении, показывающий, с какой скоростью
- 13. Дифференциальные кинетические уравнения Кинетические уравнения, записанные следующим образом: , являются дифференциальными Дифференциальные уравнения показывают, как меняется
- 14. Некоторые простые кинетические уравнения приведены в таблице: Порядок Время полупревращения, τ1/2 - это время, необходимое для
- 15. Кинетические уравнения первого порядка Рассмотрим реакцию: А Продукты. Пусть а — начальная концентрация реагента А; x
- 16. Интегрированием последнего уравнения получаем: интегральное кинетическое уравнение первого порядка Определение константы скорости реакции первого порядка Выразим
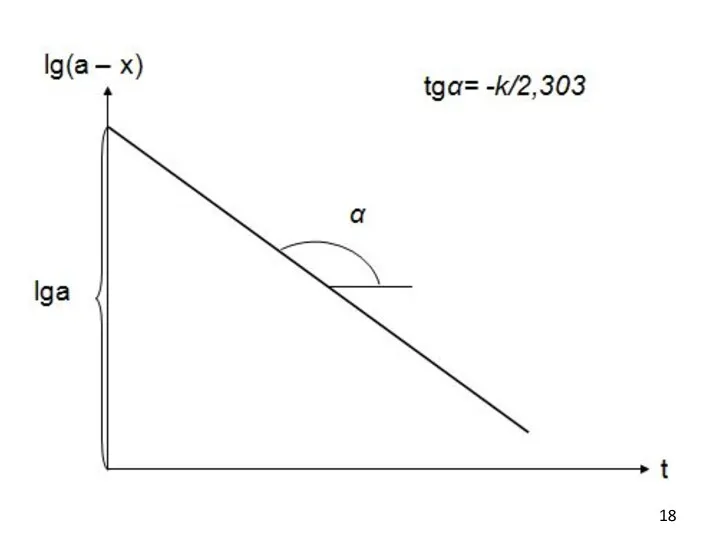
- 17. Метод подстановки Зная значения а – х, то есть текущие концентрации реагента А в разные моменты
- 19. Кинетические уравнения второго порядка Рассмотрим реакцию: А + В Продукты. Пусть начальные концентрации реагентов А и
- 20. Подстановка const в уравнение (5) дает интегральное кинетическое уравнение второго порядка 6 Определение константы скорости реакции
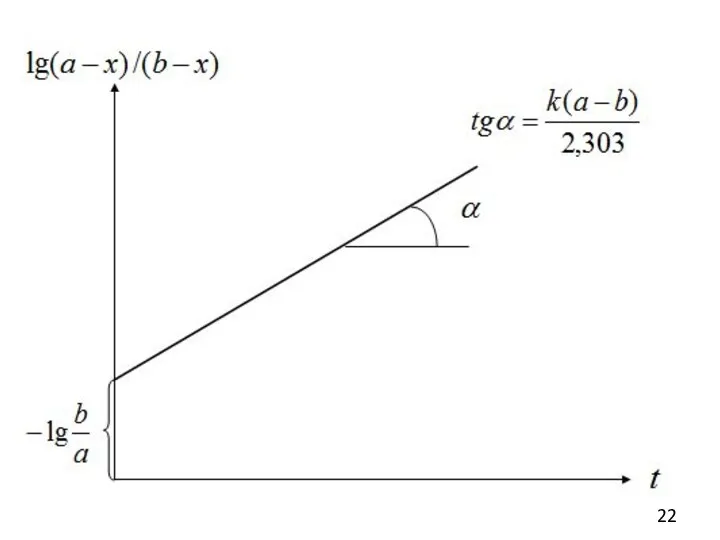
- 21. Метод подстановки Константу скорости рассчитывают путем подстановки экспериментальных значений а - х и b - х,
- 23. Кинетические уравнения третьего порядка Рассмотрим в общем виде реакцию третьего порядка А + В + С
- 24. Подстановка const в уравнение (8) дает интегральное кинетическое уравнение третьего порядка Константу скорости можно определить подстановкой
- 25. Кинетика сложных реакций Большинство реакций являются сложными и состоят из нескольких элементарных стадий при этом все
- 26. Пусть а — начальная концентрация реагента А, х — уменьшение концентрации А за время t и
- 27. Интегрирование кинетического уравнения (10) при начальных условиях СА=СА,0 и t=0 приводит к следующему выражению Полученное соотношение
- 28. Определив из экспериментальных данных равновесные значения можно вычислить константу равновесия и По значениям величины и можно
- 29. Последовательные реакции Рассмотрим две последовательные реакции первого порядка: k1 A Р k2 Р В Кинетика процесса
- 30. Интегрированием уравнения (11) при начальных условиях СА=СА,0 и t=0 получают зависимость изменения концентрации исходного реагента А
- 31. При интегрировании полученного дифференциального уравнения при начальных условиях: СР=0, СА=СА,0 и t=0, получают зависимость накопления промежуточного
- 32. Параллельные реакции Рассмотрим две параллельные реакции первого порядка, в которых вещество А одновременно превращается по двум
- 33. Дифференциальные уравнения для продуктов В1 и В2 имеют следующий вид: Интегрирование этих уравнений соответственно при начальных
- 35. Скачать презентацию


























 Солнечные коллекторы
Солнечные коллекторы Загальні закономірності горіння рідин
Загальні закономірності горіння рідин Динамика вращательного движения твердого тела. Лекция 5
Динамика вращательного движения твердого тела. Лекция 5 Денелердің жылулық сәуле шығаруы. Тепловизорлар
Денелердің жылулық сәуле шығаруы. Тепловизорлар Физика и техника (7 класс)
Физика и техника (7 класс) Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС)
Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС) Теплова дія струму. Закон Джоуля – Ленца. Урок 58
Теплова дія струму. Закон Джоуля – Ленца. Урок 58 Физическая игра Наряди ёлку
Физическая игра Наряди ёлку Испарение. Поглощение энергии при испарении и выделение её при конденсации пара
Испарение. Поглощение энергии при испарении и выделение её при конденсации пара Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния
Основные положения молекулярно-кинетической теории. Масса и размеры молекул. Термодинамическая система и параметры ее состояния Коливальний рух у природі і техніці
Коливальний рух у природі і техніці Петрофизика как прикладная наука
Петрофизика как прикладная наука Прикладная голография. Техника голографического эксперимента. (Лекция 7)
Прикладная голография. Техника голографического эксперимента. (Лекция 7) Трансмиссия. Коробки передач
Трансмиссия. Коробки передач Переменный ток
Переменный ток Закон Ома для участка цепи
Закон Ома для участка цепи Развитие взглядов на природу света. Волновые и квантовые свойства света
Развитие взглядов на природу света. Волновые и квантовые свойства света Газовая турбина. Реактивные двигатели
Газовая турбина. Реактивные двигатели Механік - моя спеціальність
Механік - моя спеціальність Презентация по теме:Тепловые двигатели
Презентация по теме:Тепловые двигатели Основы классической термодинамики. Первое начало термодинамики. (Лекция 10)
Основы классической термодинамики. Первое начало термодинамики. (Лекция 10) Услуги по переоборудованию автомобиля ВАЗ-2115
Услуги по переоборудованию автомобиля ВАЗ-2115 Рентгеновское излучение. Открытие рентгеновских лучей
Рентгеновское излучение. Открытие рентгеновских лучей Игра - кто хочет стать миллионером. Законы Ньютона.
Игра - кто хочет стать миллионером. Законы Ньютона. Люди нашего края Голобоков
Люди нашего края Голобоков Дифференциальная геометрия
Дифференциальная геометрия Система стабилизации курсовой устойчивости esp. Урок № 197
Система стабилизации курсовой устойчивости esp. Урок № 197 Решение задач
Решение задач