Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8) презентация
Содержание
- 2. КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ. ЭЛЕКТРОКИНЕТИЧЕСКИЕ СВОЙСТВА И УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ Лекция №8 Лектор: к.х.н., доцент Иванова Надежда
- 3. Коллоидная химия ‒ … … наука о поверхностных явлениях и дисперсных системах. … наука о коллоидном
- 4. Основные понятия: Дисперсность ‒ мерой её служит удельная поверхность (Sуд). Sуд ‒ площадь раздела фаз, приходящаяся
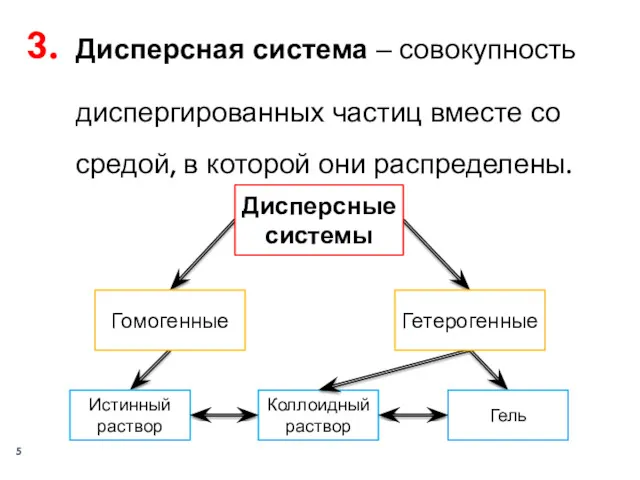
- 5. Дисперсная система ‒ совокупность диспергированных частиц вместе со средой, в которой они распределены. Дисперсные системы Гомогенные
- 6. Дисперсная фаза (ДФ) ‒ совокупность диспергированных частиц, размеры которых больше молекулярных. Дисперсионная среда (ДС) ‒ однородная
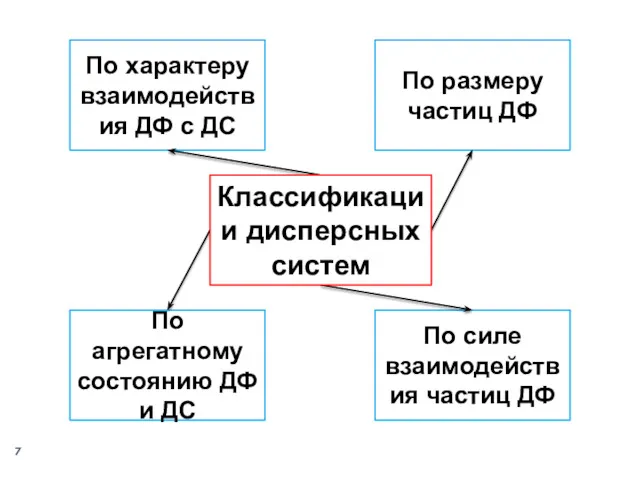
- 7. По размеру частиц ДФ По характеру взаимодействия ДФ с ДС По агрегатному состоянию ДФ и ДС
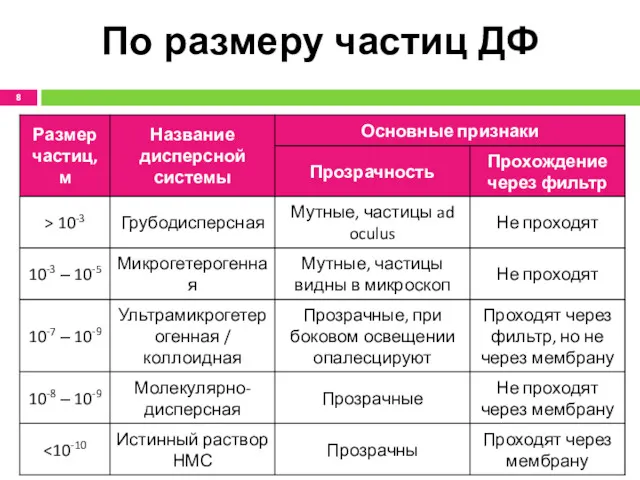
- 8. По размеру частиц ДФ
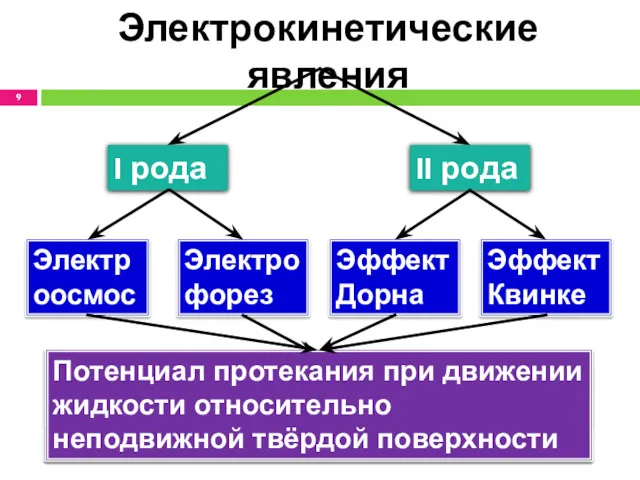
- 9. Электрокинетические явления I рода II рода Электрофорез Электроосмос Эффект Дорна Эффект Квинке Движение частиц ДФ в
- 10. Мицеллярная теория лиофобных золей Мицелла ‒ гетерогенная микросистема, состоящая из микрокристалла ДФ, окружённого сольватированными ионами стабилизатора.
- 11. Мицеллярная теория лиофобных золей – агрегат с адсорбированными на нём потенциалопределяющими ионами (ПОИ). – ионы, сообщающие
- 12. Мицеллярная теория лиофобных золей – ядро с адсорбционным слоем противоионов, являющаяся гигантским многозарядным ионом. Источником ПОИ
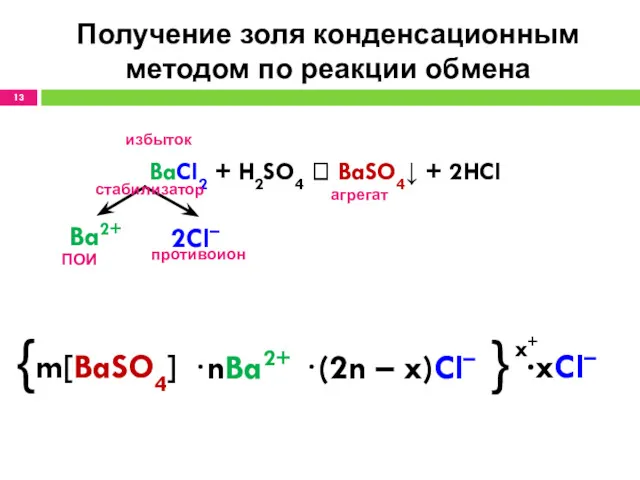
- 13. Получение золя конденсационным методом по реакции обмена BaCl2 + H2SO4 ? BaSO4↓ + 2HCl избыток агрегат
- 14. Мицелла {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– агрегат адсорбционный слой ядро гранула диффузионный слой
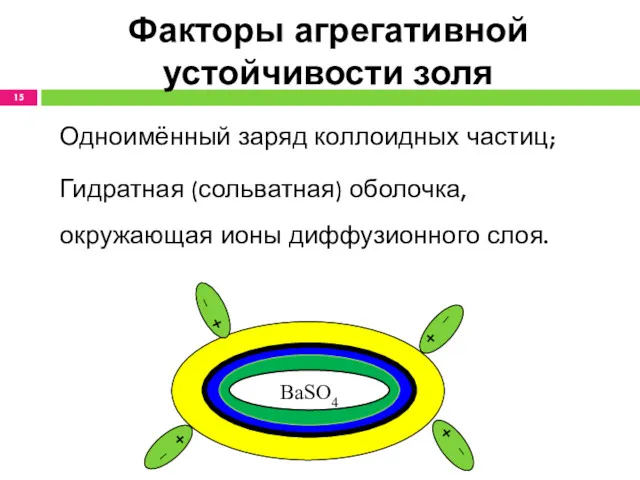
- 15. Факторы агрегативной устойчивости золя Одноимённый заряд коллоидных частиц; Гидратная (сольватная) оболочка, окружающая ионы диффузионного слоя. BaSO4
- 16. Возникновение ДЭС и потенциалов в мицелле {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– На границе
- 17. Возникновение ДЭС и потенциалов в мицелле По величине 0 ≤ ζ ζкрит. = ±30 мВ. При
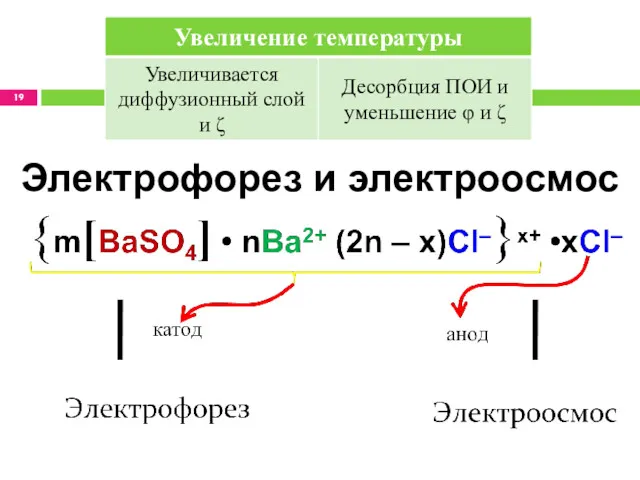
- 18. Факторы, влияющие на ζ Концентрация стабилизатора. Состояние ИЭТ золя, ζ = 0. Золь разрушается. Концентрация посторонних
- 19. Электрофорез и электроосмос
- 20. Расчёт ζ Поскольку ζ обнаруживает себя при попадании мицеллы в электрическое поле, для его расчёта используются
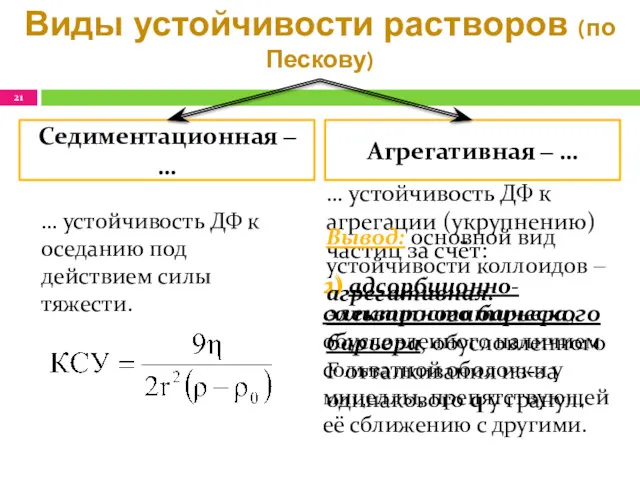
- 21. Виды устойчивости растворов (по Пескову) … устойчивость ДФ к агрегации (укрупнению) частиц за счёт: 1) электростатического
- 22. Коагуляция ‒ … … процесс слипания частиц, образование крупных агрегатов с потерей седиментационной и фазовой устойчивости
- 23. Факторы, вызывающие коагуляцию Увеличение концентрации золя приводит к уменьшению расстояния между частицами, на котором начинают действовать
- 24. Факторы, вызывающие коагуляцию Добавление электролитов наиболее сильное по 2-м причинам: из-за адсорбции ионов электролита на грануле
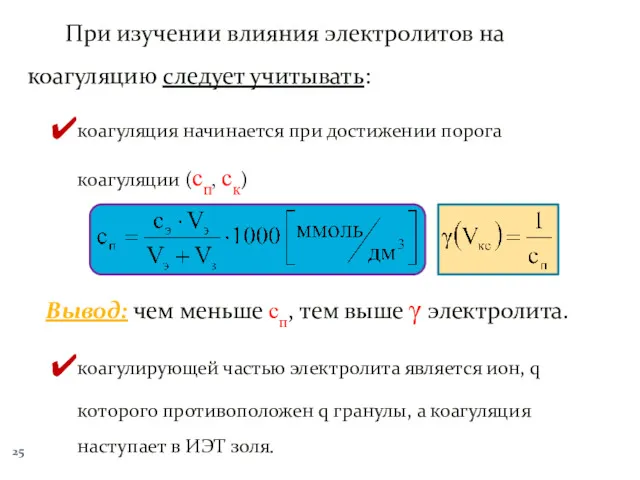
- 25. При изучении влияния электролитов на коагуляцию следует учитывать: коагуляция начинается при достижении порога коагуляции (сп, ск)
- 26. чем выше заряд коагулирующего иона, тем меньше сп и выше γ электролита. Правило Шульце ‒ Гарди
- 27. Правило Дерягина ‒ Ландау … … устанавливает связь между сп и зарядом коагулирующего иона. Теор.: Эксп.:
- 28. Способность ионов одного заряда к гидратации (лиотропные ряды) Факторы, вызывающие коагуляцию Li+ Na+ K+ Rb+ Cs+
- 29. Факторы, вызывающие коагуляцию «Ионы-партнёры», идущие в паре с коагулирующими ионами, уменьшают их γ в случае адсорбции
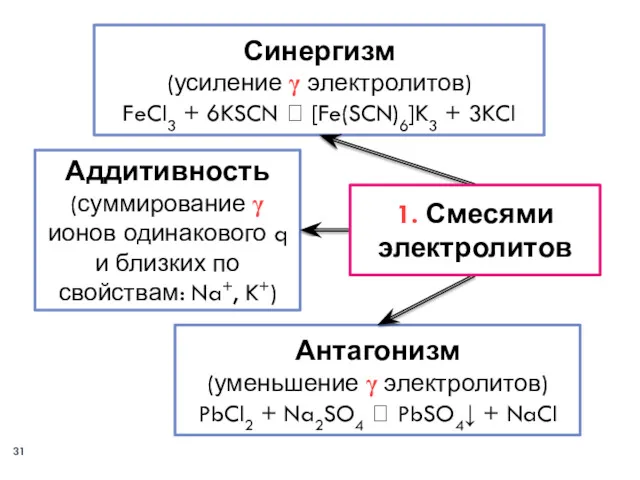
- 30. Смесями электролитов; Многозарядными ионами‒коагуляторами (чередование зон коагуляции); При смешивании коллоидов с гранулами разного по знаку заряда
- 31. Аддитивность (суммирование γ ионов одинакового q и близких по свойствам: Na+, K+) Антагонизм (уменьшение γ электролитов)
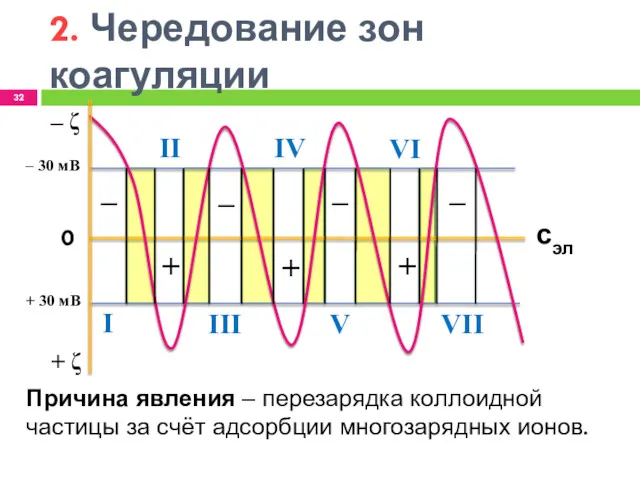
- 32. 2. Чередование зон коагуляции ‒ + + + ‒ ‒ ‒ ‒ ζ + ζ 0
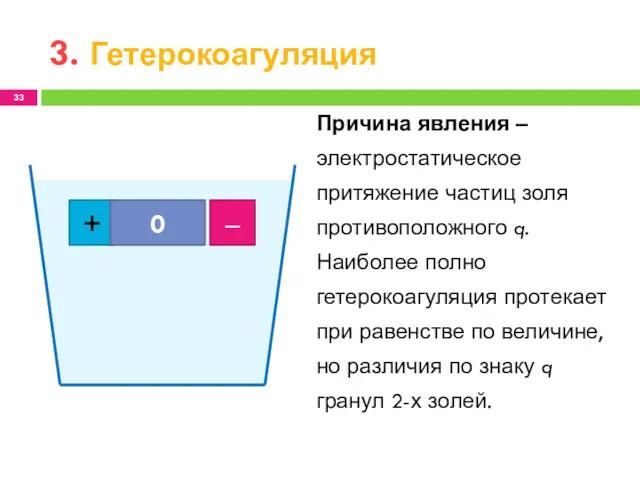
- 33. 3. Гетерокоагуляция + ‒ 0 Причина явления ‒ электростатическое притяжение частиц золя противоположного q. Наиболее полно
- 34. … вызвана добавлением очень малых количеств ВМС и понижает устойчивость коллоидов. … связана с особенностями ВМС:
- 35. Вывод: адсорбционный слой является механическим препятствием для иона ‒ коагулянта. …повышение устойчивости коллоидов добавлением ВМС в
- 36. Защитное число … … min масса ВМС (мг), достаточная для предотвращения 10 см3 гидрозоля от коагулирующего
- 37. Процесс перехода свежевыпавшего при коагуляции осадка во взвешенное состояние (золь) под влиянием пептизаторов ‒ б) адсорбция
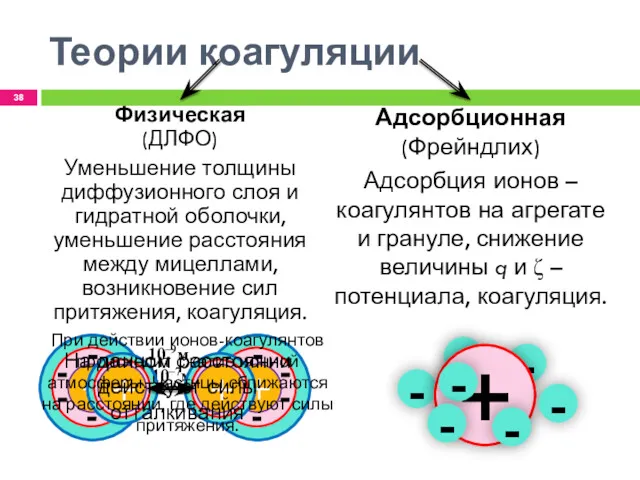
- 38. - - - Теории коагуляции Адсорбционная (Фрейндлих) Адсорбция ионов – коагулянтов на агрегате и грануле, снижение
- 40. Скачать презентацию







![Мицелла {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– агрегат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/160220/slide-13.jpg)
![Возникновение ДЭС и потенциалов в мицелле {m[BaSO4] • nBa2+ (2n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/160220/slide-15.jpg)















 Введение в Физику
Введение в Физику Закон Ома для участка электрической цепи
Закон Ома для участка электрической цепи Ячеечная модель реакторов
Ячеечная модель реакторов Экспериментальные и теоретические основы квантовой теории
Экспериментальные и теоретические основы квантовой теории Устройство автомобиля
Устройство автомобиля Решение задач по теме Законы Ньютона
Решение задач по теме Законы Ньютона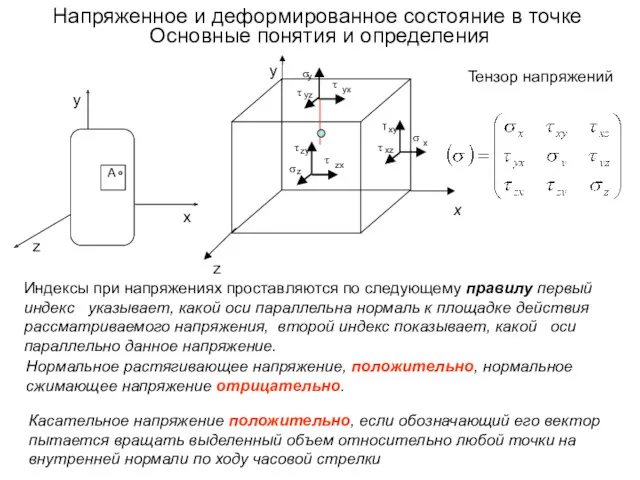 Напряженное и деформированное состояние в точке. Основные понятия и определения
Напряженное и деформированное состояние в точке. Основные понятия и определения Бензиновые двигатели
Бензиновые двигатели Теория атома водорода по Бору. Элементы квантовой механики
Теория атома водорода по Бору. Элементы квантовой механики Урок по теме Закон Кулона (презентация) 10 класс
Урок по теме Закон Кулона (презентация) 10 класс Урок по теме Квантовые постулаты Бора, 11 класс
Урок по теме Квантовые постулаты Бора, 11 класс Tormach 1100 станогын қосу және тексеру
Tormach 1100 станогын қосу және тексеру Первые шаги развития радиотехники и связи (1895-1920). Создание первого радиоприемника
Первые шаги развития радиотехники и связи (1895-1920). Создание первого радиоприемника Защита населения и объектов от чрезвычайных ситуаций. Радиационная безопасность
Защита населения и объектов от чрезвычайных ситуаций. Радиационная безопасность Основные понятия электрических цепей
Основные понятия электрических цепей Индукционные нагреватели. Перспективы и области применения
Индукционные нагреватели. Перспективы и области применения Средства механизации строительства
Средства механизации строительства Что называют волнами?
Что называют волнами? Магнетизм. ЭМ колебания и волны
Магнетизм. ЭМ колебания и волны Внеклассное мероприятие по физике 7 класс игра: Кто хочет стать отличником.
Внеклассное мероприятие по физике 7 класс игра: Кто хочет стать отличником. Геометрическая оптика. (Лекция 4)
Геометрическая оптика. (Лекция 4) Измерение углов призм и клиньев на гониометре и оптической скамье. Измерение погрешностей прямоугольных призм
Измерение углов призм и клиньев на гониометре и оптической скамье. Измерение погрешностей прямоугольных призм Тепловое излучение. Лекция 9
Тепловое излучение. Лекция 9 Гигиена труда с радиоактивными веществами и источниками ионизирующего излучения
Гигиена труда с радиоактивными веществами и источниками ионизирующего излучения Пространство и время
Пространство и время Презентация к уроку на тему:Фотоэффект
Презентация к уроку на тему:Фотоэффект Физические и химические явления вокруг нас
Физические и химические явления вокруг нас Физический брейн-ринг
Физический брейн-ринг