Содержание
- 2. Реальный газ Межмолекулярные взаимодействия. Уравнение состояния реального газа (Уравнение Ван дер Ваальса). Изотермы реального газа. Критические
- 3. Реальный газ Идеальный газ: пренебрегали межмолекулярным взаимодействием собственным объёмом молекул При больших плотностях газа и при
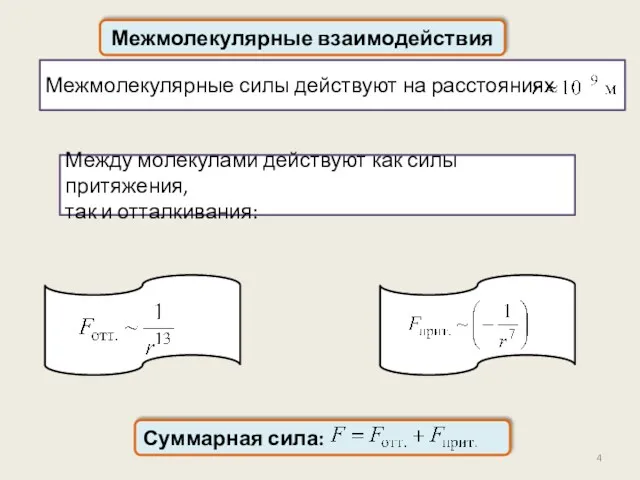
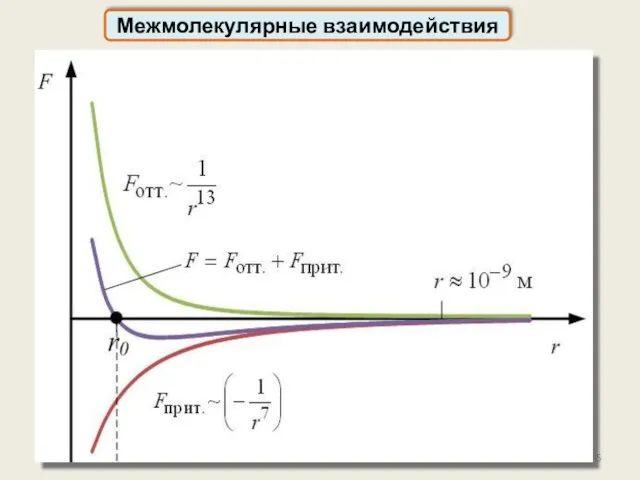
- 4. Межмолекулярные силы действуют на расстояниях Между молекулами действуют как силы притяжения, так и отталкивания: Межмолекулярные взаимодействия
- 5. Межмолекулярные взаимодействия
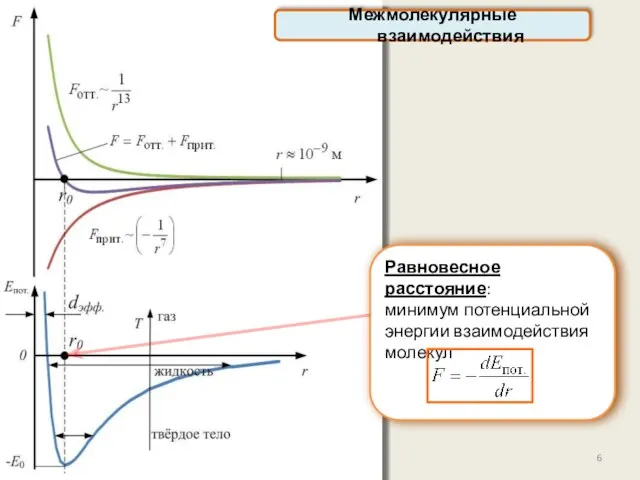
- 6. Равновесное расстояние: минимум потенциальной энергии взаимодействия молекул Межмолекулярные взаимодействия
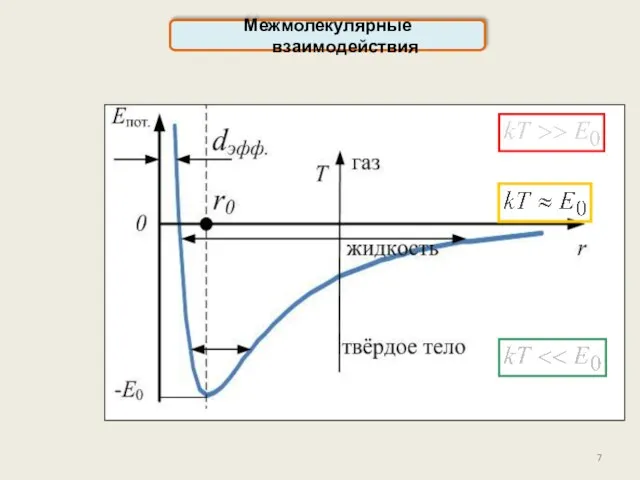
- 7. Межмолекулярные взаимодействия
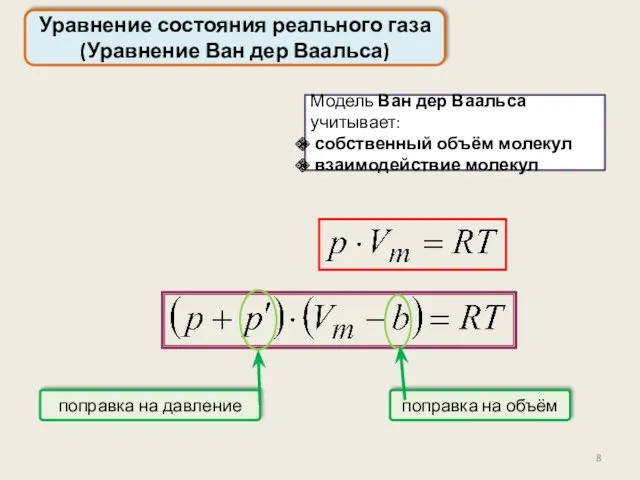
- 8. Уравнение состояния реального газа (Уравнение Ван дер Ваальса) поправка на объём Модель Ван дер Ваальса учитывает:
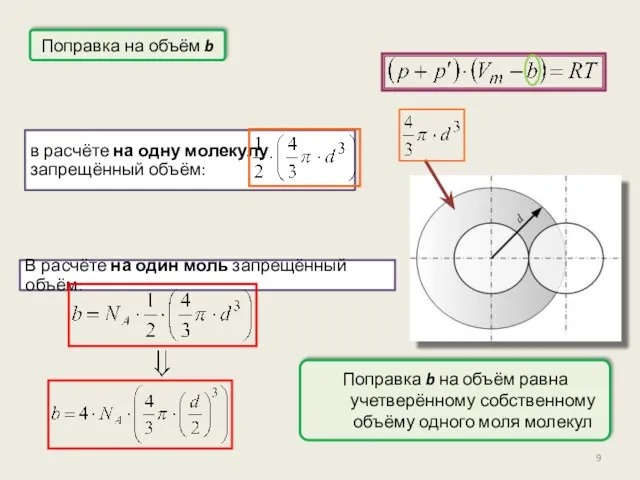
- 9. Поправка на объём b в расчёте на одну молекулу запрещённый объём: В расчёте на один моль
- 10. p’ – поправка на давление Сила притяжения двух слоёв газа друг к другу пропорциональна числу молекул
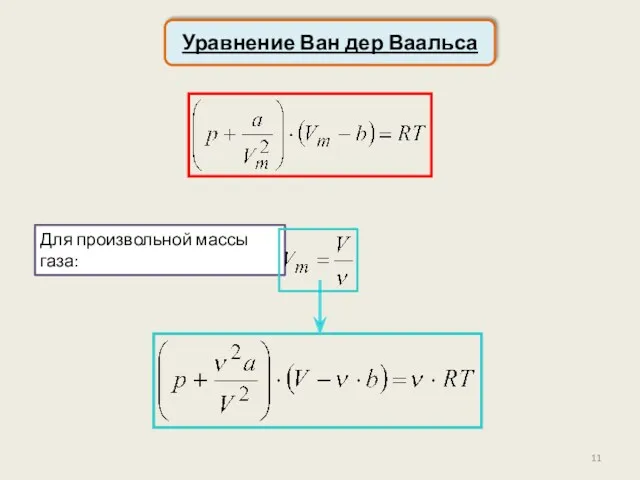
- 11. Уравнение Ван дер Ваальса Для произвольной массы газа:
- 12. Уравнение Ван дер Ваальса Замечание 1: при высоких температурах и низких плотностях (низком давлении) молярный объём
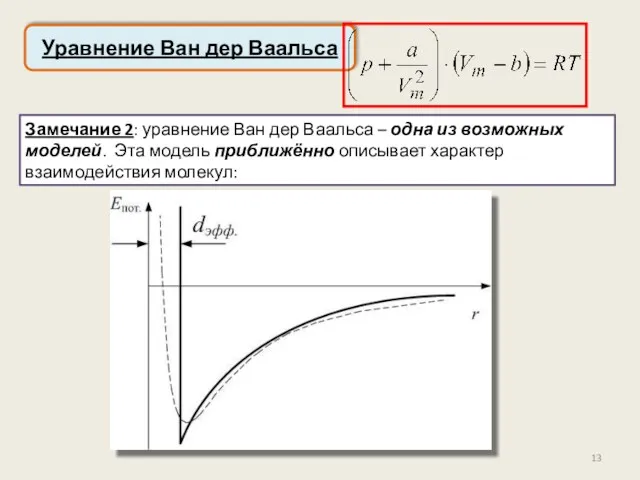
- 13. Уравнение Ван дер Ваальса Замечание 2: уравнение Ван дер Ваальса – одна из возможных моделей. Эта
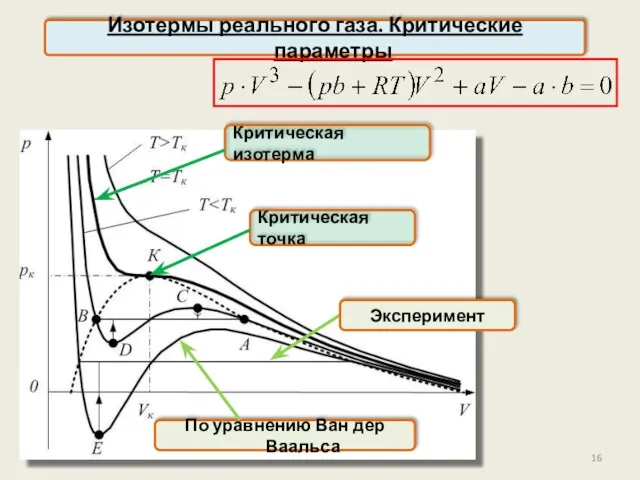
- 14. Изотермы реального газа. Критические параметры Обозначение:
- 15. Изотермы реального газа. Критические параметры Это уравнение третьей степени относительно объёма В общем случае оно имеет
- 16. Изотермы реального газа. Критические параметры Критическая изотерма Критическая точка По уравнению Ван дер Ваальса Эксперимент
- 17. Изотермы реального газа. Критические параметры Критическая изотерма перегретая жидкость Растянутая жидкость переохлаждённый пар
- 18. Критическое состояние Критическое состояние – особое состояние вещества, пограничное между паром и жидкостью Критическая точка –
- 19. Критическое состояние В критической точке уравнение Ван дер Ваальса имеет три одинаковых корня, поэтому его можно
- 20. Критическое состояние Связь между критическими параметрами pк , Tк и Vк и поправочными коэффициентами a и
- 21. Критическое состояние
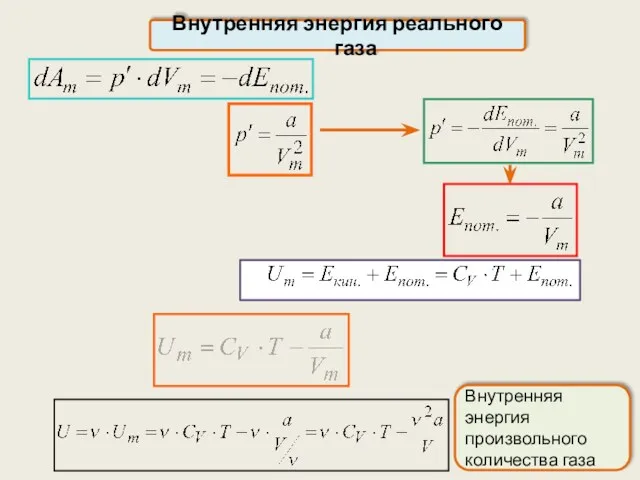
- 22. Внутренняя энергия реального газа Внутренняя энергия реального газа равна сумме: кинетической энергии хаотического движения молекул потенциальной
- 23. Внутренняя энергия реального газа Внутренняя энергия произвольного количества газа
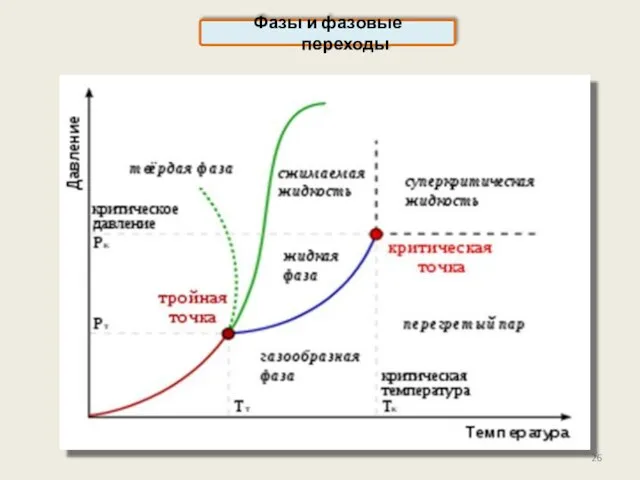
- 24. Фазы и фазовые переходы Фаза – термодинамически равновесное однородное по физическим свойствам состояние вещества Графит и
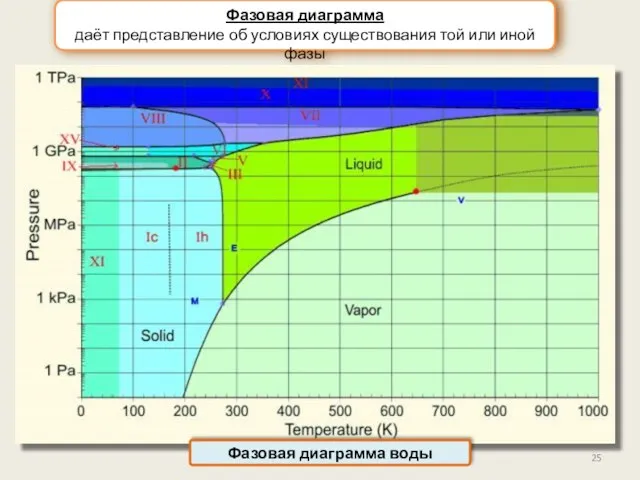
- 25. Фазовая диаграмма даёт представление об условиях существования той или иной фазы Фазовая диаграмма воды
- 26. Фазы и фазовые переходы
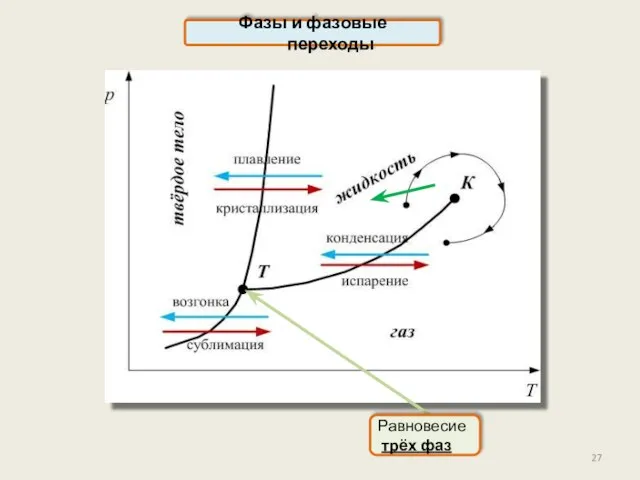
- 27. Фазы и фазовые переходы Равновесие трёх фаз
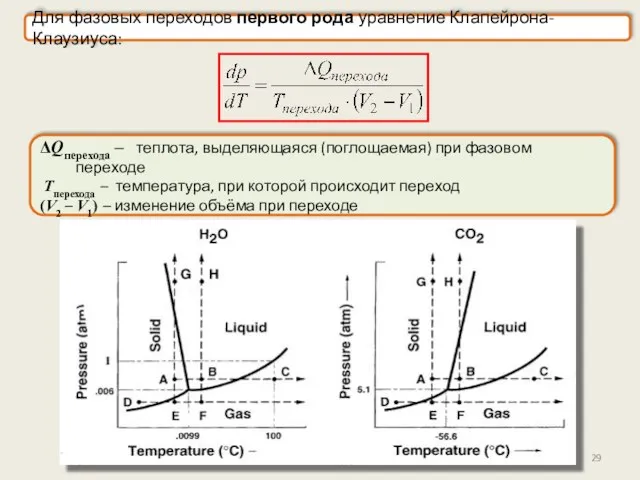
- 28. Фазы и фазовые переходы Все агрегатные превращения – это фазовые переходы первого рода: парообразование, конденсация, сублимация,
- 29. ΔQперехода – теплота, выделяющаяся (поглощаемая) при фазовом переходе Tперехода – температура, при которой происходит переход (V2
- 30. Фазы и фазовые переходы При фазовых переходах второго рода скачкообразно меняются свойства вещества: теплоёмкость, вязкость, ферромагнитные
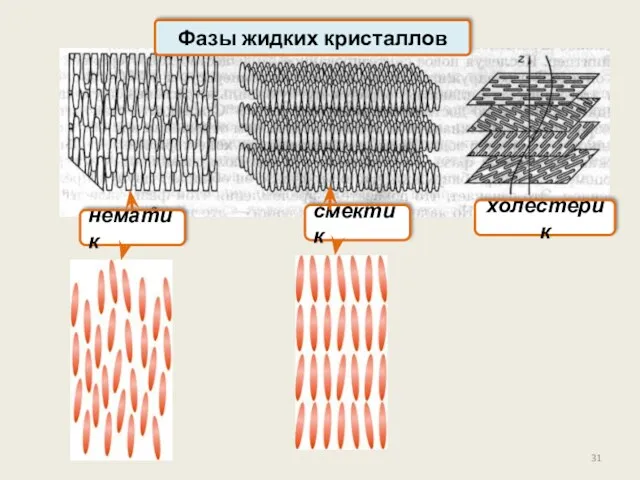
- 31. Фазы жидких кристаллов нематик смектик холестерик
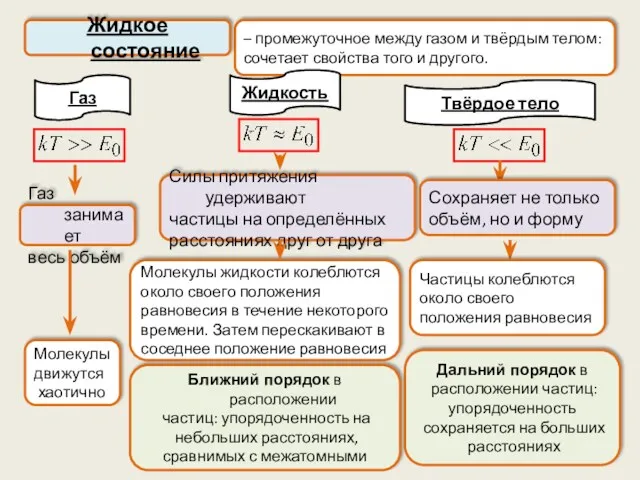
- 32. – промежуточное между газом и твёрдым телом: сочетает свойства того и другого. Жидкое состояние Газ Дальний
- 33. С возрастанием температуры молекулы становятся более подвижными Теории жидкости, объясняющей все её свойства, нет. Некоторые проблемы
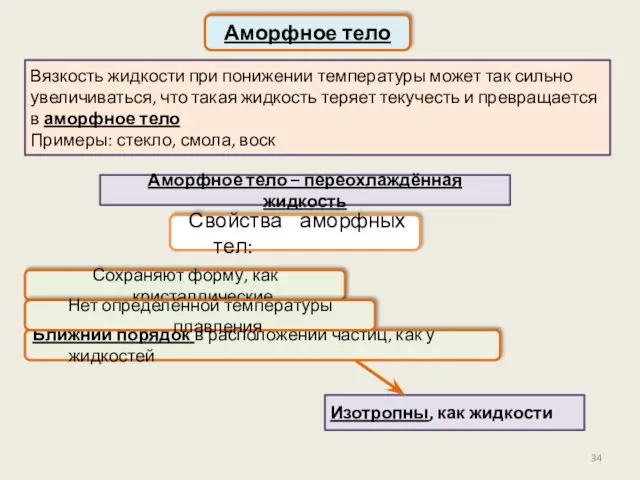
- 34. Сохраняют форму, как кристаллические Свойства аморфных тел: Вязкость жидкости при понижении температуры может так сильно увеличиваться,
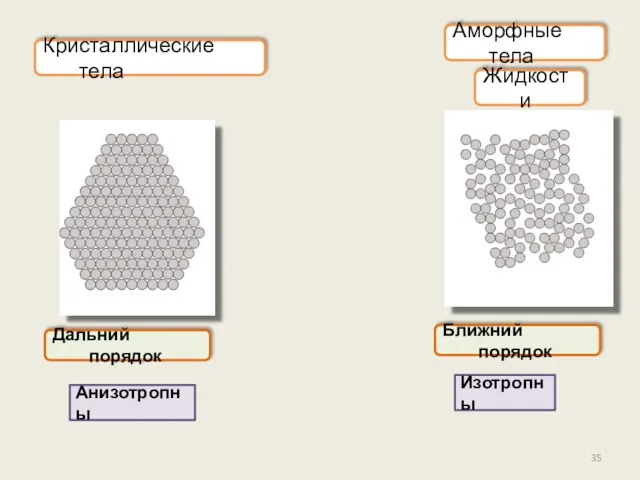
- 35. Аморфные тела Изотропны Дальний порядок Жидкости Кристаллические тела Ближний порядок Анизотропны
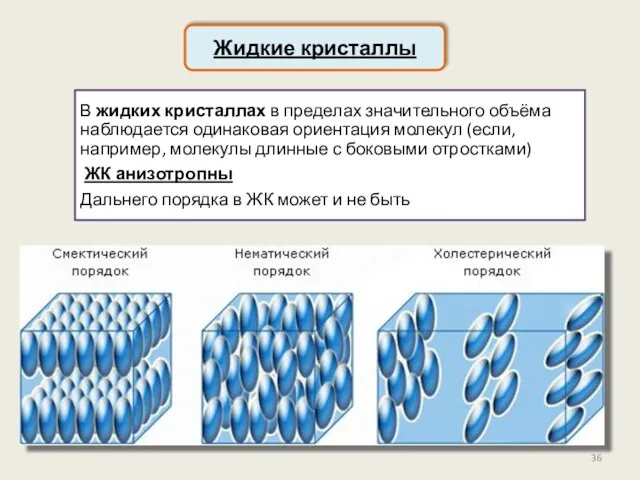
- 36. Жидкие кристаллы В жидких кристаллах в пределах значительного объёма наблюдается одинаковая ориентация молекул (если, например, молекулы
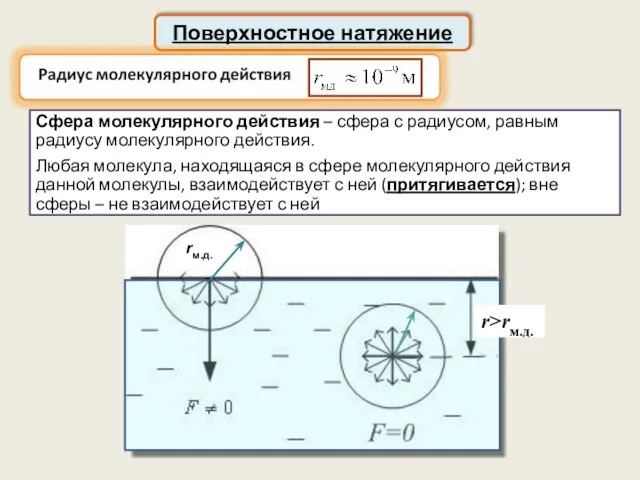
- 37. Поверхностное натяжение Сфера молекулярного действия – сфера с радиусом, равным радиусу молекулярного действия. Любая молекула, находящаяся
- 38. Для перемещения молекулы из глубины жидкости на поверхность молекула должна затратить энергию, следовательно, за счёт своей
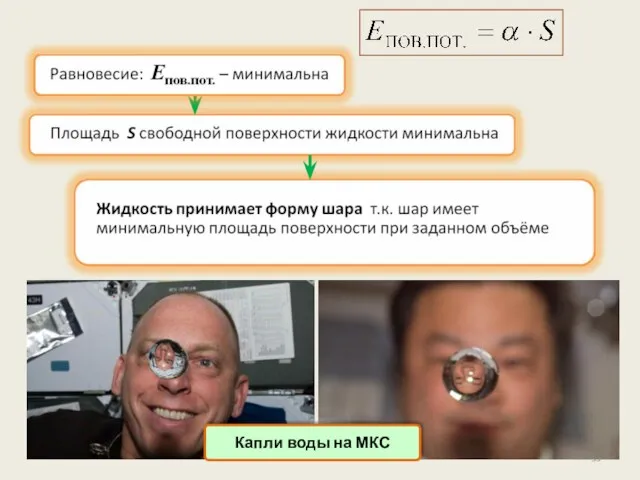
- 39. Капли воды на МКС
- 40. α - коэффициент поверхностного натяжения численно равен силе поверхностного натяжения, приходящейся на единицу длины контура
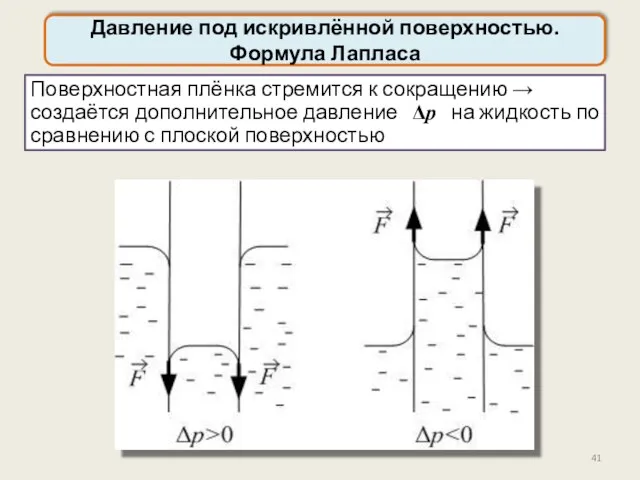
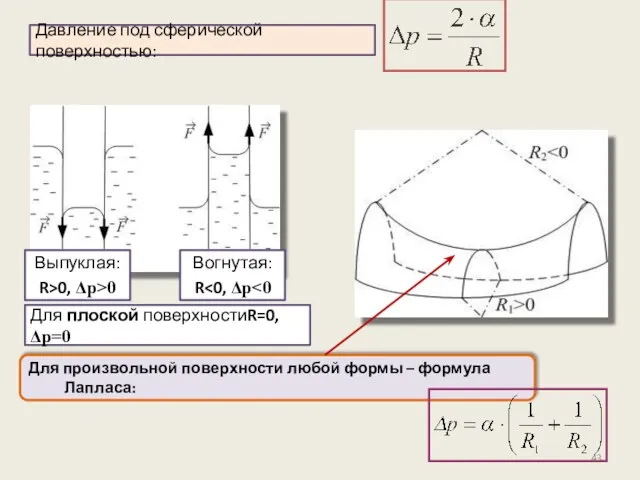
- 41. Давление под искривлённой поверхностью. Формула Лапласа Поверхностная плёнка стремится к сокращению → создаётся дополнительное давление Δp
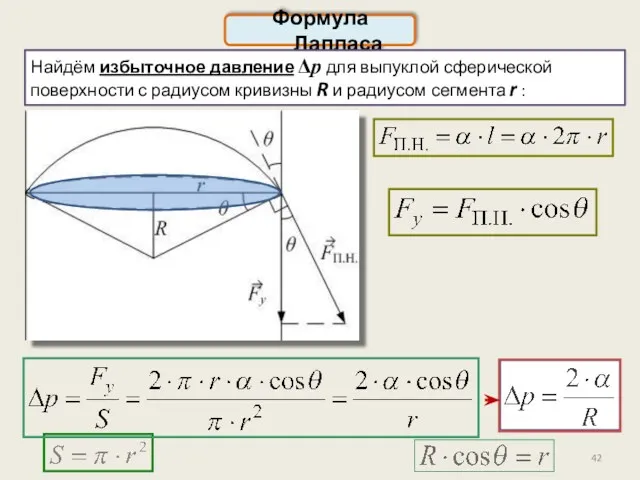
- 42. Формула Лапласа Найдём избыточное давление Δp для выпуклой сферической поверхности с радиусом кривизны R и радиусом
- 43. Для произвольной поверхности любой формы – формула Лапласа: Давление под сферической поверхностью: Для плоской поверхностиR=0, Δp=0
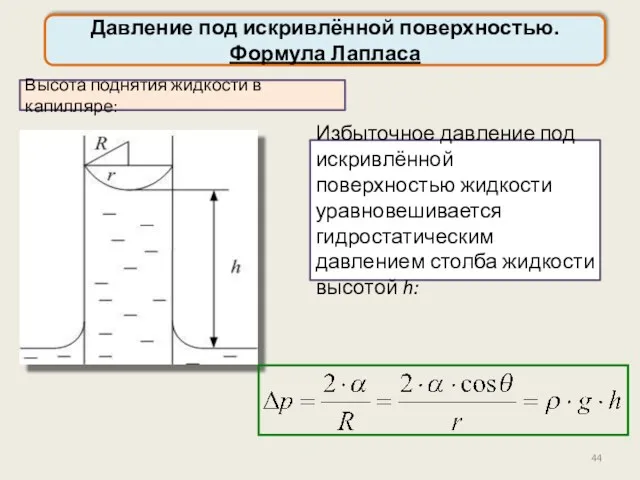
- 44. Давление под искривлённой поверхностью. Формула Лапласа Высота поднятия жидкости в капилляре: Избыточное давление под искривлённой поверхностью
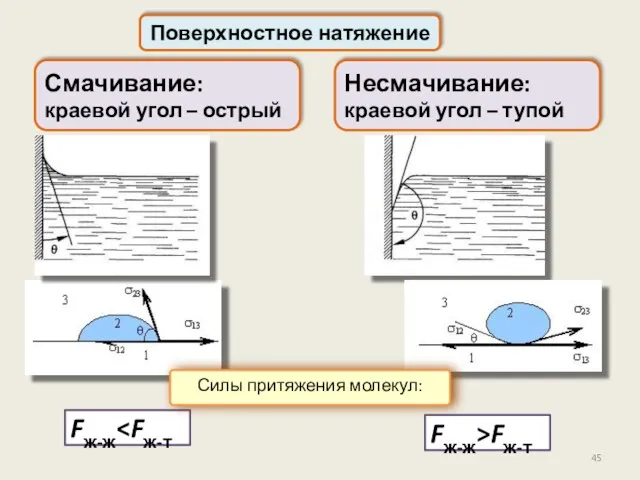
- 45. Поверхностное натяжение Fж-ж Смачивание: краевой угол – острый Несмачивание: краевой угол – тупой Fж-ж>Fж-т Силы притяжения
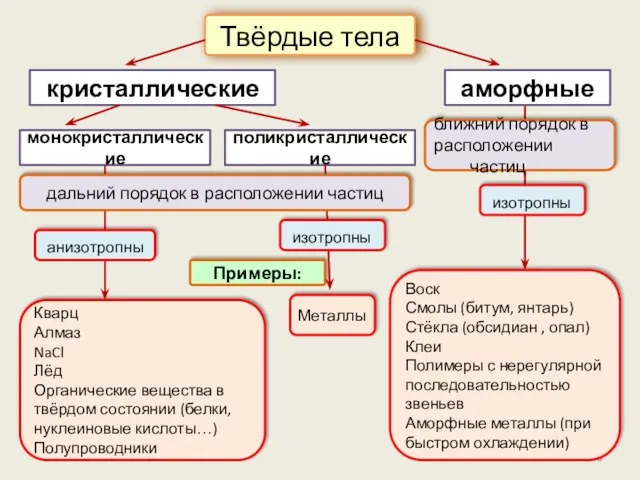
- 46. кристаллические Твёрдые тела аморфные Примеры: Воск Смолы (битум, янтарь) Стёкла (обсидиан , опал) Клеи Полимеры с
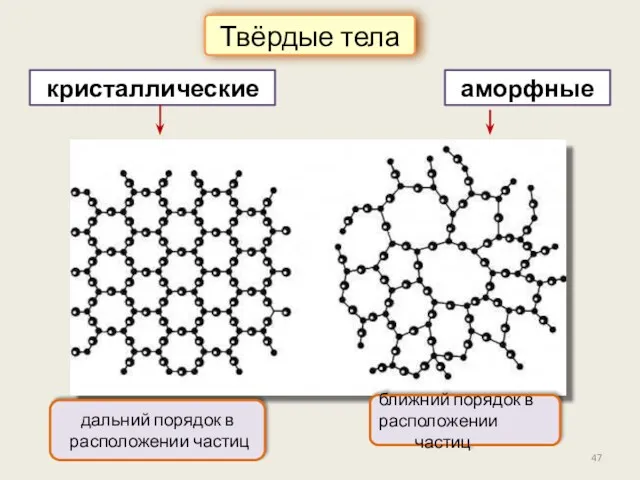
- 47. кристаллические Твёрдые тела аморфные дальний порядок в расположении частиц ближний порядок в расположении частиц
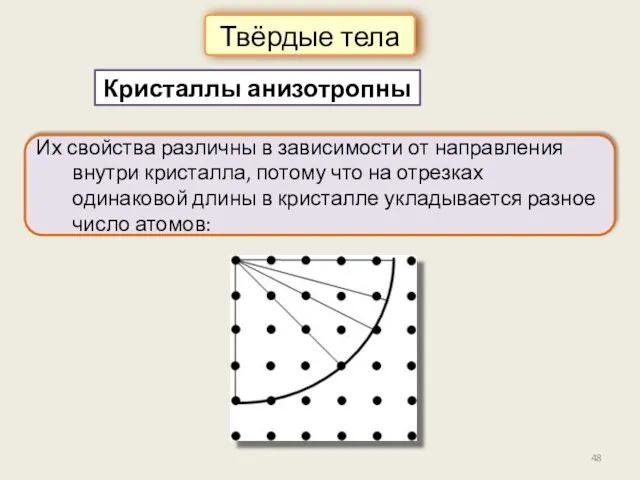
- 48. Кристаллы анизотропны Твёрдые тела Их свойства различны в зависимости от направления внутри кристалла, потому что на
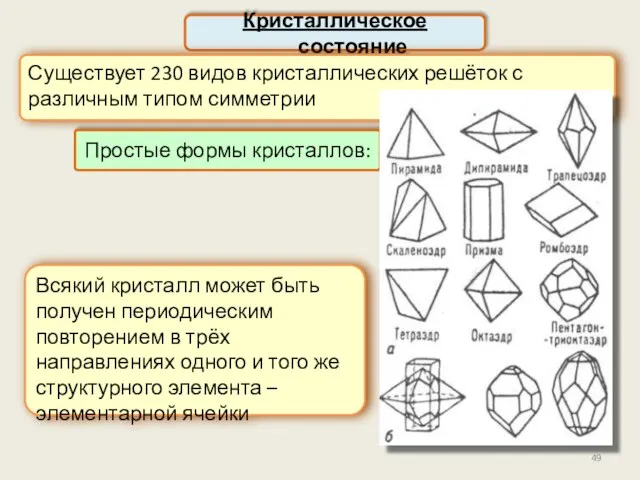
- 49. Кристаллическое состояние Существует 230 видов кристаллических решёток с различным типом симметрии Всякий кристалл может быть получен
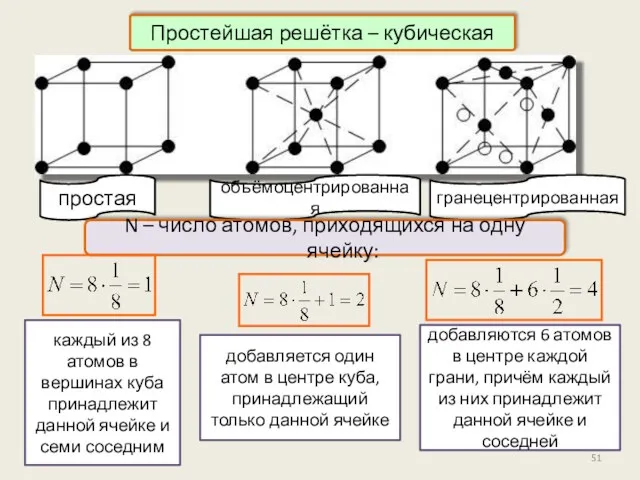
- 51. каждый из 8 атомов в вершинах куба принадлежит данной ячейке и семи соседним Простейшая решётка –
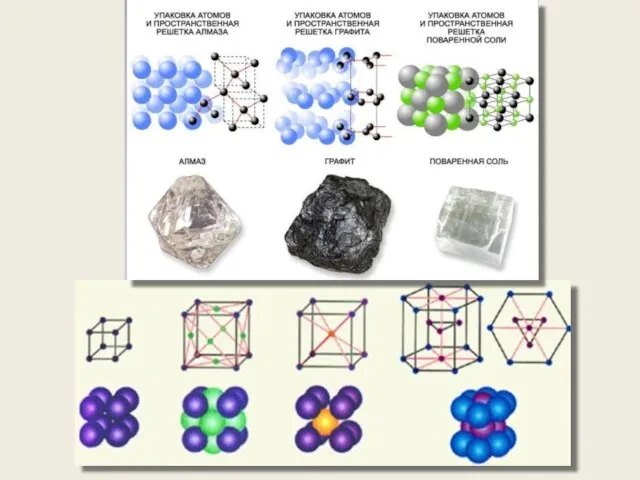
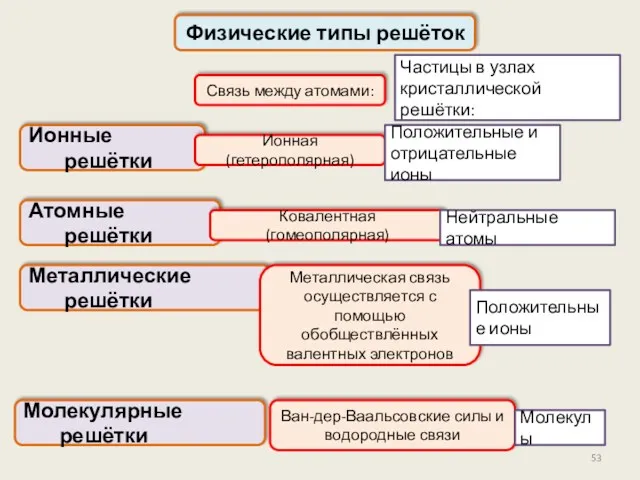
- 52. Физические типы решёток Ионные решётки В зависимости от природы частиц в узлах кристаллической решетки и характера
- 53. Физические типы решёток Ионные решётки Частицы в узлах кристаллической решётки: Ионная (гетерополярная) Атомные решётки Металлические решётки
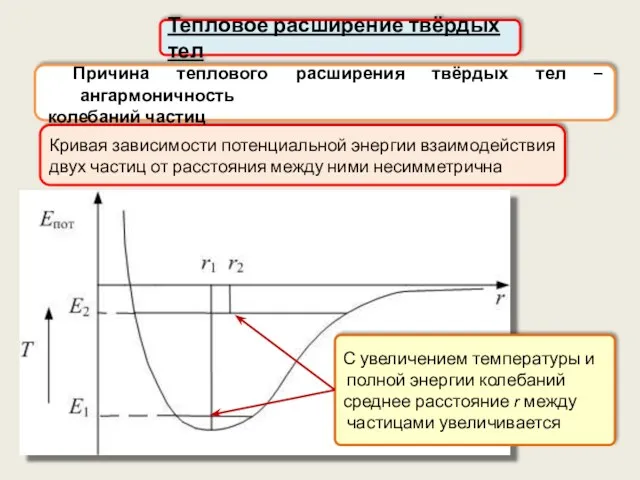
- 54. Кривая зависимости потенциальной энергии взаимодействия двух частиц от расстояния между ними несимметрична Тепловое расширение твёрдых тел
- 55. Тепловое расширение твёрдых тел Линейные размеры тела при температуре t0 C равны: Коэффициент линейного теплового расширения
- 56. Объём тела при температуре t0 C равен: Коэффициент объёмного теплового расширения β численно равен относительному увеличению
- 57. Число колебательных степени свободы i=3 Теплоёмкость твёрдых тел По теореме о равнораспределении Кинетическая энергия Потенциальная энергия
- 58. Молярная теплоёмкость: Теплоёмкость твёрдых тел. Закон Дюлонга и Пти Молярная теплоёмкость всех химически простых тел одинакова,
- 60. Скачать презентацию






















 Изгиб с кручением круглых стержней в конструкциях различных механизмов
Изгиб с кручением круглых стержней в конструкциях различных механизмов Гальванометр. Виды и применение
Гальванометр. Виды и применение Сборка изделий из тонколистового металла, проволоки и искусственных материалов. 5 класс
Сборка изделий из тонколистового металла, проволоки и искусственных материалов. 5 класс Адаптация обучающихся в учебном пространстве предмета - физика
Адаптация обучающихся в учебном пространстве предмета - физика Прибор для демонстрации графиков электромагнитных колебаний
Прибор для демонстрации графиков электромагнитных колебаний Работа лопастной машины на сеть. Напорная характеристика сети
Работа лопастной машины на сеть. Напорная характеристика сети Сила Архимеда
Сила Архимеда Атмосферное давление
Атмосферное давление Види самостійних газових розрядів
Види самостійних газових розрядів Механикалық қозғалыс. Траектория. Жол. Орын ауыстыру
Механикалық қозғалыс. Траектория. Жол. Орын ауыстыру Электрообогрев лобового стекла автомобиля
Электрообогрев лобового стекла автомобиля Презентация к уроку по физике 10 класс Применение законов Ньютона
Презентация к уроку по физике 10 класс Применение законов Ньютона Lektsia_4
Lektsia_4 Ремонт КШМ двигателя Д-240
Ремонт КШМ двигателя Д-240 Резерфорд тәжірбесі. Атомның планетарлық моделі
Резерфорд тәжірбесі. Атомның планетарлық моделі Управління потоками реактивної енергії
Управління потоками реактивної енергії Работа и мощность электрического тока
Работа и мощность электрического тока Блок - разновидность простого механизма
Блок - разновидность простого механизма Радиоактивность, модели атомов
Радиоактивность, модели атомов Лекция 5. Динамика материальной системы. Динамика тела переменной массы
Лекция 5. Динамика материальной системы. Динамика тела переменной массы ТРИЗ Электричество
ТРИЗ Электричество Электрические измерения в системах электроснабжения
Электрические измерения в системах электроснабжения Системы безопасности эксплуатации автомобилей
Системы безопасности эксплуатации автомобилей Допуски и посадки подшипников качения
Допуски и посадки подшипников качения Твердые тела и их свойства
Твердые тела и их свойства Конустық қосылыстардың өзара алмасымдылығы, әдістері және кұралдары
Конустық қосылыстардың өзара алмасымдылығы, әдістері және кұралдары Теплопередача или теплообмен
Теплопередача или теплообмен Фрезерование. Лекция №14
Фрезерование. Лекция №14