Содержание
- 2. Кристаллизация — это процесс выделения твёрдой фазы в виде кристаллов из растворов или расплавов, протекающий без
- 3. Способы кристаллизации Для осуществления кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два
- 4. Политермическая кристаллизация Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение,
- 5. Изотермическая кристаллизация Перевод исходного раствора из точки А в пересыщенное состояние можно осуществить и за счет
- 6. Кривые растворимости в воде КNО3(1), Ва(NО3)2(2) и NaCl(3). Выбор метода кристаллизации зависит от характера изменения растворимости
- 7. Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na2SO4 , растворимость которого, начиная
- 8. Кристаллизация высаливанием При добавлении к раствору вещества, понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и
- 9. В производственных условиях процесс кристаллизации состоит из следующих операций: собственно кристаллизации, отделения кристаллов от маточных растворов,
- 10. Процесс кристаллизации из растворов включает две стадии: образование кристаллических зародышей и их дальнейший рост. На образования
- 11. Центры кристаллизации возникают гомогенно в объеме начальной фазы и гетерогенно на поверхностях посторонних твердых частиц (первичное
- 12. На рост, как и на образование кристаллов влияют различные факторы: пересыщение раствора, его перемешивание, рост температуры,
- 13. При массовой кристаллизации вещества из раствора происходит перераспределение примесей между остающейся жидкой фазой (фильтратом, маточным раствором)
- 14. Дробная кристаллизация Дробная, или фракционная, кристаллизация применяется при наличии в растворе одновременно нескольких подлежащих извлечению веществ.
- 15. Эффективность разделения зависит от соотношения количеств разделяемых компонентов, их растворимости, а также от условий дробной кристаллизации.
- 17. Скачать презентацию
 Кинематика
Кинематика Расчет участка контактной сети однофазного переменного тока. Специальная часть: монтаж устройств освещения объектов
Расчет участка контактной сети однофазного переменного тока. Специальная часть: монтаж устройств освещения объектов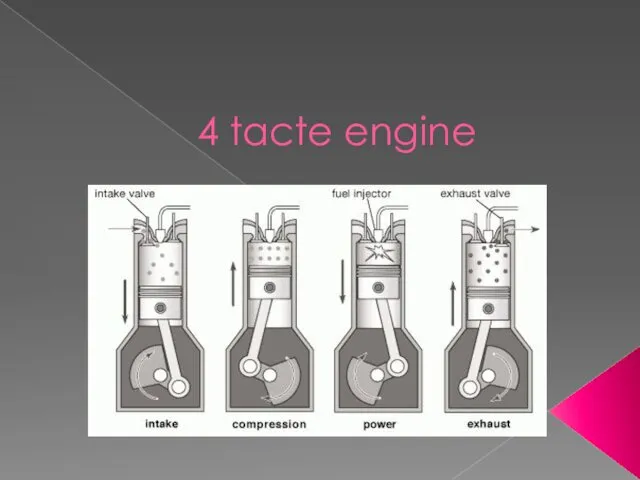 Four strokes of the engine
Four strokes of the engine Разработка урока: Решение задач по теме Газовые законы
Разработка урока: Решение задач по теме Газовые законы Условия плавания тел
Условия плавания тел Источники электроэнергии
Источники электроэнергии Строение и эволюция Вселенной
Строение и эволюция Вселенной Реальные среды. Жидкости и твердые тела
Реальные среды. Жидкости и твердые тела Геофизические исследования скважин (ГИС). Методы каротажа
Геофизические исследования скважин (ГИС). Методы каротажа Динамика вращательного движения (динамика абсолютно твёрдого тела)
Динамика вращательного движения (динамика абсолютно твёрдого тела) Волновая оптика
Волновая оптика Силы в природе (7 класс)
Силы в природе (7 класс) Механические колебания
Механические колебания Назначение, классификация, общее устройство ДВС. Основные параметры работы ДВС. Рабочий цикл ДВС. Тема 2.1.1
Назначение, классификация, общее устройство ДВС. Основные параметры работы ДВС. Рабочий цикл ДВС. Тема 2.1.1 Презентация 5
Презентация 5 Скоростемер 3СЛ-2м. Функции скоростемера 3СЛ-2м
Скоростемер 3СЛ-2м. Функции скоростемера 3СЛ-2м Элементы специальной теории относительности (СТО). Релятивистская динамика
Элементы специальной теории относительности (СТО). Релятивистская динамика Технология термической обработки
Технология термической обработки Сила трения. Трение в природе и технике
Сила трения. Трение в природе и технике Механические волны
Механические волны Трение. Силы трения
Трение. Силы трения Презентация к уроку физики 9 класса Радиоактивность
Презентация к уроку физики 9 класса Радиоактивность Ионные двигатели
Ионные двигатели Телескопы. Оптические телескопы
Телескопы. Оптические телескопы Фізика та екологія
Фізика та екологія Простой механизм
Простой механизм 2.1 МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ
2.1 МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ Фізика в сучасному житті людини
Фізика в сучасному житті людини