Содержание
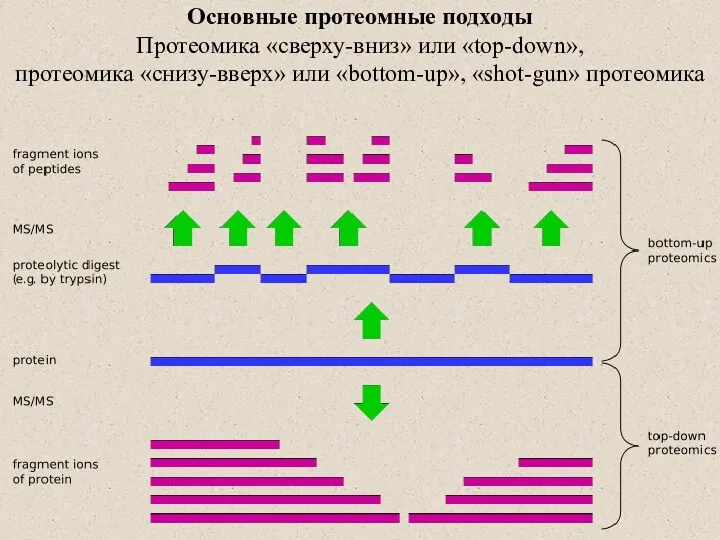
- 2. Основные протеомные подходы Протеомика «сверху-вниз» или «top-down», протеомика «снизу-вверх» или «bottom-up», «shot-gun» протеомика
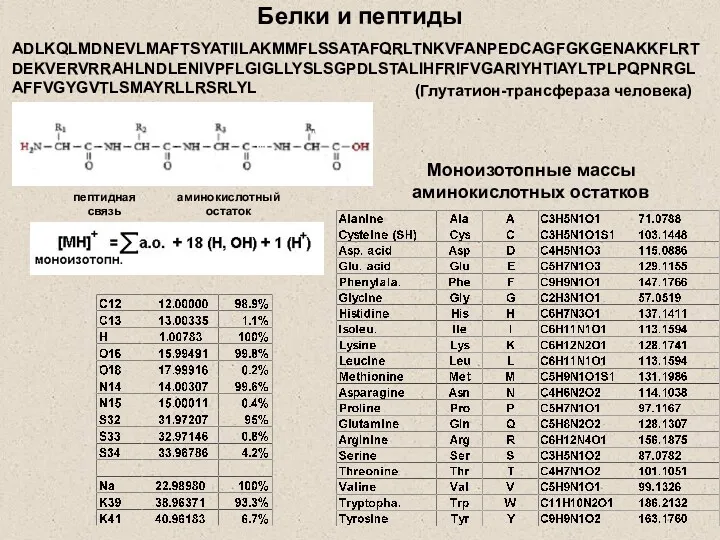
- 3. Белки и пептиды Моноизотопные массы аминокислотных остатков ADLKQLMDNEVLMAFTSYATIILAKMMFLSSATAFQRLTNKVFANPEDCAGFGKGENAKKFLRTDEKVERVRRAHLNDLENIVPFLGIGLLYSLSGPDLSTALIHFRIFVGARIYHTIAYLTPLPQPNRGLAFFVGYGVTLSMAYRLLRSRLYL (Глутатион-трансфераза человека) пептидная связь аминокислотный остаток
- 4. SAPASTTQPIGSTTSTTTKTAGATPATASGLFTIPDGDFFSTARAIVASNAVATNEDLSKIEAIWKDMKVPTDTMAQAAWDLVRHCADVGSSAQTEMIDTGPYSNGISRARLAAAIKEVCTLRQFCMKYAPVVWNWMLTNNSPPANWQAQGFKPEHKFAAFDFFNGVTNPAAIMPKEGLIRPPSEAEMNAAQTAAFVKITKARAQSNDFASLDAAVTRGRITGTTTAEAVVTLPPP (Белок оболочки Х-вируса картофеля) Пептидный фингерпринт Num From-To MH+ HPLC pI Sequence 1 1- 19
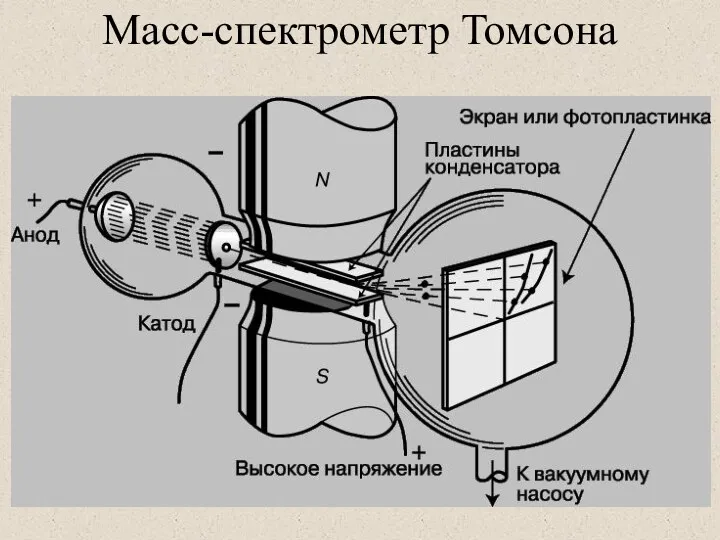
- 5. История масс-спектрометрии 1912 год — Томсон создает первый масс-спектрограф и получает масс-спектры молекул кислорода, азота, угарного
- 6. Масс-спектрометр Томсона
- 7. ICP масс-спектрометр (ICP-MS) Серия 7700x
- 8. Электроспрей-TOF (ESI-TOF) масс-спектрометр Серия 6500
- 9. Квадрупольный масс-спектрометр (QMS) 10 000 u/sec | серия 6100
- 10. Тройной квадруполь (QMS) Серия 7000
- 11. Ионная ловушка (ITMS) Серия 6300
- 12. MALDI-TOF: Bruker Reflex III
- 13. Прибор для капиллярного электрофореза с масс-спектрометрическим детектором (CE/MS)
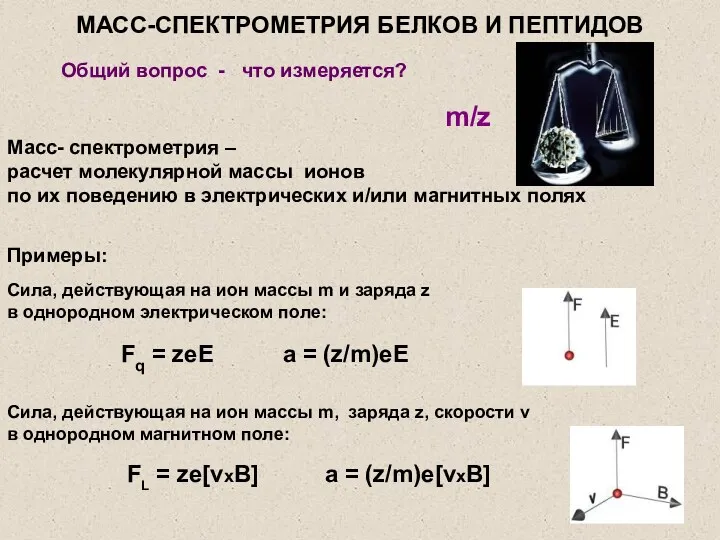
- 14. Общий вопрос - что измеряется? Масс- спектрометрия – расчет молекулярной массы ионов по их поведению в
- 15. Источник ионов Система разделения ионов Детектор Общая схема масс-спектрометра MALDI ESI Времяпролетные (TOF) Квадрупольные (Q) Ионные
- 16. ! Масс-спектрометр – вакуумный прибор
- 17. Способы ионизации Газовая фаза электронная ионизация (EI) химическая ионизация (CI) электронный захват (EC) ионизация в электрическом
- 18. Источники ионизации ESI MALDI APCI
- 19. Масс-анализаторы Непрерывные масс-анализаторы Магнитный и электростатический секторный масс-анализатор (англ. Sector instrument) Квадрупольный масс-анализатор (англ. Quadrupole mass
- 20. Детекторы фотопластина динодные вторично-электронные умножители фотоумножители микроканальные пластины коллекторы Фарадея
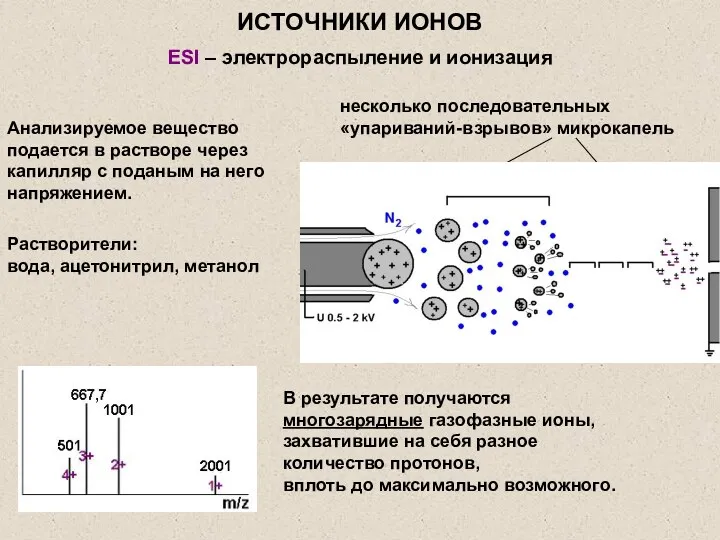
- 21. ESI – электрораспыление и ионизация Растворители: вода, ацетонитрил, метанол Анализируемое вещество подается в растворе через капилляр
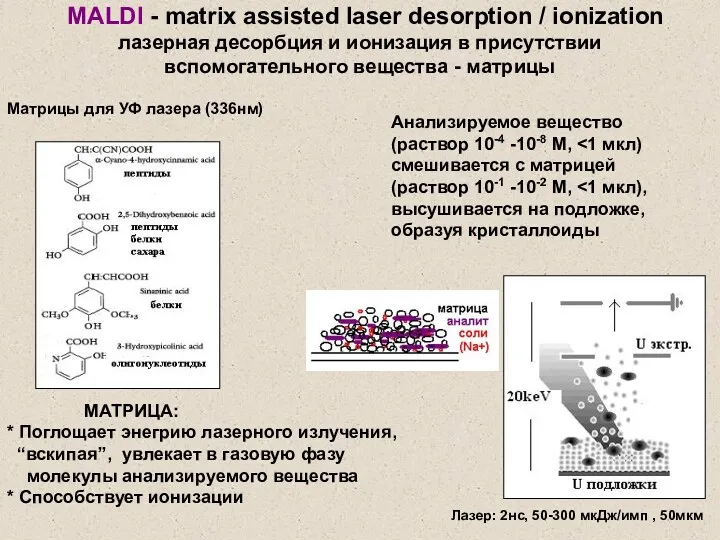
- 22. МАТРИЦА: * Поглощает энегрию лазерного излучения, “вскипая”, увлекает в газовую фазу молекулы анализируемого вещества * Способствует
- 23. Пластина для MALDI
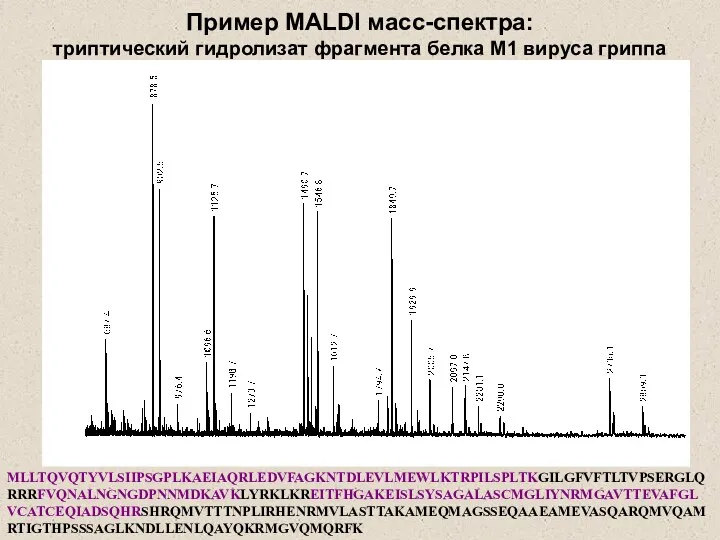
- 24. MLLTQVQTYVLSIIPSGPLKAEIAQRLEDVFAGKNTDLEVLMEWLKTRPILSPLTKGILGFVFTLTVPSERGLQRRRFVQNALNGNGDPNNMDKAVKLYRKLKREITFHGAKEISLSYSAGALASCMGLIYNRMGAVTTEVAFGLVCATCEQIADSQHRSHRQMVTTTNPLIRHENRMVLASTTAKAMEQMAGSSEQAAEAMEVASQARQMVQAMRTIGTHPSSSAGLKNDLLENLQAYQKRMGVQMQRFK Пример MALDI масс-спектра: триптический гидролизат фрагмента белка М1 вируса гриппа
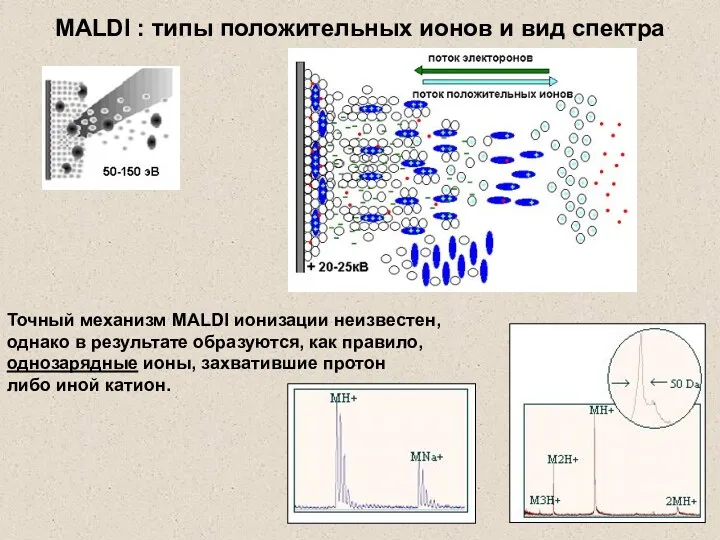
- 25. Точный механизм MALDI ионизации неизвестен, однако в результате образуются, как правило, однозарядные ионы, захватившие протон либо
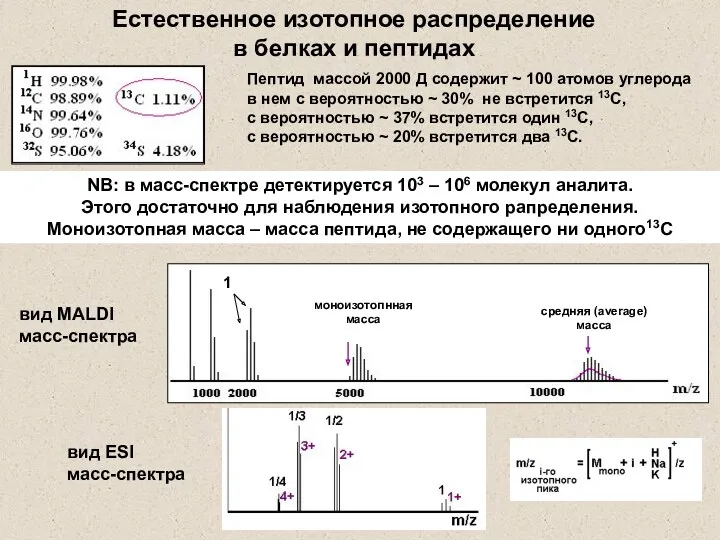
- 26. Пептид массой 2000 Д содержит ~ 100 атомов углерода в нем с вероятностью ~ 30% не
- 27. * Оба метода ионизации требуют высокой химической чистоты анализируемого вещества. * Диапазон концентрации аналита при ESI
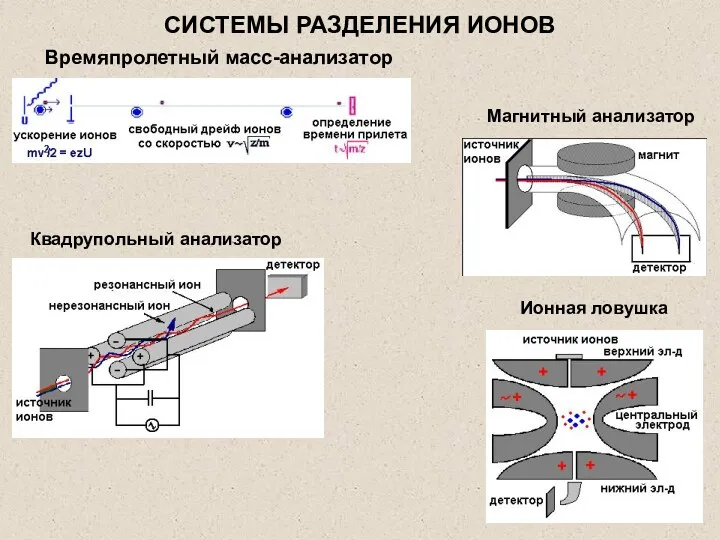
- 28. Квадрупольный анализатор Ионная ловушка Магнитный анализатор Времяпролетный масс-анализатор СИСТЕМЫ РАЗДЕЛЕНИЯ ИОНОВ
- 29. Микроканальные пластины При MALDI существует разброс по энергиям, приводящий к уширению пиков. Энергия ускорения 20 кэВ
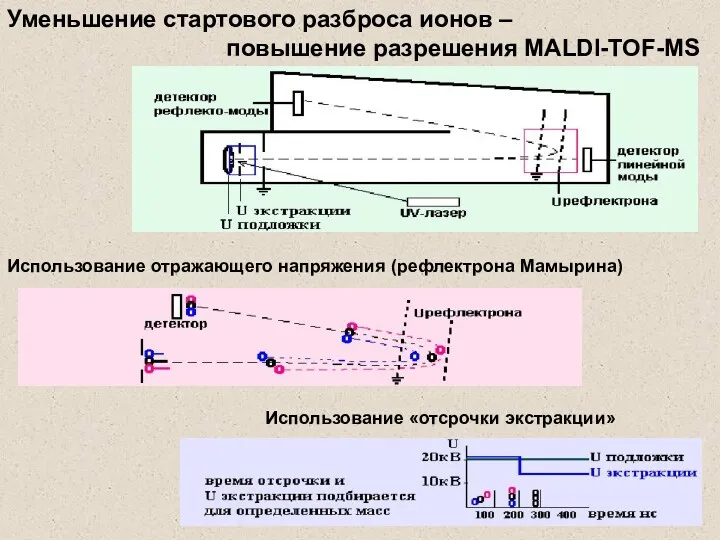
- 30. Использование отражающего напряжения (рефлектрона Мамырина) Использование «отсрочки экстракции» вакуум Уменьшение стартового разброса ионов – повышение разрешения
- 31. Рефлектрон
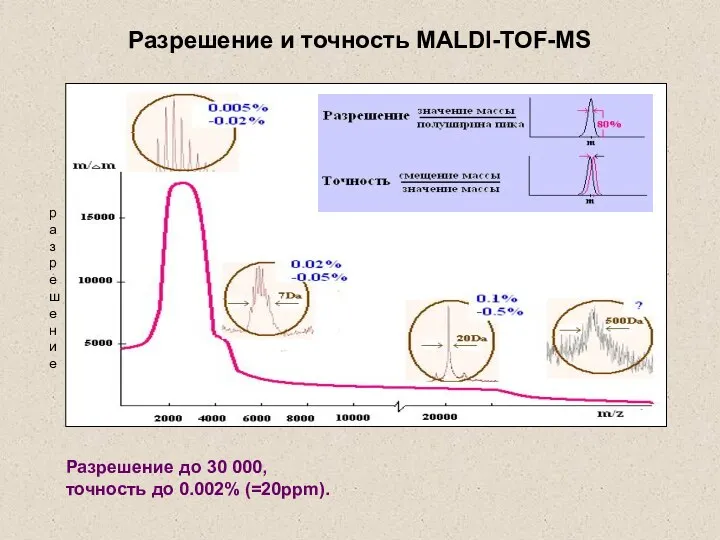
- 32. Разрешение до 30 000, точность до 0.002% (=20ppm). Разрешение и точность MALDI-TOF-MS
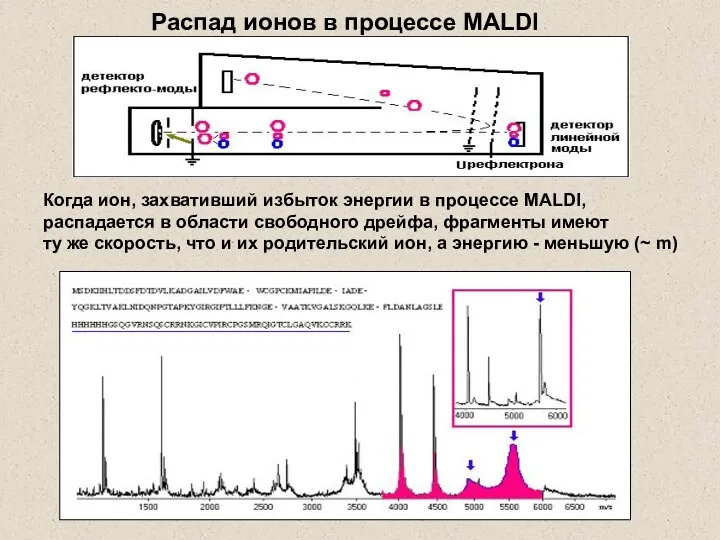
- 33. Когда ион, захвативший избыток энергии в процессе MALDI, распадается в области свободного дрейфа, фрагменты имеют ту
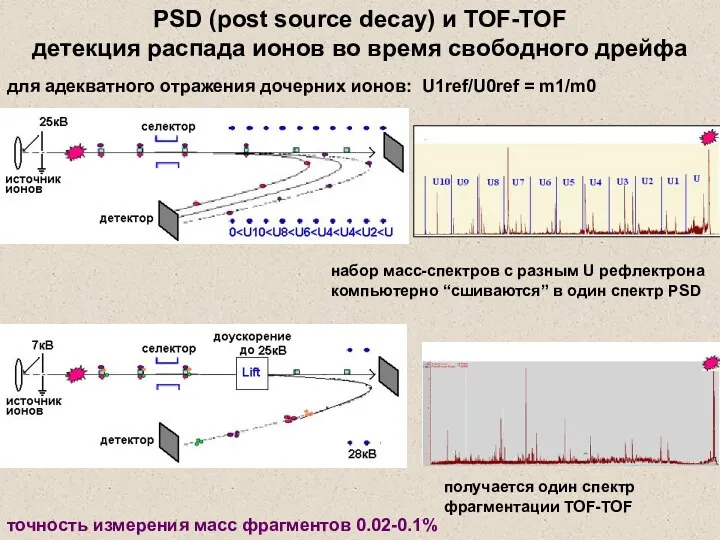
- 34. для адекватного отражения дочерних ионов: U1ref/U0ref = m1/m0 набор масс-спектров с разным U рефлектрона компьютерно “сшиваются”
- 35. На верхний и нижний электроды подано постоянное положительное напряжение. На короткое время отталкивающее напряжение с верхнего
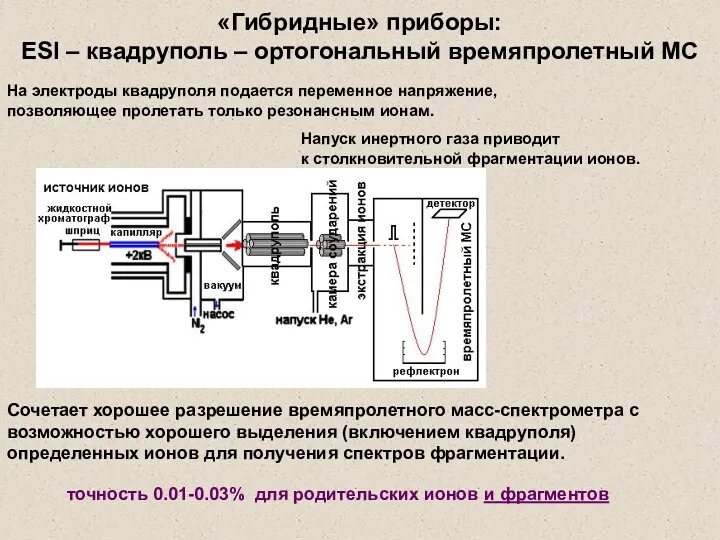
- 36. Сочетает хорошее разрешение времяпролетного масс-спектрометра с возможностью хорошего выделения (включением квадруполя) определенных ионов для получения спектров
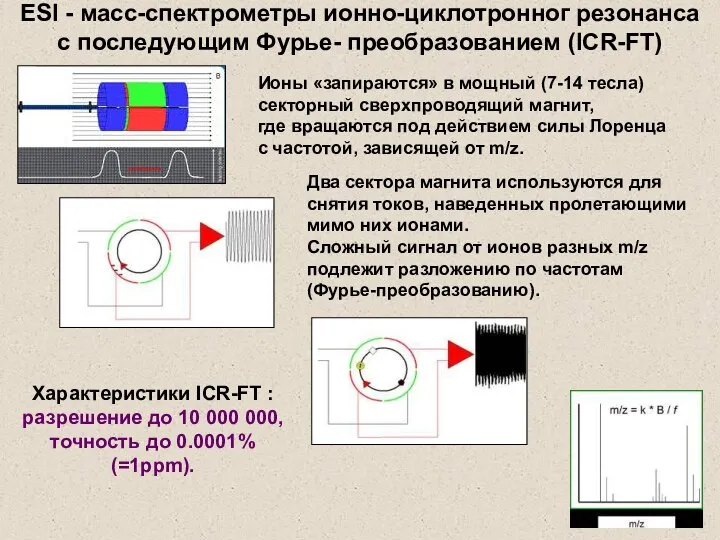
- 37. Ионы «запираются» в мощный (7-14 тесла) секторный сверхпроводящий магнит, где вращаются под действием силы Лоренца с
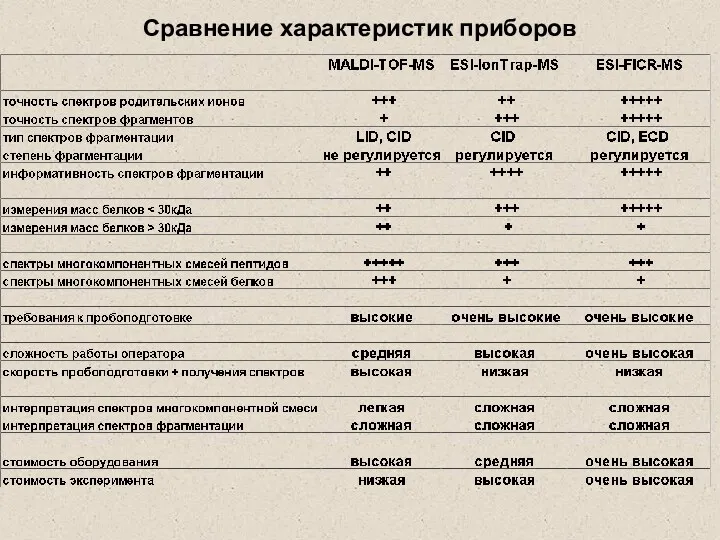
- 38. Сравнение характеристик приборов
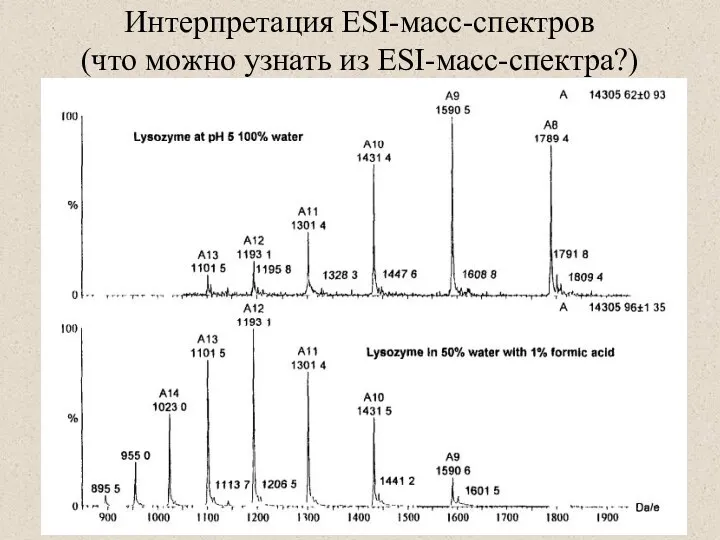
- 39. Интерпретация ESI-масс-спектров (что можно узнать из ESI-масс-спектра?)
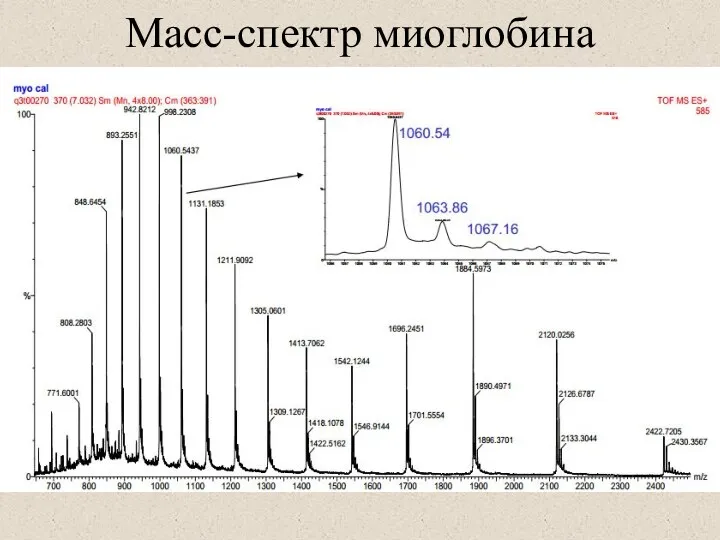
- 40. Масс-спектр миоглобина
- 41. ESI-масс-спектры Определение молекулярной массы белка Исследование вторичной структуры (распределение зарядов и водородный обмен) Как определить молекулярную
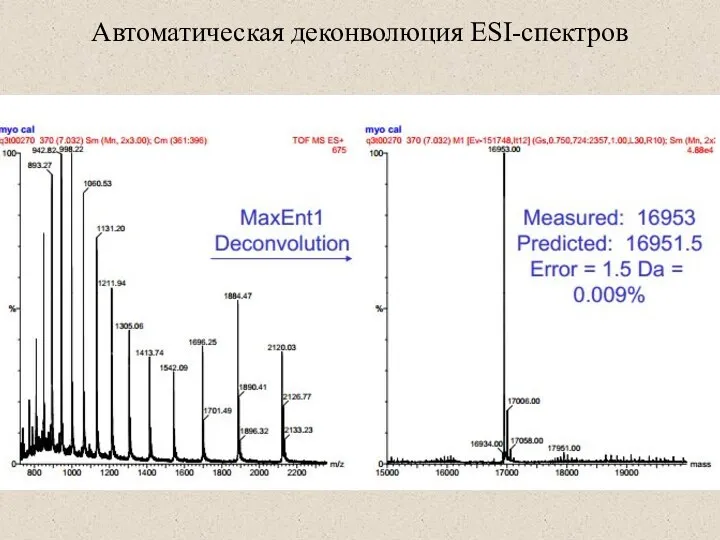
- 42. Автоматическая деконволюция ESI-спектров
- 44. Скачать презентацию





















 61f4bb8105f047b8922e06e3e916ed53
61f4bb8105f047b8922e06e3e916ed53 Сила упругости. Закон Гука. Сила реакции опоры. Причина возникновения силы упругости
Сила упругости. Закон Гука. Сила реакции опоры. Причина возникновения силы упругости Лампы накаливания. Электронагревательные приборы
Лампы накаливания. Электронагревательные приборы Урок по теме: Физические величины и их измерение.
Урок по теме: Физические величины и их измерение. Тормозная система автомобиля
Тормозная система автомобиля Конференция фонда Династия 2011 год
Конференция фонда Династия 2011 год Специальная теория относительности. Постулаты теории относительности
Специальная теория относительности. Постулаты теории относительности Жидкие кристаллы
Жидкие кристаллы Презентация по теме Импульс и его сохранение
Презентация по теме Импульс и его сохранение Измерение влажности
Измерение влажности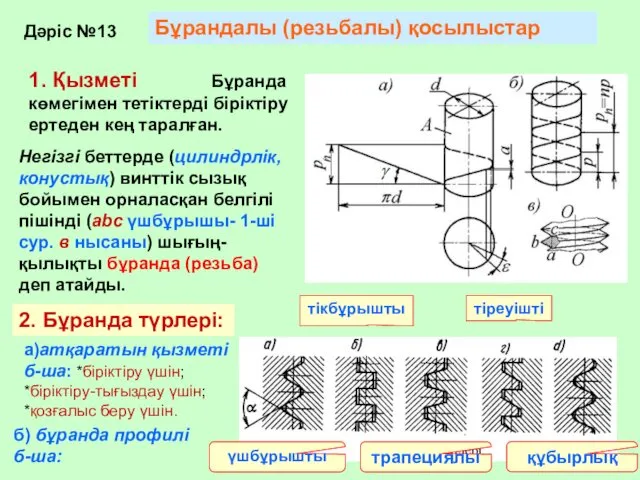 Бұрандалы қосылыстар
Бұрандалы қосылыстар Холодильные и теплонасосные установки
Холодильные и теплонасосные установки Солнечные источники энергии. Солнечные батареи
Солнечные источники энергии. Солнечные батареи Управляемый термоядерный синтез (УТС)
Управляемый термоядерный синтез (УТС) Электрический ток
Электрический ток Механические волны
Механические волны Резка металла
Резка металла Корабельные энергетические установки. Лекция 1.2
Корабельные энергетические установки. Лекция 1.2 Физические величины. Измерение физических величин 7 класс
Физические величины. Измерение физических величин 7 класс Автокөліктерді жөндеу технологиясы
Автокөліктерді жөндеу технологиясы Нефть, газ, их состав и физические свойства. Основные гипотезы происхождения нефти и газа
Нефть, газ, их состав и физические свойства. Основные гипотезы происхождения нефти и газа Электротехника и электроника. Трехфазные электрические цепи. (Лекция 8)
Электротехника и электроника. Трехфазные электрические цепи. (Лекция 8) Электрическое поле. Напряжённость электрического поля
Электрическое поле. Напряжённость электрического поля История создания швейной машинки
История создания швейной машинки Группы и определения эксплуатационных свойств
Группы и определения эксплуатационных свойств Поверхностное натяжение жидкости. Поверхностная энергия. Коэффициент поверхностного натяжения
Поверхностное натяжение жидкости. Поверхностная энергия. Коэффициент поверхностного натяжения Базові шасі техніки зв’язку. Особливості будови автомобіля КРАЗ
Базові шасі техніки зв’язку. Особливості будови автомобіля КРАЗ Зеркальные антенны. Лекция №18. АФУ
Зеркальные антенны. Лекция №18. АФУ