Содержание
- 2. Модель атома Опыт Резерфорда Квантовая физика Слово атом означает неделимый. Но так ли в действительности? То,
- 3. Модель атома Томсона Первую модель атома предложил Дж.Дж.Томсон. Он предположил, что отрицательные электроны находится внутри положительно
- 4. Модель атома Томсона Количество атомов совпадало с положительным зарядом шара. Так, что в целом шар оставался
- 5. Опыт Резерфорда Ученик Дж.Томсона Эрнест Резерфорд воспользовался альфа-частицами как снарядами для бомбардировки атомов различных веществ. Опыты
- 6. Свойства радиоактивных излучений
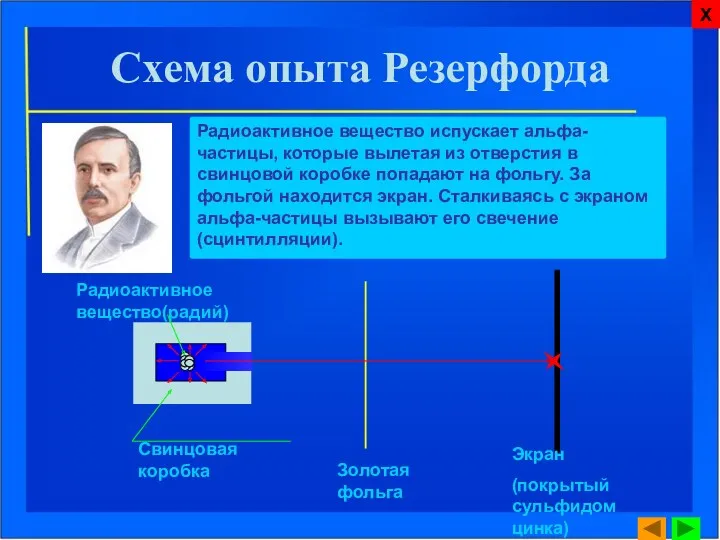
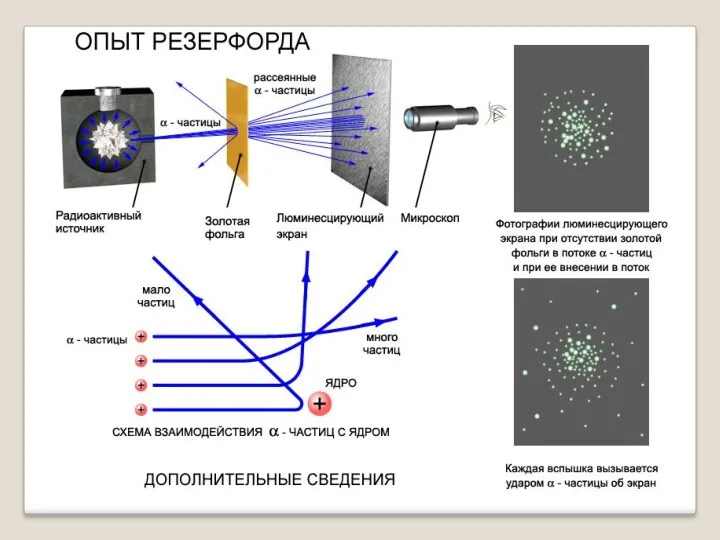
- 7. Схема опыта Резерфорда Свинцовая коробка Золотая фольга Экран (покрытый сульфидом цинка) Радиоактивное вещество(радий) Радиоактивное вещество испускает
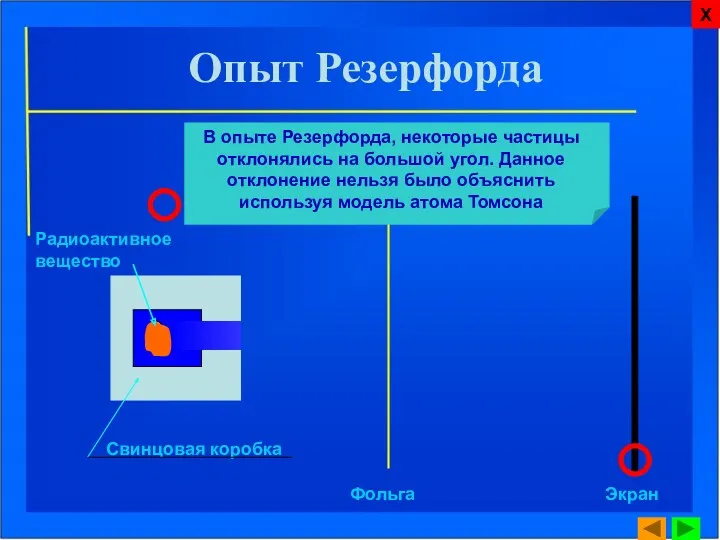
- 8. Свинцовая коробка Фольга Экран Радиоактивное вещество В опыте Резерфорда, некоторые частицы отклонялись на большой угол. Данное
- 10. Предполагаемый результат исходя из модели атома по Томсону Если рассматривать атом исходя их модели атома по
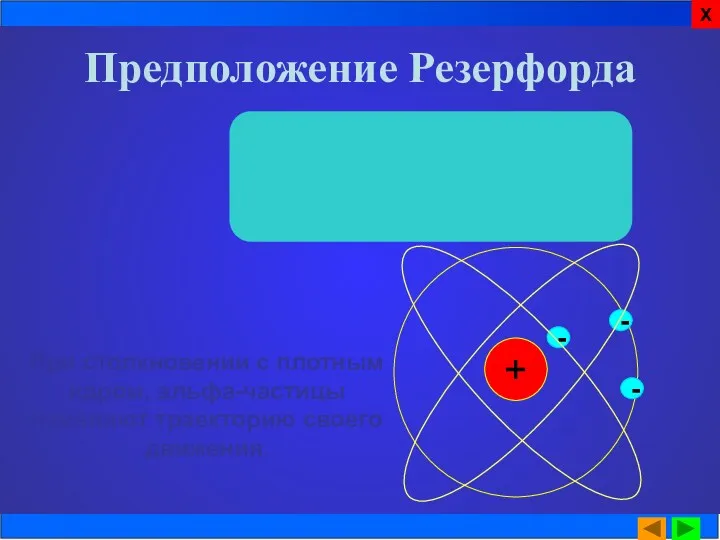
- 11. Предположение Резерфорда Резерфорд объяснил наблюдаемое явление. По его предположению основная масса атома заключена в малой области
- 12. + - При столкновении с плотным ядром, альфа-частицы изменяют траекторию своего движения. Предположение Резерфорда - -
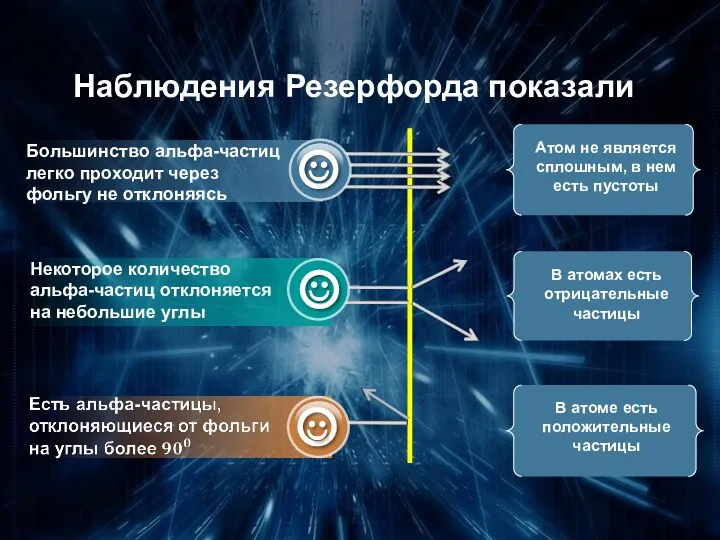
- 13. Наблюдения Резерфорда показали
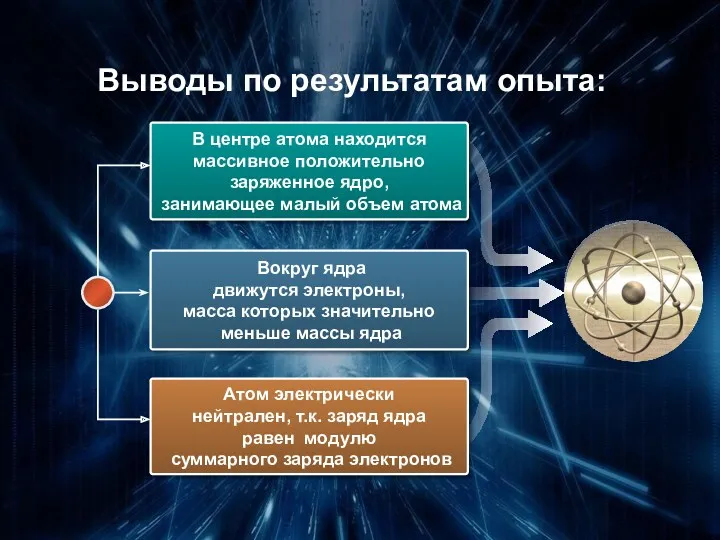
- 14. Выводы по результатам опыта: В центре атома находится массивное положительно заряженное ядро, занимающее малый объем атома
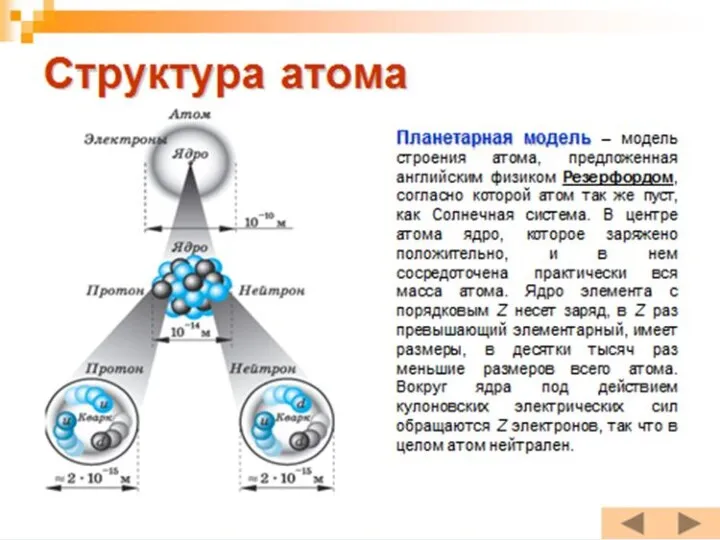
- 15. Атом по Резерфорду Из-за некоторого сходства с Солнечной системой, модель атома по Резерфорду назвали планетарной моделью.
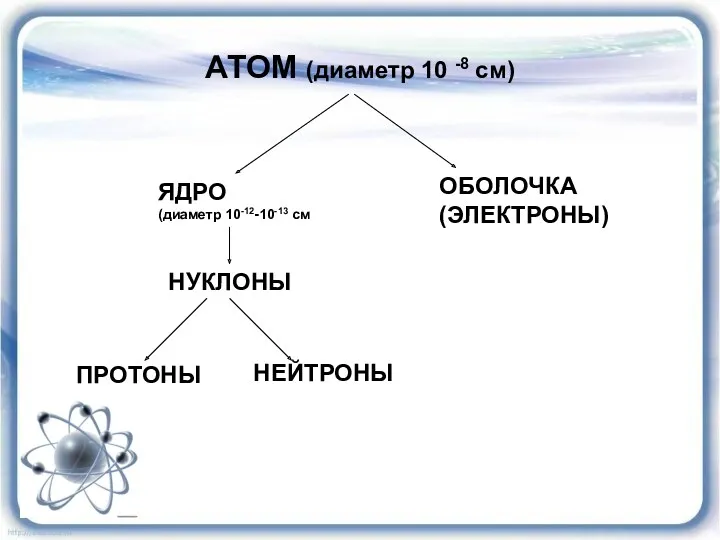
- 17. АТОМ (диаметр 10 -8 см) ЯДРО (диаметр 10-12-10-13 см ОБОЛОЧКА (ЭЛЕКТРОНЫ) НУКЛОНЫ ПРОТОНЫ НЕЙТРОНЫ
- 19. Итог В начале ХХ века были рассмотрены две модели атомов. Первая модель была разработана Дж.Томсоном и
- 20. Итог В начале ХХ века были рассмотрены две модели атомов. Первая модель была разработана Дж.Томсоном и
- 21. Итог Исходя из планетарной модели атома: Большая часть массы атома сосредоточена в ядре. Линейный размер ядра
- 22. Итог Из двух представленных моделей для дальнейшего разбора и изучения выберем планетарную модель Резерфорда как наиболее
- 23. Недостатки атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся
- 24. Нильс Бор 1913 год Квантовая теория атома
- 25. I ПОСТУЛАТ БОРА Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых
- 26. II ПОСТУЛАТ БОРА При переходе атома из стационарного состояния с большей энергией En в стационарное состояние
- 27. Энергетический уровень – каждое значение энергии, которой обладает атом в том или ином стационарном состоянии. Чем
- 28. Когда атом переходит с более высокого на более низкий уровень, то происходит ИЗЛУЧЕНИЕ (ИСПУСКАНИЕ) кванта света
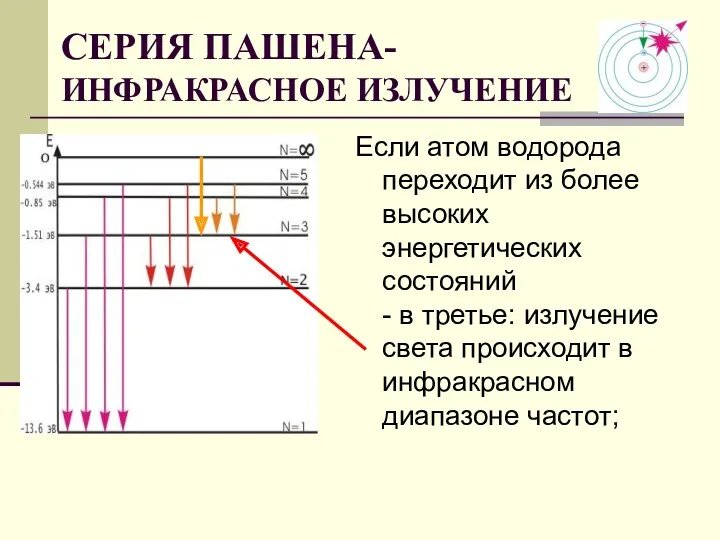
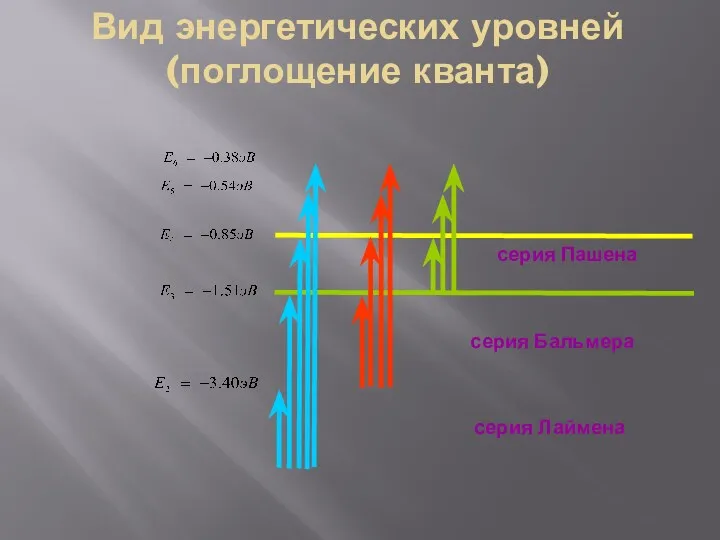
- 29. Если атом водорода переходит из более высоких энергетических состояний - в третье: излучение света происходит в
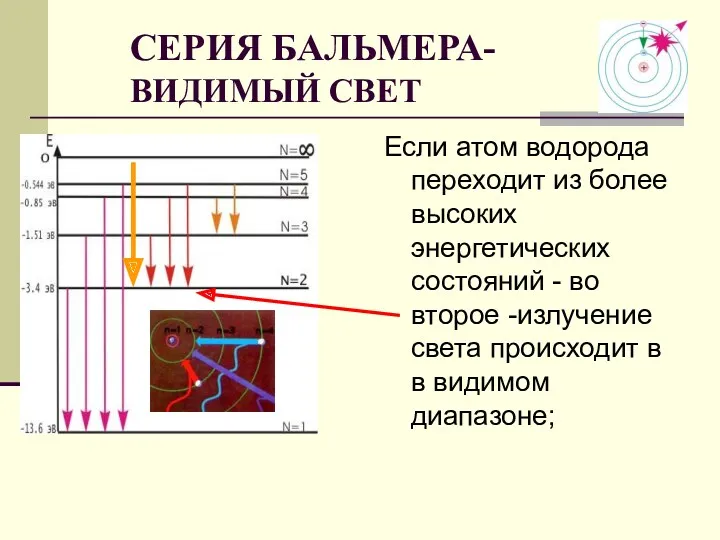
- 30. Если атом водорода переходит из более высоких энергетических состояний - во второе -излучение света происходит в
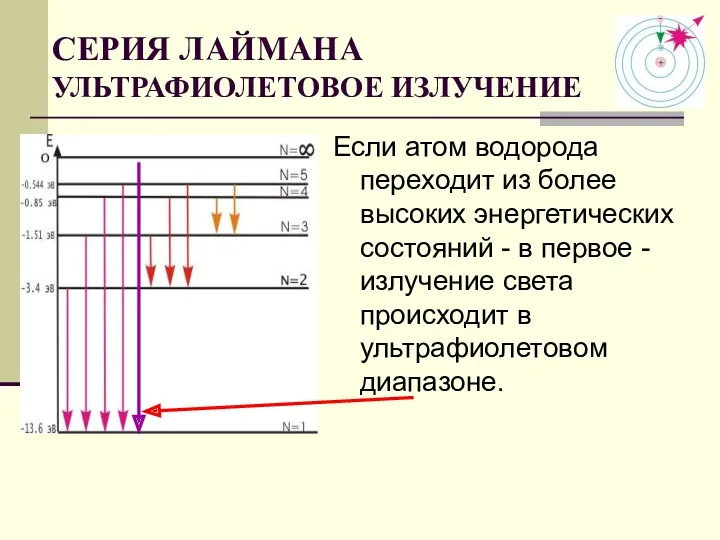
- 31. СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ Если атом водорода переходит из более высоких энергетических состояний - в первое
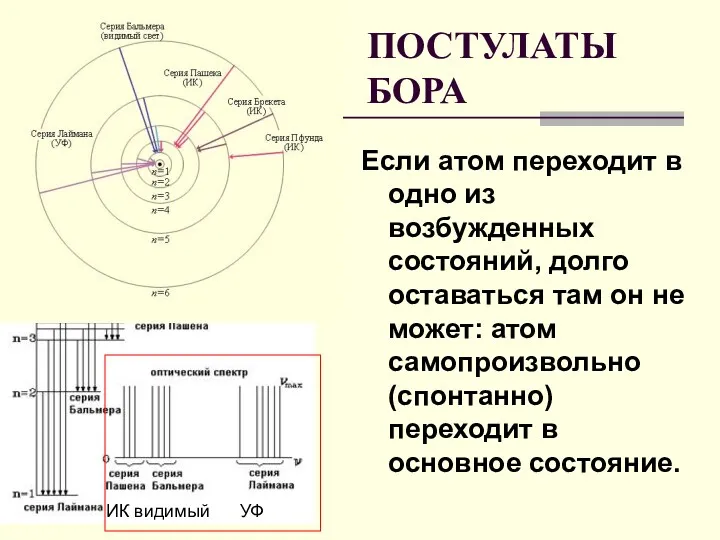
- 32. Если атом переходит в одно из возбужденных состояний, долго оставаться там он не может: атом самопроизвольно
- 33. Вид энергетических уровней (поглощение кванта)
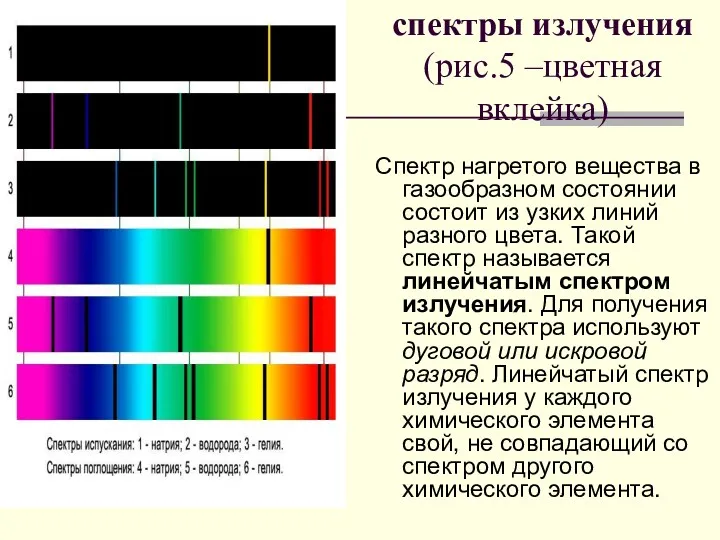
- 34. спектры излучения (рис.5 –цветная вклейка) Спектр нагретого вещества в газообразном состоянии состоит из узких линий разного
- 35. СПЕКТРЫ ИСПУСКАНИЯ СПЕКТРЫ ПОГЛОЩЕНИЯ 1-сплошной 2-натрия 3-водорода 4-гелия 5-солнечный 6-натрия 7-водорода 8-гелия
- 36. Свои постулаты Бор применил для объяснения излучения и поглощения света атомом водорода.
- 38. Скачать презентацию





















 Презентация по физике Оптические иллюзии
Презентация по физике Оптические иллюзии Законы отражения
Законы отражения Ядерные реакции
Ядерные реакции Механические волны. Виды волн
Механические волны. Виды волн Ығысу Тогы. Максвелдің екінші теңдеуі
Ығысу Тогы. Максвелдің екінші теңдеуі Механика. Движение абсолютно твердого тела. Лекция 7
Механика. Движение абсолютно твердого тела. Лекция 7 Работа по перемещению проводника с током в магнитном поле
Работа по перемещению проводника с током в магнитном поле Динамика поступательного движения. Законы сохранения
Динамика поступательного движения. Законы сохранения Плавание тел в жидкости
Плавание тел в жидкости Специальные вопросы электроснабжения. Изоляция и перенапряжения
Специальные вопросы электроснабжения. Изоляция и перенапряжения Механическое движение. Плотность вещества. 7 класс
Механическое движение. Плотность вещества. 7 класс Жылуалмасу теориясының негізгі ережелері. Жылудың жылуөткізгіштікпен берілуі
Жылуалмасу теориясының негізгі ережелері. Жылудың жылуөткізгіштікпен берілуі Звук и его характеристики.
Звук и его характеристики. Общая химия. Химическая термодинамика. Первый закон термодинамики. Термохимия
Общая химия. Химическая термодинамика. Первый закон термодинамики. Термохимия Заклёпочные соединения
Заклёпочные соединения Циклы теплосиловых установок. Термодинамическая эффективность циклов теплосиловых установок. (Занятие 7)
Циклы теплосиловых установок. Термодинамическая эффективность циклов теплосиловых установок. (Занятие 7) Качер Бровина
Качер Бровина Генератор переменного тока
Генератор переменного тока Основные понятия и определения в электротехнике
Основные понятия и определения в электротехнике Особенности ядерных реакций
Особенности ядерных реакций урок-игра по физике по теме Плотность
урок-игра по физике по теме Плотность План-конспект урока по физике по теме Сила 7 класс
План-конспект урока по физике по теме Сила 7 класс Работа и мощность электрического поля. Закон Джоуля - Ленца
Работа и мощность электрического поля. Закон Джоуля - Ленца Тербелістер мен толқындар
Тербелістер мен толқындар Испарение и конденсация
Испарение и конденсация Управление нефтегазовыми технологическими процессами
Управление нефтегазовыми технологическими процессами Механическое движение. Плотность вещества
Механическое движение. Плотность вещества Сила трения
Сила трения