Содержание
- 2. Изучает физические свойства и агрегатные состояния тел в зависимости от их молекуляр-ного строения, сил взаимодейст-вия между
- 3. МЕТОДЫ основан на опыте; состоит в изучении свойств тел путем анализа условий и количественных соотноше-ний превращения
- 4. P, V, T – термодинамические параметры
- 5. Атомная масса Атомная единица массы (а.е.м.) - это 1/12 массы атома изотопа углерода . Относительная атомная
- 6. Количество вещества 1 моль — это количество вещества, в котором содержится столько же атомов, сколько их
- 7. Молярная масса Молярная масса М - это масса одного моля вещества в граммах. Молярная масса равна
- 8. Состояния и процессы Состояние характеризуется набором ТД-параметров. Если все параметры имеют определенные значения, состояние равновесное. Процесс
- 9. ИДЕАЛЬНЫЙ ГАЗ Размеры молекул пренебрежи-мо малы; Молекулы не взаимодействуют; Столкновения – упругие.
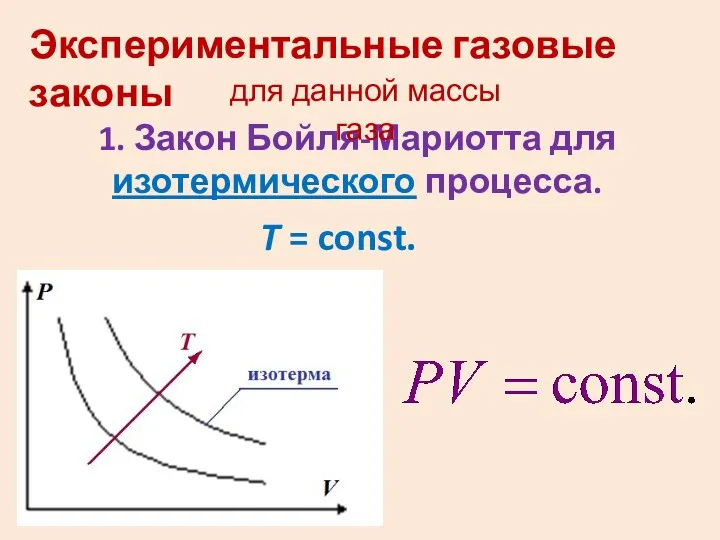
- 10. Экспериментальные газовые законы 1. Закон Бойля-Мариотта для изотермического процесса. T = const. для данной массы газа
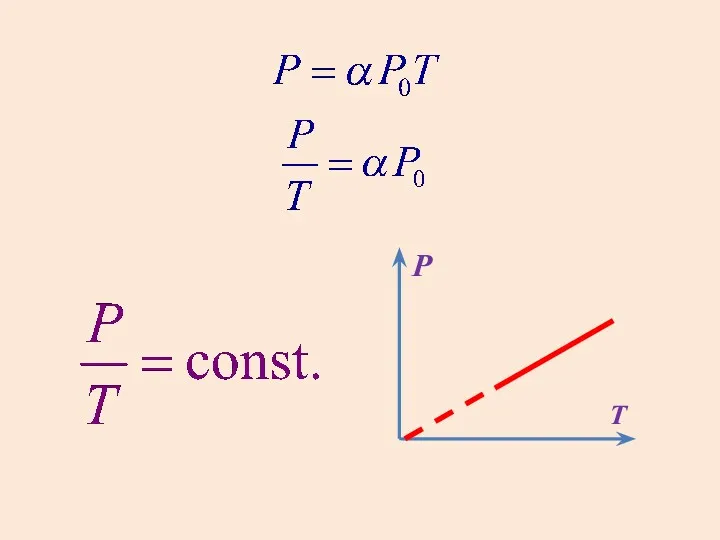
- 11. 2. Закон Шарля для изохорного процесса. Т – абсолютная температура
- 12. P T
- 13. 3. Закон Гей-Люссака для изобарного процесса. T V
- 14. 4. Закон Авогадро 1 киломоль любого газа занимает при одинаковых условиях одинаковый объем. При нормальных условиях
- 15. 5. Закон Дальтона Давление смеси газов равно сумме парциальных давлений. парциальные давления (каждого газа в отдельности)
- 16. Уравнение состояния газа
- 17. Для одного моля газа R - универсальная газовая постоянная Для ν молей газа
- 18. Уравнение Менделеева — Клапейрона
- 19. - концентрация молекул - постоянная Больцмана Другая запись уравнения М-К:
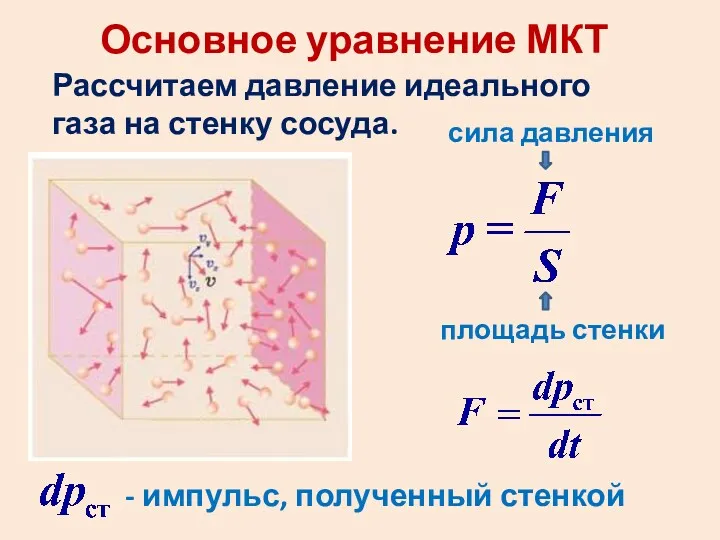
- 20. Основное уравнение МКТ Рассчитаем давление идеального газа на стенку сосуда. сила давления площадь стенки - импульс,
- 21. У куба 6 граней. Пусть к каждой грани движется 1/6 часть всех молекул со средней скоростью
- 22. По закону сохранения импульса: Изменение импульса одной молекулы:
- 23. За время dt со стенкой S столкнутся N молекул – те, что в объеме dV и
- 24. Получим итоговую формулу для давления:
- 25. - средняя кинетическая энергия поступательного движения молекул Основное уравнение МКТ: Умножим и поделим на 2:
- 26. Абсолютная температура идеального газа - это величина, прямо пропорциональная средней кинетической энергии поступательного движения его молекул.
- 27. Средняя квадратичная скорость молекул
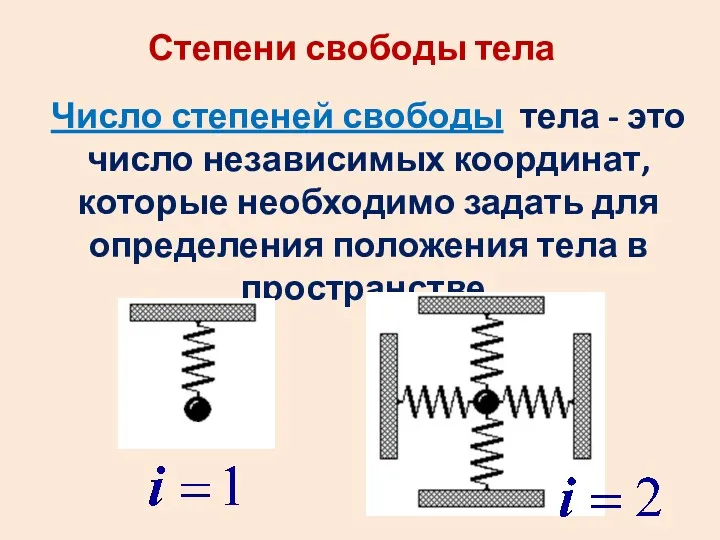
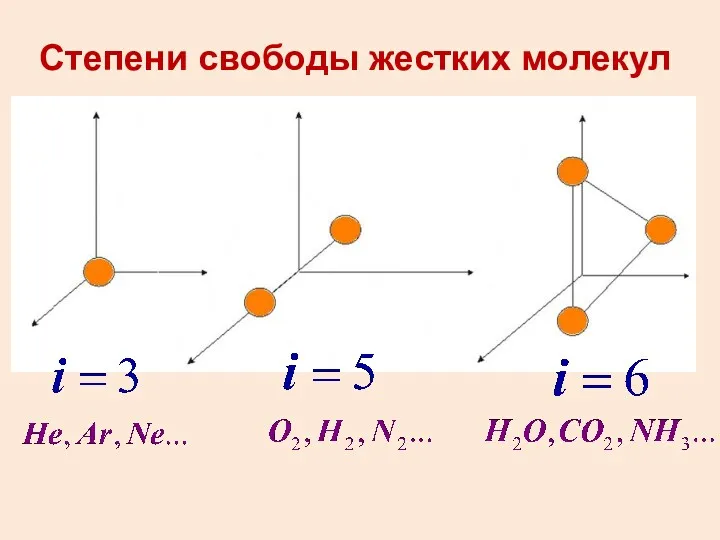
- 29. Степени свободы тела Число степеней свободы тела - это число независимых координат, которые необходимо задать для
- 30. Степени свободы жестких молекул
- 31. На одну степень свободы приходится энергия Распределение энергии по степеням свободы
- 32. Энергия многоатомной молекулы
- 34. Скачать презентацию


























 Материаловедение. Электромагнитные и теплофизические свойства материалов
Материаловедение. Электромагнитные и теплофизические свойства материалов Закон всемирного тяготения
Закон всемирного тяготения Презентация к уроку Квантовые постулаты Бора, 11 класс
Презентация к уроку Квантовые постулаты Бора, 11 класс Динамика вращательного движения твердого тела. Лекция 5
Динамика вращательного движения твердого тела. Лекция 5 Конспект лекций по курсу Лазерные измерительные системы
Конспект лекций по курсу Лазерные измерительные системы Изучение основ электричества и магнетизма
Изучение основ электричества и магнетизма Демонстрационный эксперимент по физике
Демонстрационный эксперимент по физике Квантовая физика
Квантовая физика Виды реактивных двигателей
Виды реактивных двигателей Структура пограничного слоя при продольном обтекании сотовой поверхности
Структура пограничного слоя при продольном обтекании сотовой поверхности Работа, теплота, первое начало в термодинамике. (Лекция 6)
Работа, теплота, первое начало в термодинамике. (Лекция 6) Радиометр радона и его дочерних продуктов распада РАМОН-02
Радиометр радона и его дочерних продуктов распада РАМОН-02 урок физики в 10 классе Теплопередача. Количество теплоты
урок физики в 10 классе Теплопередача. Количество теплоты Решение задач Закон Ома для участка цепи, последовательное и параллельное соединение проводников
Решение задач Закон Ома для участка цепи, последовательное и параллельное соединение проводников Механика твердого тела. Динамика вращений
Механика твердого тела. Динамика вращений Методическое пособие по теме Геометрическая оптика
Методическое пособие по теме Геометрическая оптика ОГЭ - 2016. Физика.
ОГЭ - 2016. Физика. к уроку физики Основные единицы измерения системы СИ
к уроку физики Основные единицы измерения системы СИ Простая физика сложных явлений
Простая физика сложных явлений Теория симметричного вибратора
Теория симметричного вибратора Вводный урок по физике в 7 классе.
Вводный урок по физике в 7 классе. Теорема Гаусса для диэлектриков
Теорема Гаусса для диэлектриков Явление диффузии в жидкостях
Явление диффузии в жидкостях Основы электростатики. (Лекция 7)
Основы электростатики. (Лекция 7) Оптоэлектроника
Оптоэлектроника Настоящее и будущее магнитов и ферромагнитной жидкости
Настоящее и будущее магнитов и ферромагнитной жидкости Движение в неинерциальной системе отсчета
Движение в неинерциальной системе отсчета Решение задач по физике. Подготовка к проверочной работе. 7 класс
Решение задач по физике. Подготовка к проверочной работе. 7 класс