Содержание
- 3. учение, которое объясняет строение и свойства тел движением и взаимодействием частиц, из которых состоят тела. Молекулярно-кинетическая
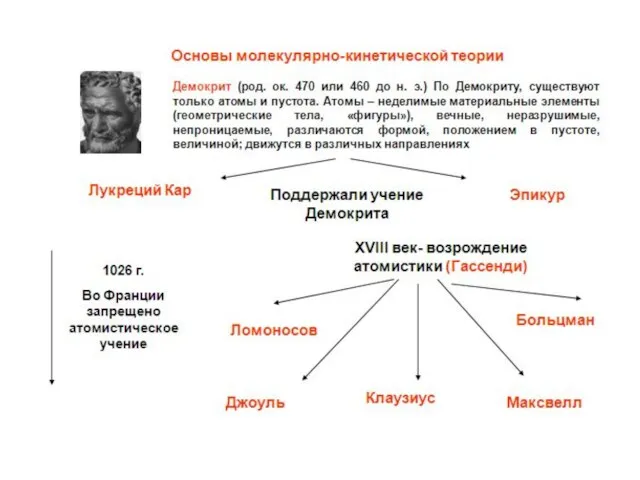
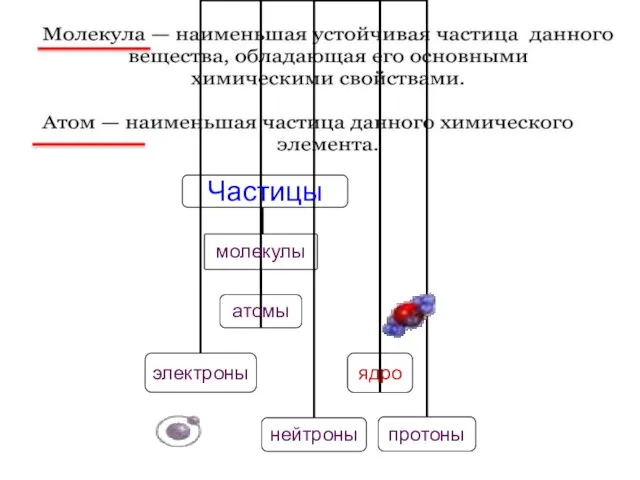
- 4. Фундаментом МКТ является атомистическая гипотеза: все тела в природе состоят из мельчайших структурных единиц – атомов
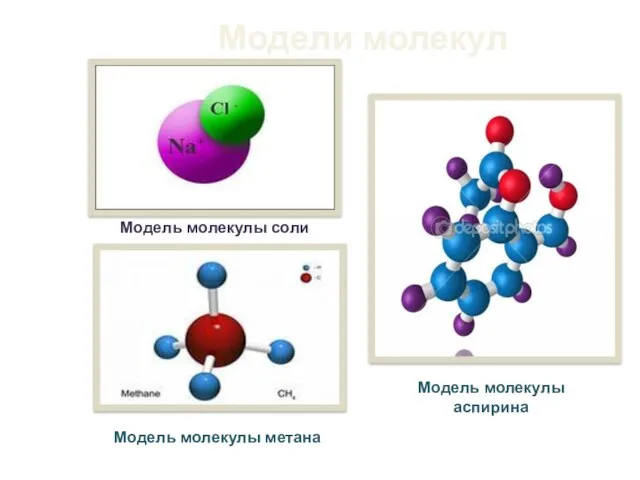
- 6. Модели молекул Модель молекулы аспирина Модель молекулы соли Модель молекулы метана
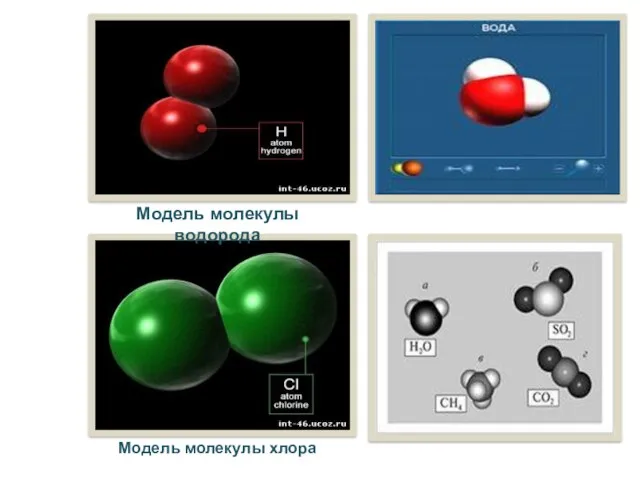
- 7. Модель молекулы водорода Модель молекулы хлора Модель молекулы воды
- 8. Основные положения МКТ: 1. все тела состоят из молекул, между которыми есть промежутки; 2. частицы вещества
- 9. Косвенные доказательства: дробление вещества Испарение расширение и сжатие при изменении температуры или деформации диффузия Прямые доказательства:
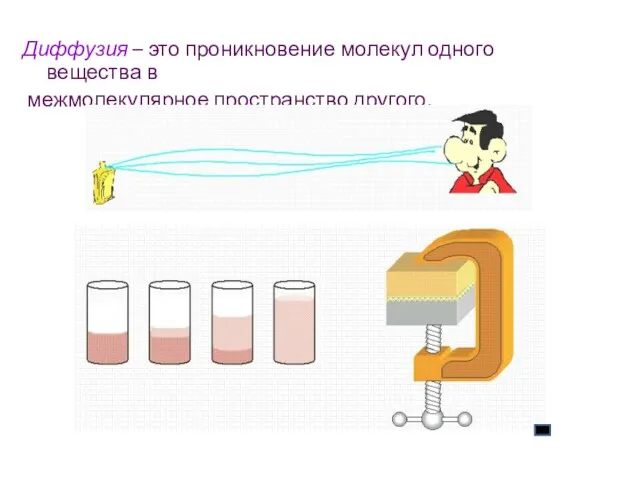
- 10. Диффузия – это проникновение молекул одного вещества в межмолекулярное пространство другого.
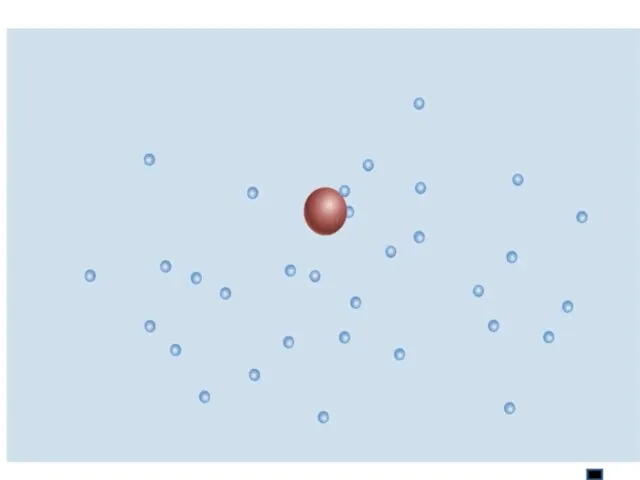
- 11. Причина: удары молекул жидкости о частицу не компенсируют друг друга Характер движения зависит от вида жидкости,
- 13. Оценка размеров молекул
- 14. Число молекул Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно объемом 1
- 15. Масса молекулы Вычислим массу одной молекулы воды. В 1 г воды содержится 3,7·1022 молекул.
- 16. Относительная молекулярная масса Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома)
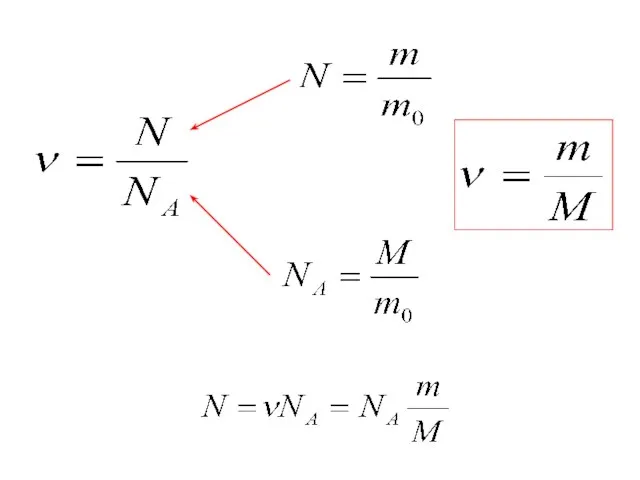
- 17. Постоянная Авогадро Один моль – это количество вещества, в котором содержится столько же молекул или атомов,
- 18. Количество вещества ν равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.
- 19. Молярная масса Молярной массой М вещества называют массу вещества, взятого в количестве 1 моль. M =
- 22. Скачать презентацию












 Тепловые машины
Тепловые машины Общее устройство автомобилей
Общее устройство автомобилей Технічні дані тепловозів
Технічні дані тепловозів Задачи. 11 класс
Задачи. 11 класс Управляемый термоядерный синтез (УТС)
Управляемый термоядерный синтез (УТС) Магнітне поле струму. Правило свердлика
Магнітне поле струму. Правило свердлика Покорение Силы
Покорение Силы Создание телефона
Создание телефона Механические свойства твердых тел
Механические свойства твердых тел экологическое воспитание на уроках физики
экологическое воспитание на уроках физики Физические методы измерений. Виды и методы измерений. (Лекция 1)
Физические методы измерений. Виды и методы измерений. (Лекция 1) Характеристики датчиков
Характеристики датчиков Принципы измерения координат
Принципы измерения координат Электрический ток в полупроводниках
Электрический ток в полупроводниках Дополнительный материал по физике для 8 класса.
Дополнительный материал по физике для 8 класса. методическая разработка раздела курса физики 7 класса Давление
методическая разработка раздела курса физики 7 класса Давление Биоэлектромагнетизм. Основы электрокардиографии и реографии
Биоэлектромагнетизм. Основы электрокардиографии и реографии Биполярный насыщенный ключ с динамической нагрузкой. Цифровые ключи на полевых транзисторах
Биполярный насыщенный ключ с динамической нагрузкой. Цифровые ключи на полевых транзисторах Монтаж заземляющих устройств
Монтаж заземляющих устройств Магнитное поле. Сила Лоренца
Магнитное поле. Сила Лоренца Презентация к уроку по теме Механическое движение
Презентация к уроку по теме Механическое движение Линзы. Урок 62. Изображения, даваемые линзой
Линзы. Урок 62. Изображения, даваемые линзой Законы Ньютона. Решение задач
Законы Ньютона. Решение задач Организация зоны технического обслуживания и ремонта АТП ИП Дедов по восстановлению коленчатого вала автомобилей ЗИЛ 130
Организация зоны технического обслуживания и ремонта АТП ИП Дедов по восстановлению коленчатого вала автомобилей ЗИЛ 130 атомы
атомы Модернизация рабочих мест участка по регулировке и установке углов управляемых колес для обслуживания легковых автомобилей
Модернизация рабочих мест участка по регулировке и установке углов управляемых колес для обслуживания легковых автомобилей Схема работы акустической системы
Схема работы акустической системы Импульс тела. Закон сохранения импульса. Реактивное движение
Импульс тела. Закон сохранения импульса. Реактивное движение