Содержание
- 2. Вопросы: 1. Скорость технологического процесса. 2. Движущая сила процесса. 3. Способы увеличения скорости процесса.
- 3. Основными объектами, изучаемыми в химической технологии являются равновесие и скорость процессов, которые сильно различаются в гомогенных
- 4. Видно, что количество продукта возрастает Y(τ) по логарифмической кривой, а υ((τ) уменьшается. При некотором значении υn
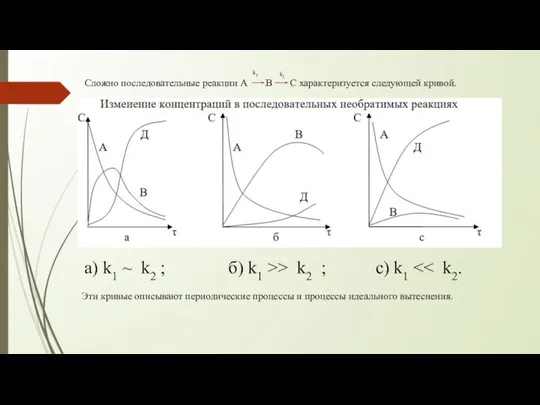
- 6. Сложно последовательные реакции А В С характеризуется следующей кривой. k1 k2 а) k1 ~ k2 ;
- 7. В проточном реакторе: где Н - высота ω - линейная скорость υ - реакционный объем Vc
- 8. Определяющими величинами в уравнении скорости процесса могут быть константа скорости k, движущая сила процесса ∆С, величина
- 9. Константа скорости k - является сложной величиной, зависящей не только от химических свойств, реагирующих веществ, но
- 10. Для гомогенных реакций ΔС определяется по закону действия масс как произведения концентраций, реагирующих веществ в данный
- 12. Как видно из рис. концентрация реагирующих веществ измеряется по логарифмическим кривым, соответственно ΔСср. вычисляется как средняя
- 14. 3. Способы увеличения скорости процесса. Для повышения скорости процесса следует найти способы увеличения определяющих величин ΔС,
- 15. Влияние давления на скорость газовых реакций различного порядка Зависимость скорости от давления для реакций идущих с
- 16. в) Регулирование температуры процесса. При абсорбции, адсорбции, конденсации ΔС = С - С*, понижая Т жидкой
- 17. Влияние температуры на скорость процессов в диффузионной области меньше, чем в кинетической. Температурная зависимость коэффициента диффузии
- 18. Для процессов идеального смешения и близких к ним массопередача осуществляется не молекулярной, а турбулентной диффузией, которая
- 19. в)Перемешивание увеличивает коэффициент массопередачи или k скорости, т.к. позволяет заменить молекулярную диффузию конвективной. Целесообразно применять для
- 20. б) Г - Т и Ж - Т необходимо всегда измельчение твердого вещества или применение пористых
- 22. Скачать презентацию


















 Урок физике в 7 классе Решение задач на расчёт механической работы и мощности
Урок физике в 7 классе Решение задач на расчёт механической работы и мощности Истечение жидкости через отверстия и насадки
Истечение жидкости через отверстия и насадки урок-игра по физике по теме Плотность
урок-игра по физике по теме Плотность Сила трения. Тест
Сила трения. Тест Взаимодействие тел. Масса
Взаимодействие тел. Масса Лекция №6 (6 ). Поле системы элементарных излучателей
Лекция №6 (6 ). Поле системы элементарных излучателей Термоядерная реакция
Термоядерная реакция Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем
Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем Повторение курса физики. 8 класс
Повторение курса физики. 8 класс Анализ эксплуатационной надежности бурового вертлюга ВБ-80М
Анализ эксплуатационной надежности бурового вертлюга ВБ-80М Открытие электромагнитных колебаний. 11 класс
Открытие электромагнитных колебаний. 11 класс Точність обробки. (Лекция 3)
Точність обробки. (Лекция 3) Закон Кулона. Электрическое поле
Закон Кулона. Электрическое поле Молекулярная физика. Атом
Молекулярная физика. Атом Явление электромагнитной индукции
Явление электромагнитной индукции Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Цифровые сигналы
Цифровые сигналы МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР
МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР Электромагнитные явления. Своя игра
Электромагнитные явления. Своя игра Аэродинамические весы
Аэродинамические весы Движение под действием силы тяжести. Решение задач
Движение под действием силы тяжести. Решение задач Динамика вязкой жидкости
Динамика вязкой жидкости Расчеты на прочность при изгибе
Расчеты на прочность при изгибе Реактивное движение. Ракеты
Реактивное движение. Ракеты Соединения деталей. Виды изделий. Резьбовые соединения
Соединения деталей. Виды изделий. Резьбовые соединения Создание источника электричества из овощей и фруктов
Создание источника электричества из овощей и фруктов Момент инерции. Теорема Штейнера. Кинетическая энергия вращательного движения твердого тела. (Лекция 5)
Момент инерции. Теорема Штейнера. Кинетическая энергия вращательного движения твердого тела. (Лекция 5) Закон сохранения энергии в тепловых процессах.
Закон сохранения энергии в тепловых процессах.