Содержание
- 2. План 1. Классификация оптических методов анализа. 2. Молекулярный спектральный анализ УВИ области спектра. 3. Основной закон
- 3. 1. Классификация оптических методов анализа. К оптическим методам анализа относят физико-химические методы, основанные на взаимодействии электромагнитного
- 4. Оптические методы классифицируются: 1) по изучаемым объектам – атомный и молекулярный спектральный анализ; 2) по характеру
- 5. 3) по области используемого электромагнитного спектра: а) спектроскопия в УФ области в интервале длин волн 200-400
- 6. Суть оптического метода основывается на взаимодействии вещества со средой, а в качестве среды используют электромагнитные волны
- 7. Применяются два общих способа измерения: 1) На глаз 2) Инструментальный метод При взаимодействии вещества с электромагнитными
- 8. Есть методы, основывающиеся на поглощении света веществом. Поглощать свет могут молекулы и ионы. - колориметрия; -
- 9. Эмиссионный метод. - флюорометрия; - люминесцентный метод; Излучать свет могут и отдельные атомы, когда вещество переходит
- 10. Все оптические методы используют специальные приборы источник излучения; фокусирующее устройство; селектор (преобразователь) кювета с изучаемым веществом;
- 11. Источники излучения: пламя горелки; вольтова дуга; лампа накаливания(320-10000); натриевые лампы (λ = 585 нм); водородные и
- 12. Фокусирующее устройство. Селекторы (преобразователь света) преломляющая призма; обычные светофильтры; призмодифракционные решетки. Кюветы (например, держатели для вещества)
- 13. Усилитель сигнала. Регистратор и анализатор: - микроамперметр - вольтметр - самописцы - компьютеры с анализаторами. Характеристика
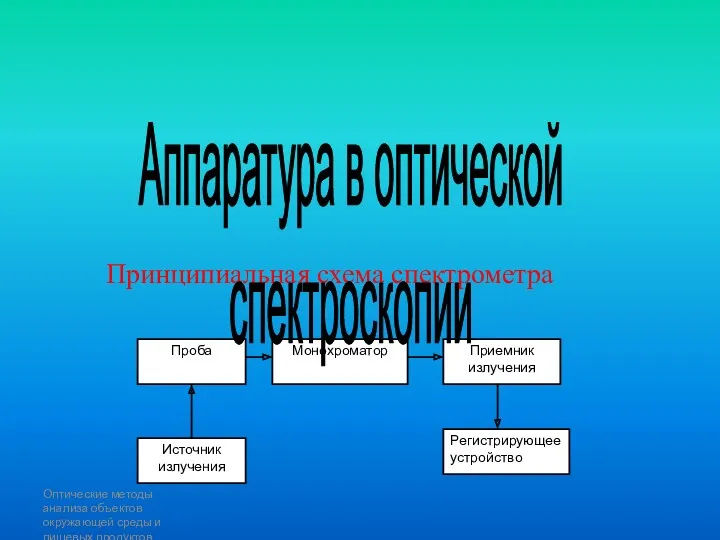
- 14. Оптические методы анализа объектов окружающей среды и пищевых продуктов Принципиальная схема спектрометра Аппаратура в оптической спектроскопии
- 15. 2. Молекулярный спектральный анализ УВИ области спектра. Спектр поглощения вещества в видимой области (400-760 нм) и
- 16. Спектр – (от лат. spectrum – представление) – совокупность различных значений, которые может принимать данная физическая
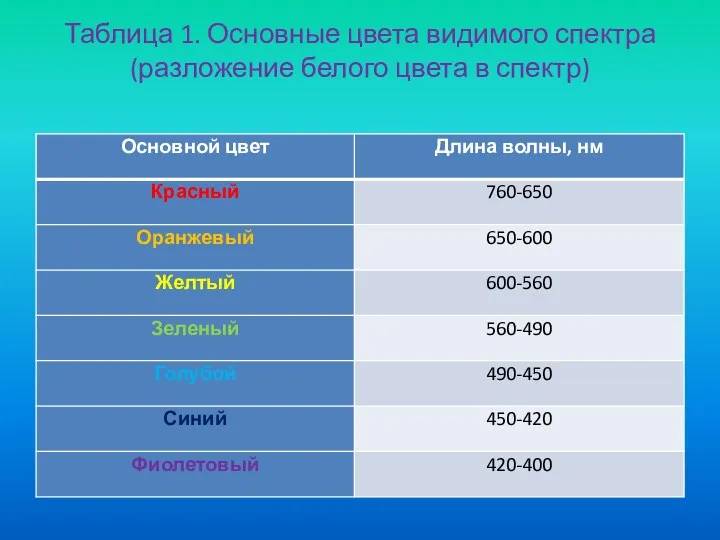
- 17. Таблица 1. Основные цвета видимого спектра (разложение белого цвета в спектр)
- 18. Цвет вещества (прозрачной светопоглощающей среды), через которое проходит свет, обусловлен его поглощением: цвет в-ва всегда является
- 19. Таблица 2.
- 20. Важнейшей характеристикой является количество поглощённой энергии, которая зависит от концентрации вещества. Интенсивность поглощения света веществом зависит
- 21. Молекулярно-абсорбционный спектральный анализ включает спектрофотометрический и фотоколориметрический виды анализа. Спектрофотометрический основан на определении спектра поглощения или
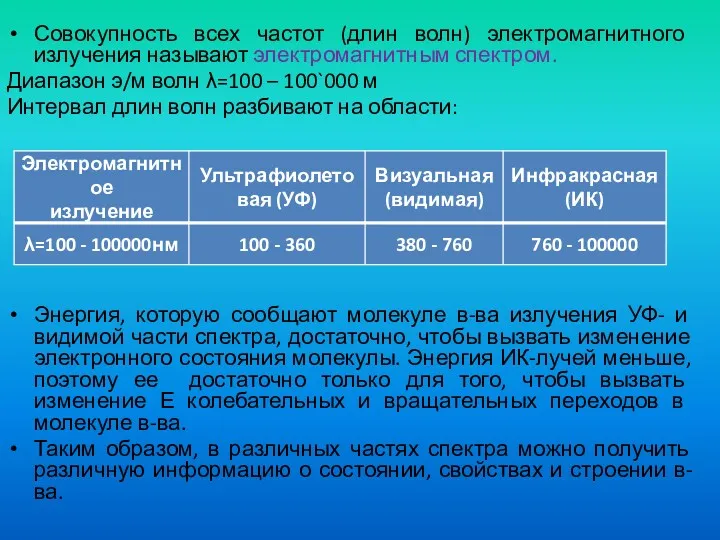
- 22. Совокупность всех частот (длин волн) электромагнитного излучения называют электромагнитным спектром. Диапазон э/м волн λ=100 – 100`000
- 23. 3. Основной закон светопоглощения – закон Бугера (1729), Ламберта (1760) и Бера (1852). В основе фотометрических
- 24. Второй закон (Бугера-Бера) гласит: доля светового потока, поглощенного данным тонким слоем внутри однородной среды, пропорциональна числу
- 25. Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают
- 26. Отношение интенсивность потока монохроматического излучения, прошедшего через исследуемый раствор I, к интенсивности первоначального потока излучения I0
- 27. Причины отклонения от закона Бугера-Ламберта-Бера: 1) при высоких концентрациях уменьшается степень диссоциации и наблюдается ассоциация ионов;
- 28. 4. Фотометрический анализ Фотометрический метод анализа – это анализ, основанный на поглощении света молекулами анализируемого вещества
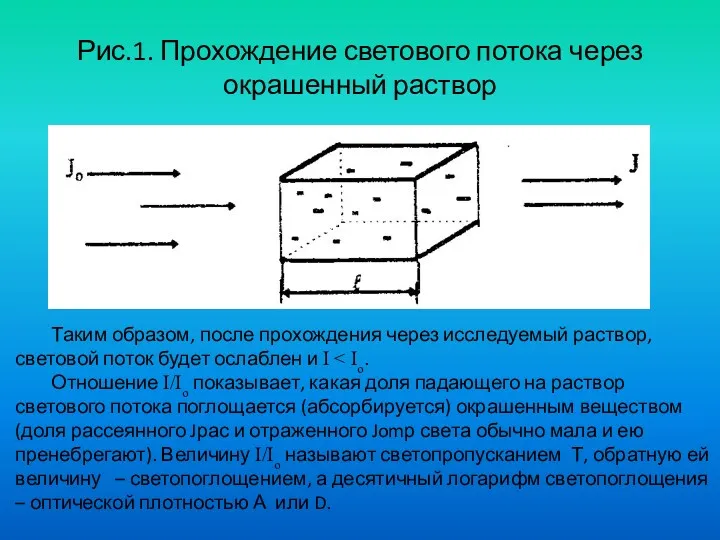
- 29. Рис.1. Прохождение светового потока через окрашенный раствор Таким образом, после прохождения через исследуемый раствор, световой поток
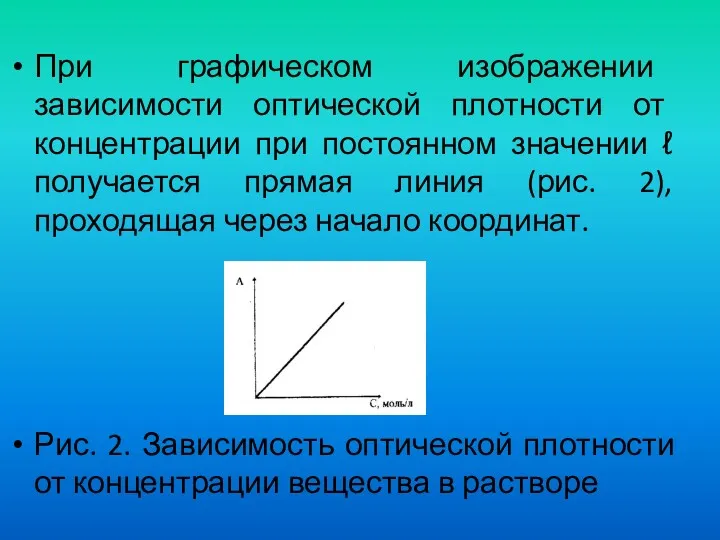
- 31. При графическом изображении зависимости оптической плотности от концентрации при постоянном значении ℓ получается прямая линия (рис.
- 32. В фотометрическом методе анализа используют излучение следующих длин волн:
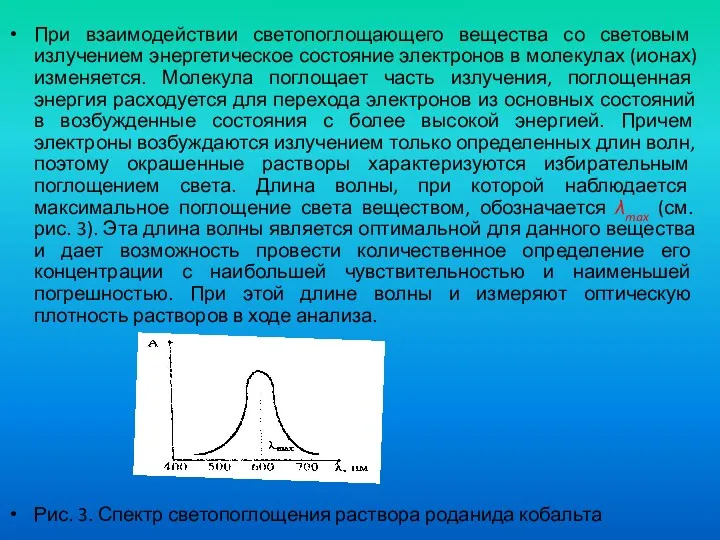
- 33. При взаимодействии светопоглощающего вещества со световым излучением энергетическое состояние электронов в молекулах (ионах) изменяется. Молекула поглощает
- 35. Фотометрический анализ включает следующие методы абсорбционного анализа: колориметрию, фотоэлектроколориметрию, спектрофотометрию. ВИЗУАЛЬНАЯ КОЛОРИМЕТРИЯ Интенсивность окраски растворов можно
- 36. К визуальным методам относятся: — метод стандартных серий; — метод колориметрического титрования, или дублирования; — метод
- 37. Метод уравнивания отличается от описанных выше визуальных колориметрических методов, в которых подобие окрасок стандартного и испытуемого
- 38. Недостатки: — необходимо готовить стандартный раствор или серии стандартных растворов; — невозможно сравнивать интенсивность окраски раствора
- 39. ФОТОЭЛЕКТРОКОЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Фотоэлектроколориметрия применяется для измерения поглощения света или пропускания окрашенными растворами. Приборы, используемые для
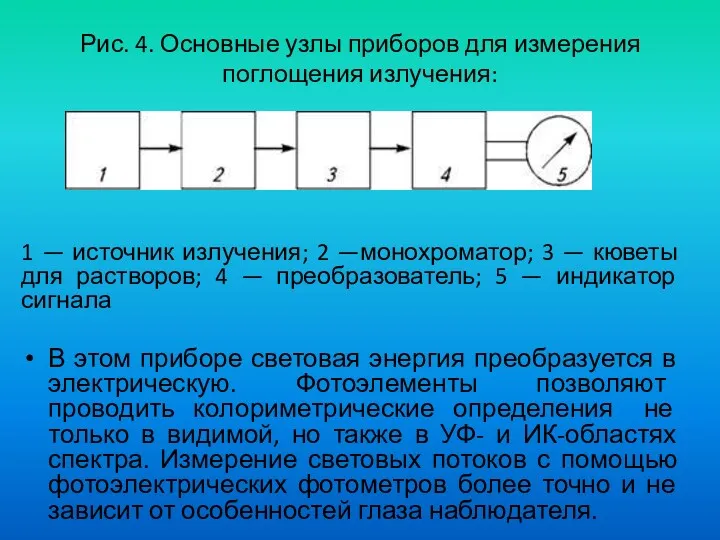
- 40. Рис. 4. Основные узлы приборов для измерения поглощения излучения: 1 — источник излучения; 2 —монохроматор; 3
- 41. Фотоколориметры в зависимости от числа используемых при измерениях фотоэлементов делятся на две группы: однолучевые (одноплечие) —
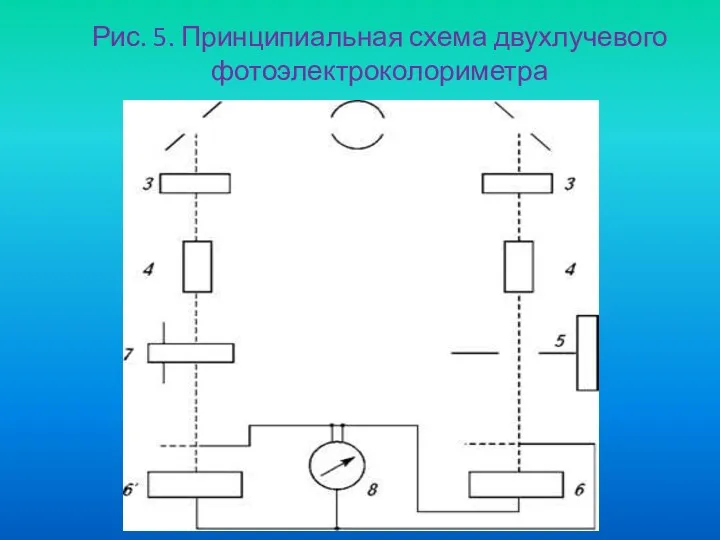
- 42. Рис. 5. Принципиальная схема двухлучевого фотоэлектроколориметра
- 43. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ В ФОТОЭЛЕКТРОКОЛОРИМЕТРИИ Для определения концентрации анализируемого вещества используют следующие методы: молярного коэффициента светопоглощения; сравнения
- 44. Метод сравнения оптических плотностей стандартного и исследуемого окрашенных растворов. Для определения готовят эталонный раствор определяемогo вещества
- 45. Метод определения по среднему значению молярного коэффициента светопоглощения. При работе по этому методу определяют оптическую плотность
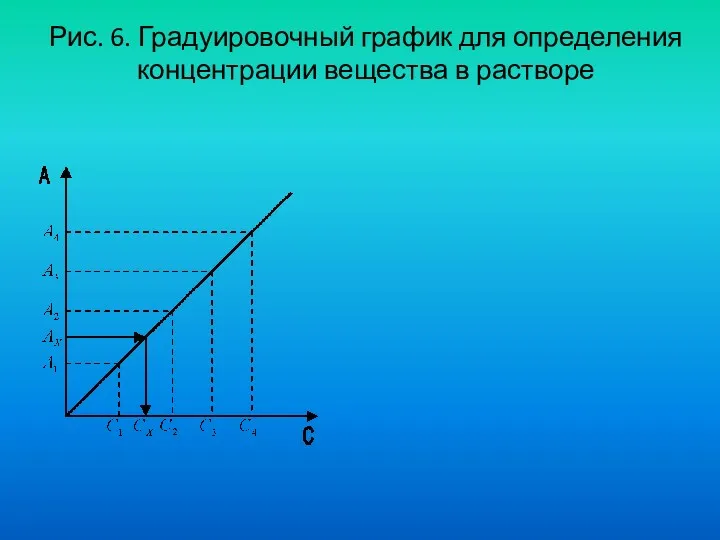
- 46. Метод градуировочного графика. Для определения концентрации вещества этим методом готовят серию из 5-8 стандартных растворов различной
- 47. Рис. 6. Градуировочный график для определения концентрации вещества в растворе
- 48. Метод добавок. Метод добавок — это разновидность метода сравнения, основанный на сравнении оптической плотности исследуемого раствора
- 49. Сущность его заключается в следующем. Сначала определяют оптическую плотность Ах анализируемого раствора, содержащего определяемый компонент неизвестной
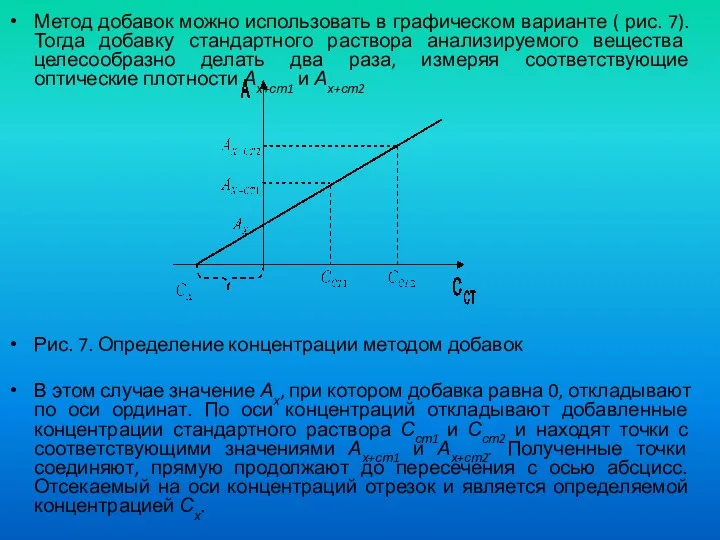
- 50. Метод добавок можно использовать в графическом варианте ( рис. 7). Тогда добавку стандартного раствора анализируемого вещества
- 51. Условия фотометрических определений Для получения оптимальных результатов при фотометрических измерениях предварительно проводят фотометрическую реакцию, подбирают аналитическую
- 52. 2). Выбор концентрации измеряемого раствора и толщины поглощающего слоя. Фотометрические измерения оптимально проводить в интервале измерения
- 53. СПЕКТРОФОТОМЕТРИЯ Это метод фотометрического анализа, в котором определение содержания вещества производят по поглощению им монохроматического света
- 54. Спектрофотометрические методы, по сравнению с фотоколориметрическими, позволяют решать более широкий круг задач: - проводить количественное определение
- 55. Спектрофотометры, как и фотометры, бывают одно- и двулучевые. В двулучевых приборах световой поток каким-либо способом раздваивают
- 56. И одно-, и двулучевые приборы пригодны для измерений видимого и УФ-излучений. В основе ИК-спектрофотометров, выпускаемых промышленностью,
- 57. Фотометрическим методом можно определять также компоненты смеси двух и более веществ. Эти определения основаны на свойстве
- 58. 5. Дифференциальный фотометрический анализ В.Г.Беликов, Е.Н.Вергейчик Дифференциальная спектрофотометрия – это метод измерения светопоглощения анализируемого раствора по
- 59. В аналитической практике наиболее распространен способ измерения А анализируемого раствора по отношению к раствору сравнения, содержащему
- 60. Сущность метода Готовят серию (5-10) эталонных растворов определяемого в-ва с различной , точно заданной концентрацией С0,
- 61. Расчетный способ
- 62. Способ градуировочного графика Для построения градуировочного графика в дифференциально-фотометрическом методе готовят несколько стандартных растворов с концентрациями
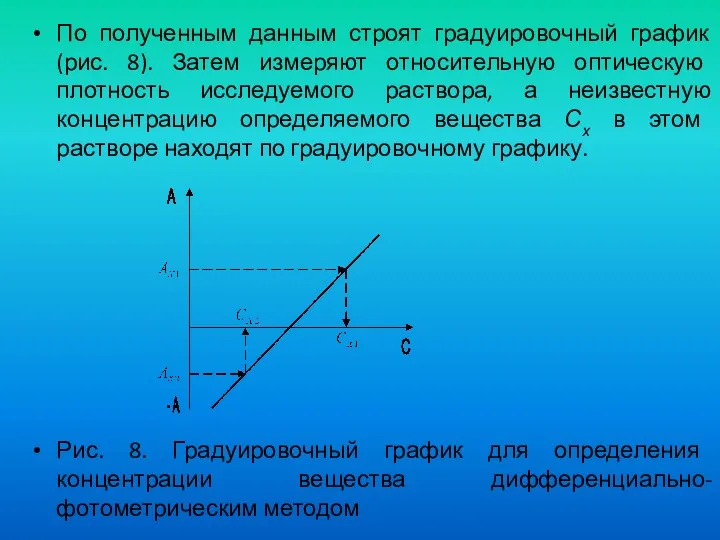
- 63. По полученным данным строят градуировочный график (рис. 8). Затем измеряют относительную оптическую плотность исследуемого раствора, а
- 64. 6. Экстракционно-фотометрический анализ В методе сочетаются экстракция и фотометрия. Определяемое вещество, содержащееся в растворе извлекают из
- 65. Данный метод применяют в следующих случаях: при определении компонента сложной смеси, когда другие присутствующие в смеси
- 66. При использовании метода, необходимо, чтобы степень извлечения определяемого в-ва из исходного раствора экстрагентом была бы количественной,
- 67. В экстрационно-фотометрическом анализе используют 2 типа фотометрических реакций: 1) фотометрические реакции образования окрашенных комплексных соединений металлов.
- 68. 2) фотометрические реакции образования окрашенных ионных ассоциатов. Определяемое в-во переводят в окрашенный продукт, содержащий катионы или
- 69. Например, при экстракционно-фотометрическом определении Sb(v) ее вначале переводят в водном солянокислом р-ре в бесцветный комплексный анион
- 70. Значение метода При экстракции малых количеств веществ происходит не только их выделение, но и концентрирование. Поэтому
- 71. 7. Фотометрическое титрование Метод фотометрического анализа, основанный на определении конца титрования по резкому изменению светопоглощения титруемого
- 72. По результатам измерения светопоглощения титруемого р-ра строят кривую титрования в координатах оптическая плотность А – объем
- 73. Различают 2 варианта фотометрического титрования: титрование без индикатора и с одноцветным или с двухцветным индикатором. Если
- 74. Кривые спектрофотометрического титрования могут быть различной формы. Характер их зависит от того, какие компоненты реакции поглощают
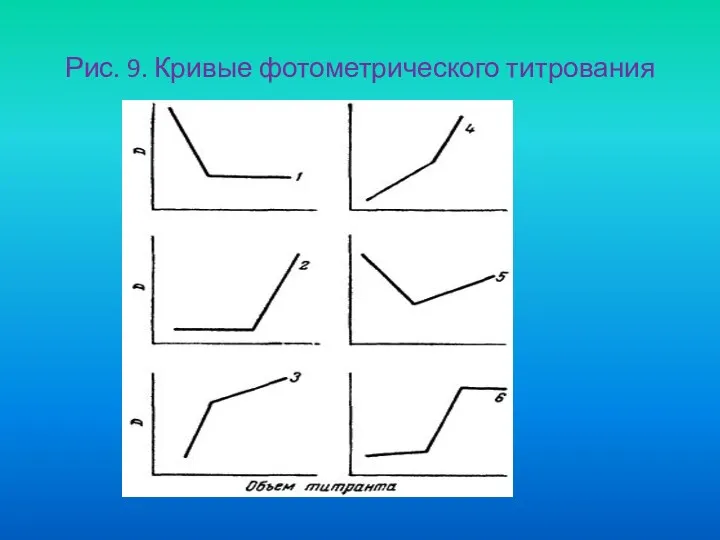
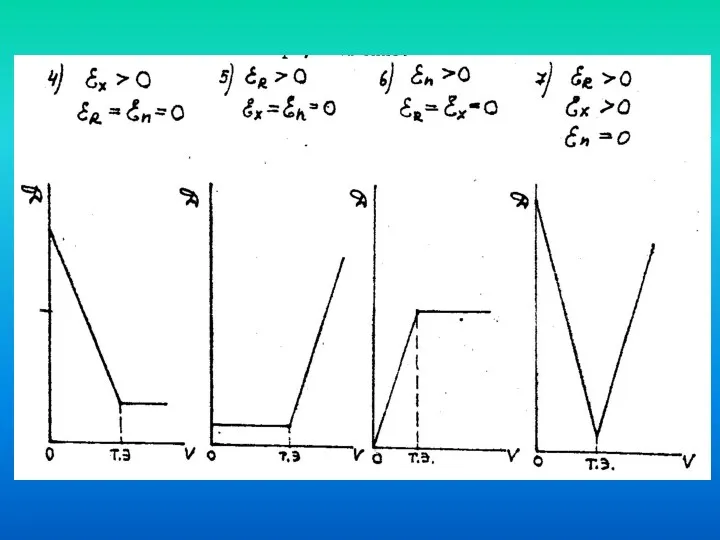
- 75. Случаи фотометрического титрования 1). Поглощает анализируемое вещество (А), титрант (В) и продукт реакции (АВ) при данной
- 76. Рис. 9. Кривые фотометрического титрования
- 77. 2).Поглощает продукт реакции (АВ), анализируемое вещество (А) и титрант (В) не поглощают. Оптическая плотность по мере
- 78. 3). Анализируемое вещество (А) и продукт реакции (АВ) не поглощают, поглощает титрант (В). Оптическая плотность до
- 79. 4). Поглощает продукт реакции (АВ) и титрант (В), анализируемое вещество (А) не поглощает. Характер кривой титрования
- 80. 5). Поглощает анализируемое вещество (А) и титрант (В), продукт реакции (АВ) не поглощает. В процессе титрования
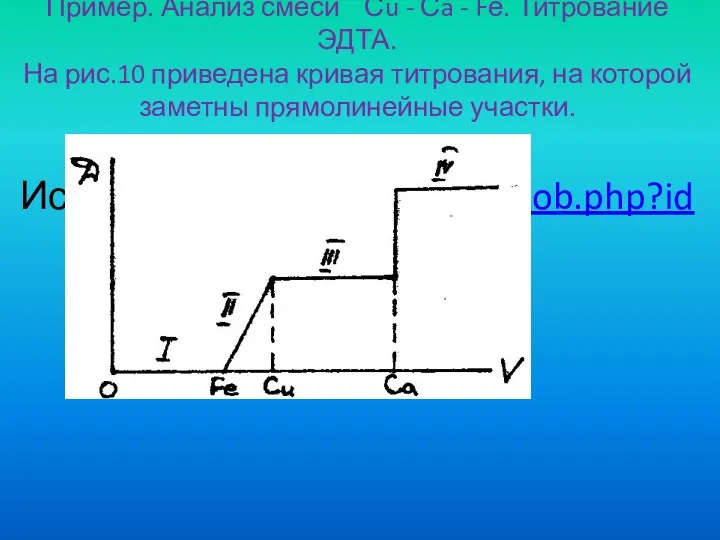
- 81. Пример. Анализ смеси Сu - Сa - Fе. Титрование ЭДТА. На рис.10 приведена кривая титрования, на
- 82. Фотометрическое титрование часто обеспечивает более точные результаты, чем прямой фотометрический анализ, так как для определения конечной
- 84. Оптические методы анализа объектов окружающей среды и пищевых продуктов Методы атомной спектроскопии основаны на явлениях поглощения
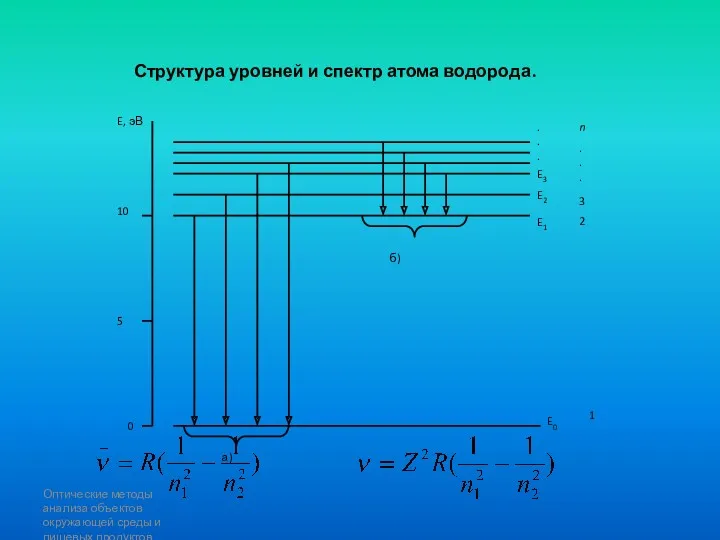
- 85. Оптические методы анализа объектов окружающей среды и пищевых продуктов Структура уровней и спектр атома водорода.
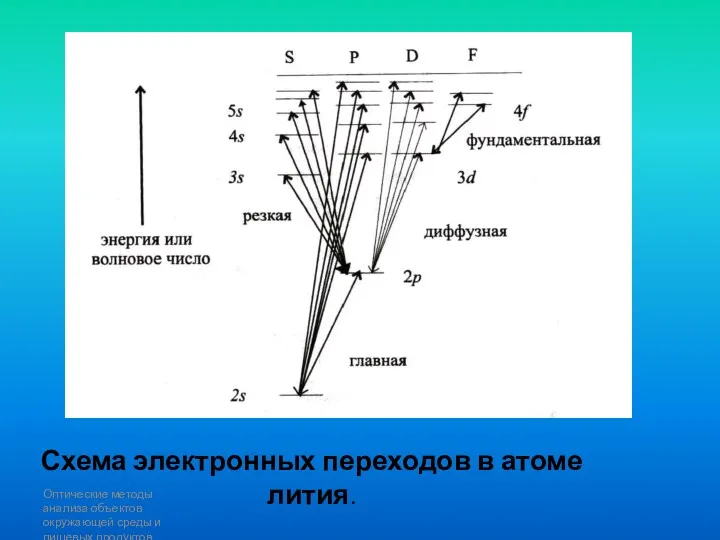
- 86. Оптические методы анализа объектов окружающей среды и пищевых продуктов Схема электронных переходов в атоме лития.
- 87. Оптические методы анализа объектов окружающей среды и пищевых продуктов Серийная структура атомного спектра в атоме лития.
- 88. Оптические методы анализа объектов окружающей среды и пищевых продуктов Схема электронных переходов в атоме натрия.
- 89. Оптические методы анализа объектов окружающей среды и пищевых продуктов Полная энергия молекулы может быть представлена как
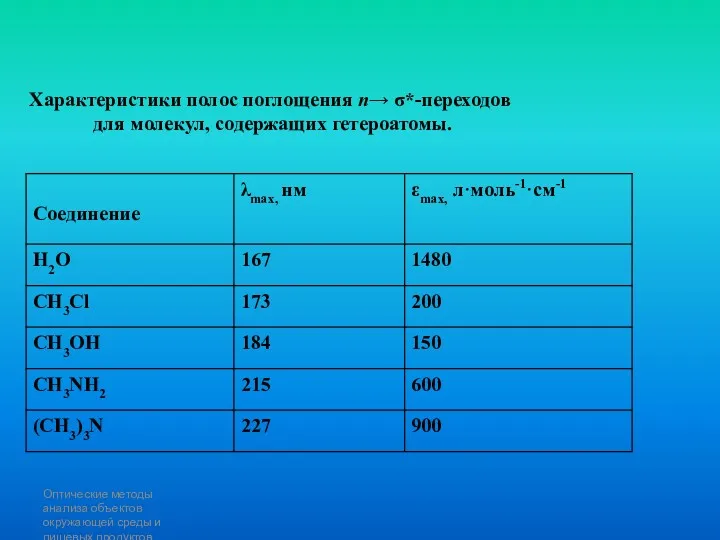
- 90. Оптические методы анализа объектов окружающей среды и пищевых продуктов Характеристики полос поглощения n→ σ*-переходов для молекул,
- 91. Оптические методы анализа объектов окружающей среды и пищевых продуктов Излучение черного тела В соответствии с законом
- 93. Скачать презентацию









































































 Организация познавательной деятельности школьников через систему внеклассной работы по физике
Организация познавательной деятельности школьников через систему внеклассной работы по физике Зубчатые передачи
Зубчатые передачи Электростатическое поле
Электростатическое поле Тесты по физике. Темы: Работа. Мощность. Энергия
Тесты по физике. Темы: Работа. Мощность. Энергия Презентация по физике Световые явления для 8 класса
Презентация по физике Световые явления для 8 класса Электромагнитные волны. Электромагнитные колебания. Понятие об электромагнитном поле
Электромагнитные волны. Электромагнитные колебания. Понятие об электромагнитном поле Давление. Единицы давления
Давление. Единицы давления Імітаційна модель виміру параметрів сигналів частотної маніпуляції
Імітаційна модель виміру параметрів сигналів частотної маніпуляції Статические испытания
Статические испытания Получение и передача переменного электрического тока. Трансформатор
Получение и передача переменного электрического тока. Трансформатор Сила трения
Сила трения Урок по теме Излучение 8 класс
Урок по теме Излучение 8 класс ОГЭ по физике. Экспериментальное задание 23
ОГЭ по физике. Экспериментальное задание 23 Генератор переменного тока. Виды генераторов
Генератор переменного тока. Виды генераторов Скорость при равномерном движении
Скорость при равномерном движении Уявлення про природу світла
Уявлення про природу світла Атомный ледокол Ленин
Атомный ледокол Ленин Криволинейное движение
Криволинейное движение Энергия. Работа. Мощность. Работа постоянной и переменной силы. Кинетическая энергия
Энергия. Работа. Мощность. Работа постоянной и переменной силы. Кинетическая энергия презентация к уроку Диффузия вещества. Золото этрусков.
презентация к уроку Диффузия вещества. Золото этрусков. Хроматографические методы анализа и их применение для контроля качества лекарственных средств
Хроматографические методы анализа и их применение для контроля качества лекарственных средств Диагностика автомобильных дорог. Основы и организация диагностики
Диагностика автомобильных дорог. Основы и организация диагностики Основы теории напряженного состояния. Лекция 9
Основы теории напряженного состояния. Лекция 9 Конструкция и техническое обслуживание пассажирских вагонов
Конструкция и техническое обслуживание пассажирских вагонов Кинематика материальной точки и твердого тела
Кинематика материальной точки и твердого тела Основы кинематики
Основы кинематики Тест как средство контроля знаний и умений учащихся по физике
Тест как средство контроля знаний и умений учащихся по физике Тепломассообмен. Нестационарная теплопроводность
Тепломассообмен. Нестационарная теплопроводность