Содержание
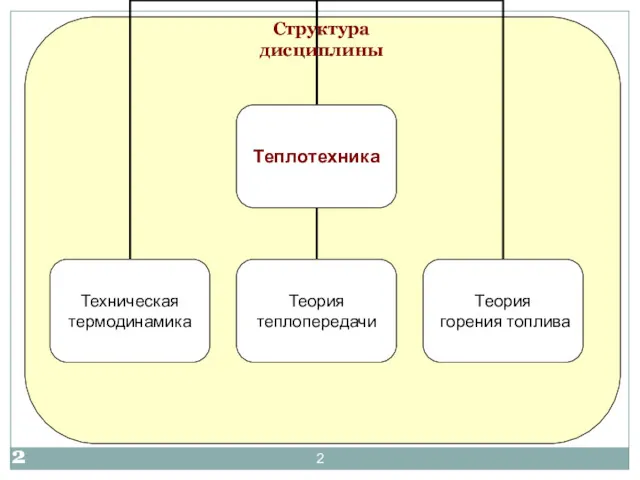
- 2. Структура дисциплины
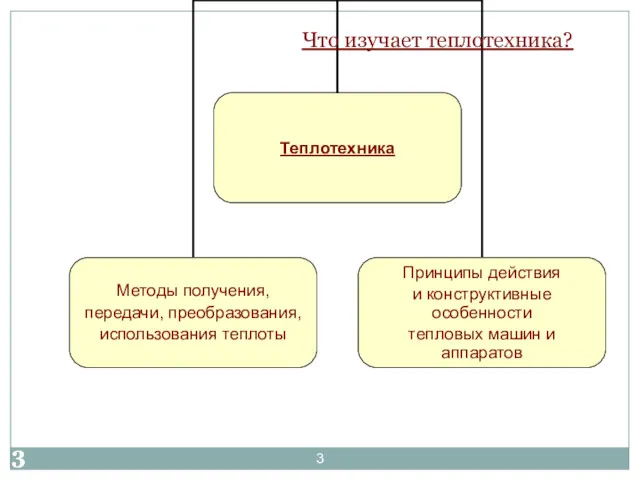
- 3. Что изучает теплотехника?
- 4. Что изучает термодинамика? THERME + DYNAMIS = ТЕПЛОТА + СИЛА «Никто не сомневается, что теплота может
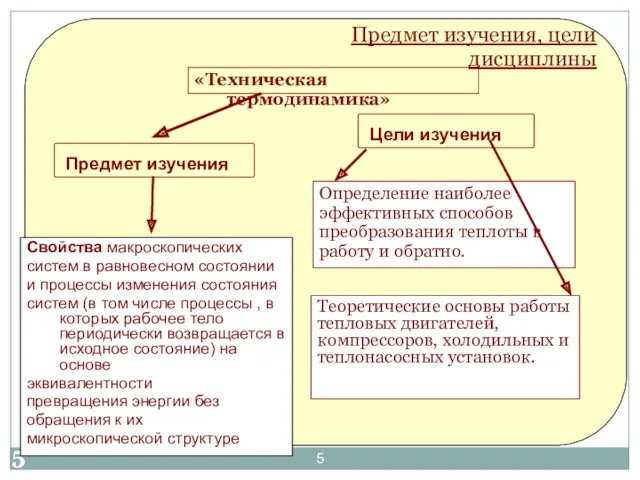
- 5. Определение наиболее эффективных способов преобразования теплоты в работу и обратно. Свойства макроскопических систем в равновесном состоянии
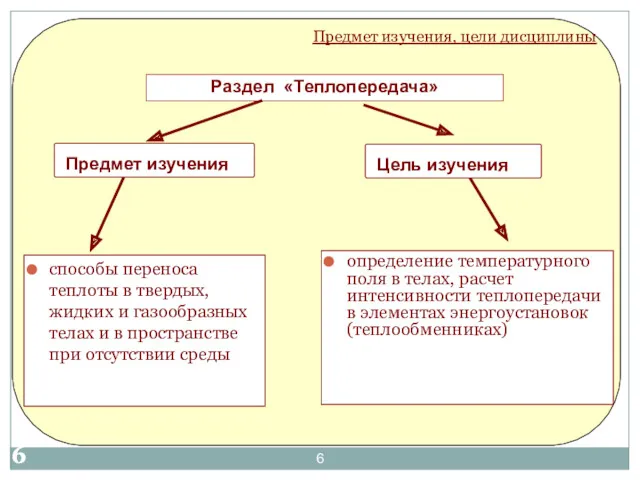
- 6. способы переноса теплоты в твердых, жидких и газообразных телах и в пространстве при отсутствии среды определение
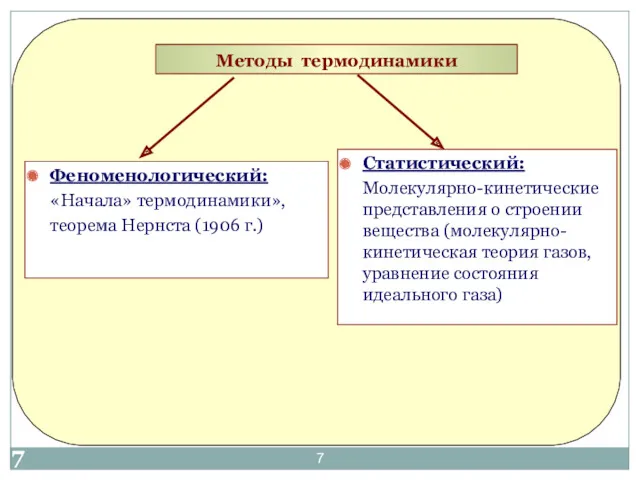
- 7. Методы термодинамики Феноменологический: «Начала» термодинамики», теорема Нернста (1906 г.) Статистический: Молекулярно-кинетические представления о строении вещества (молекулярно-кинетическая
- 8. «Начала» термодинамики» Для закрытой системы: если масса системы неизменна, то «теплота (Q), полученная системой извне, используется
- 9. Закон сохранения энергии по М. Ломоносову Все перемены, в натуре случающиеся, такого суть состояния, что сколько
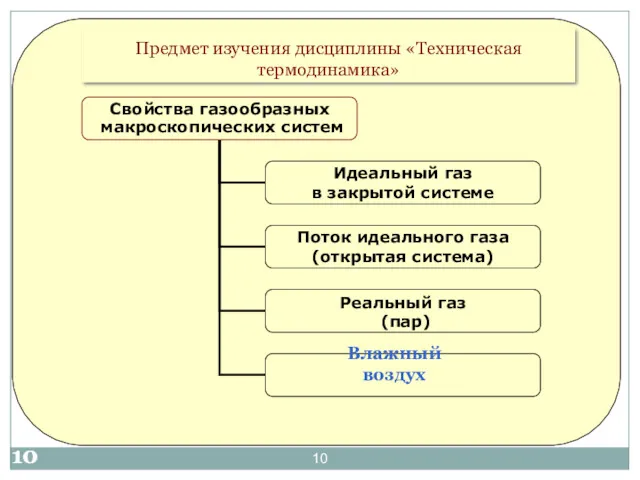
- 10. Предмет изучения дисциплины «Техническая термодинамика» Влажный воздух
- 11. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА 1.Теплотехника: Учебник для втузов. Под общ. ред. А.М. Архарова, В.Н. Афанасьева.– М., Изд-во. МГТУ
- 12. Основное содержание раздела «Термодинамика» Равновесные состояния и параметры состояния идеального газа Процессы идеальных газов в закрытых
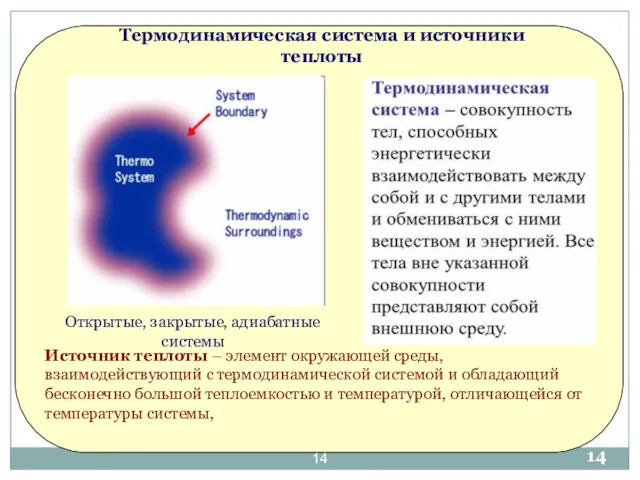
- 13. Основные понятия термодинамики Термодинамическая система (открытая, закрытая, адиабатная) и окружающая среда Источники теплоты: «горячий» и «холодный»
- 14. Термодинамическая система и источники теплоты Источник теплоты – элемент окружающей среды, взаимодействующий с термодинамической системой и
- 15. Рабочее тело – идеальный газ Энергетическое состояние термодинамической системы (идеального газа) характеризуется определенными измеряемыми величинами, называемыми
- 16. Абсолютное давление (p), Па. Давление: абсолютное, р барометрическое (атмосферное) В=101325 Па ≈ 0,1 МПа 1 мм.рт.ст.
- 17. Параметры термодинамического состояния Абсолютная температура, T Абсолютная температура: представляет собой меру средней кинетической энергии молекул характеризует
- 18. Уравнение состояния идеального газа для 1 моля (кмоля): где Rμ - универсальная газовая постоянная - работа,
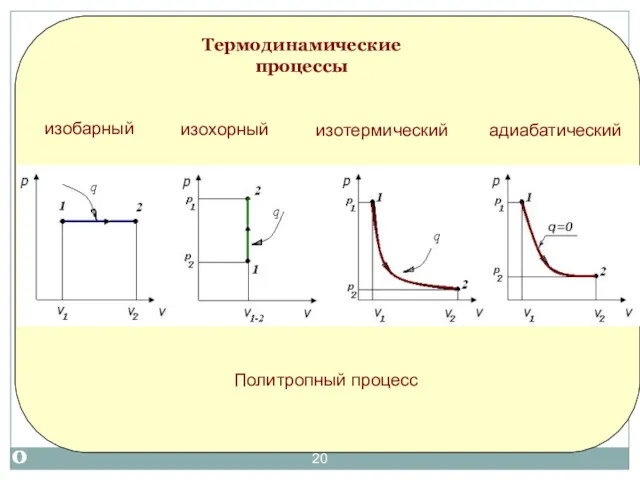
- 19. Термодинамические процессы и циклы Термодинамический процесс: всякое изменение хотя бы одного из параметров состояния. Прямые и
- 20. Термодинамические процессы Политропный процесс изохорный изобарный изотермический адиабатический Термодинамические процессы
- 21. Первое «Начало» термодинамики» Если масса системы неизменна, то «теплота (Q), полученная системой извне, используется на изменение
- 22. Термодинамические процессы
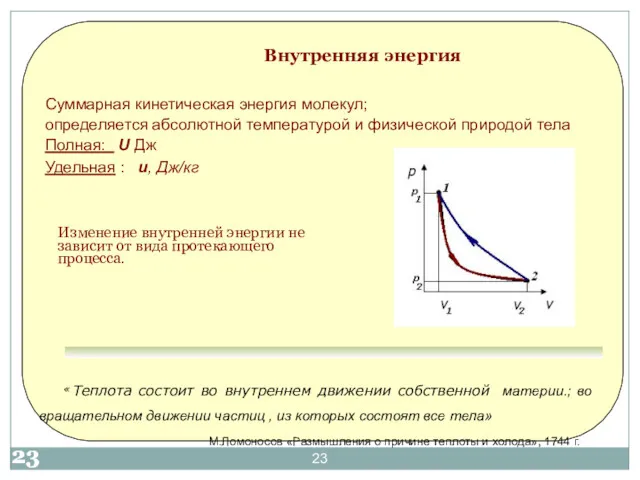
- 23. Внутренняя энергия Изменение внутренней энергии не зависит от вида протекающего процесса. «Теплота состоит во внутреннем движении
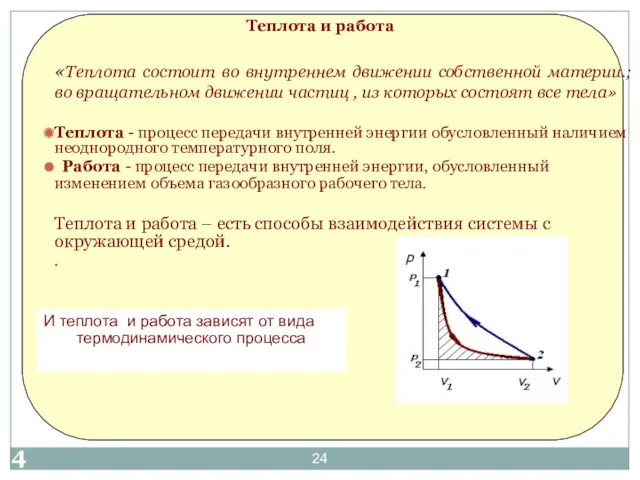
- 24. Теплота и работа «Теплота состоит во внутреннем движении собственной материи.; во вращательном движении частиц , из
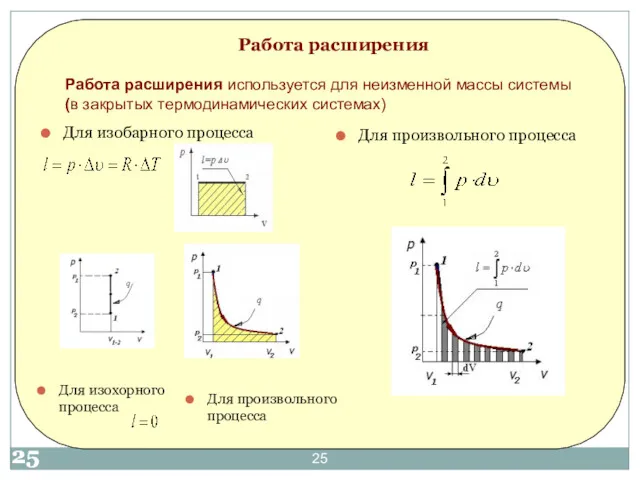
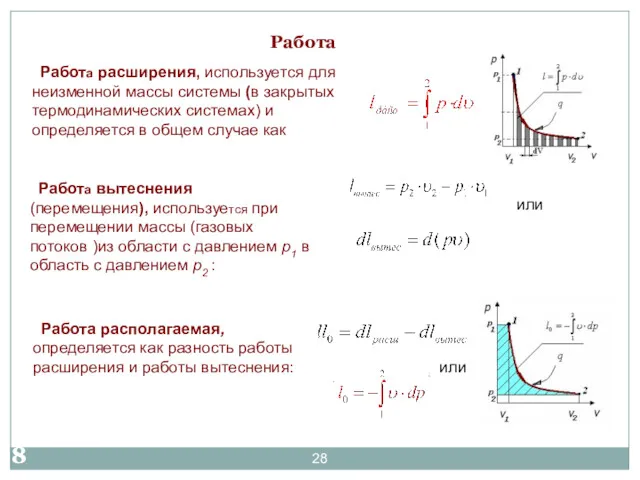
- 25. Работа расширения Для изобарного процесса Для произвольного процесса Работа расширения используется для неизменной массы системы (в
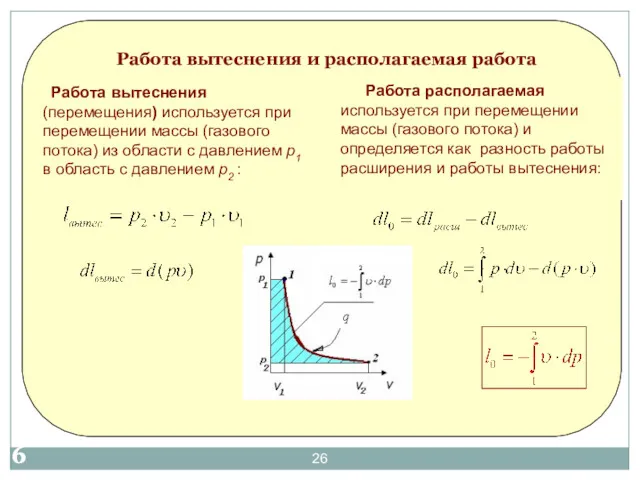
- 26. Работа располагаемая используется при перемещении массы (газового потока) и определяется как разность работы расширения и работы
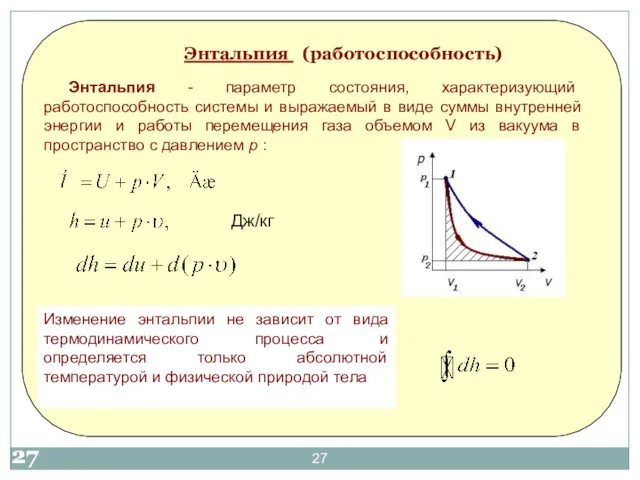
- 27. Энтальпия (работоспособность) Энтальпия - параметр состояния, характеризующий работоспособность системы и выражаемый в виде суммы внутренней энергии
- 28. Работа Работа расширения, используется для неизменной массы системы (в закрытых термодинамических системах) и определяется в общем
- 29. Энтропия Энтропия – есть мера неупорядоченности системы: S = k lnW Важно изменение энтропии, а не
- 30. Первое начало термодинамики для открытых систем где При составлении уравнения баланса энергии для стационарного течения несжимаемого
- 31. Первое начало термодинамики для открытых систем с Сравнивая (1) или Тогда, если или Учитывая, что то
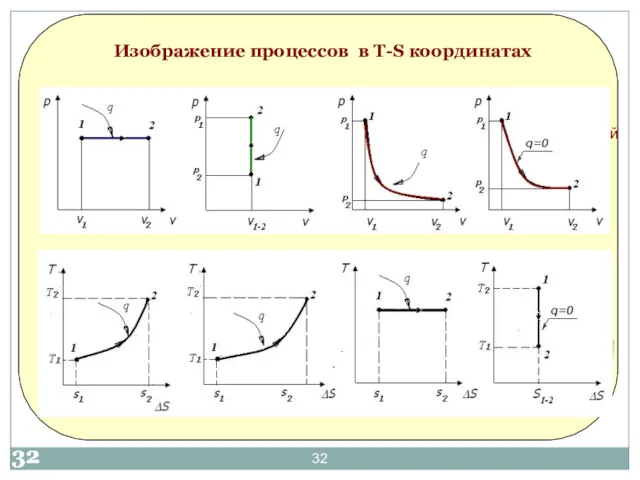
- 32. Изображение процессов в Т-S координатах изобарный изохорный изотермический адиабатический
- 33. Теплоемкость идеальных газов Очевидно: При подводе теплоты к рабочему телу увеличивается внутренней энергии и изменяются параметры
- 34. Виды удельной теплоемкости массовая объёмная мольная (z – количество молей) Взаимосвязь между массовой и объемной: Взаимосвязь
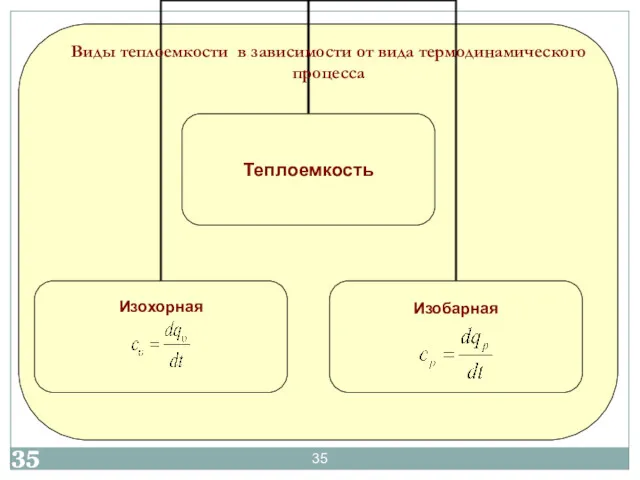
- 35. Виды теплоемкости в зависимости от вида термодинамического процесса
- 36. Важные соотношения k- показатель адиабаты k =5/3 = 1,67 - 1- атомный газ; k = 7/5
- 37. Применение понятия теплоемкости для определения: Теплоты политропного процесса Изменения внутренней энергии Изменения энтальпии Изменения энтропии
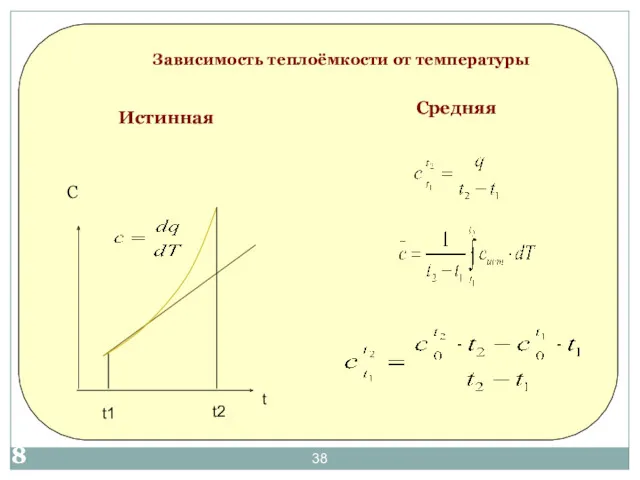
- 38. Зависимость теплоёмкости от температуры Истинная С Средняя t t2 t1
- 39. Смеси идеальных газов (газовые смеси) Состав смеси обычно задается объемными, массовыми мольными долями.
- 40. Термодинамические параметры смеси, заданной объемными долями Плотность Молярная кажущаяся масса Газовая постоянная Парциальные давления
- 41. Термодинамические параметры смеси, заданной массовыми долями Плотность Молярная кажущаяся масса Газовая постоянная Парциальные давления
- 42. Политропные термодинамические процессы
- 43. Вывод уравнения политропного процесса 1-е начало термодинамики в дифференциальном виде Разделим 2-е на 1-е, сохраняя равенство:
- 44. Вывод уравнения политропного процесса Интегрируя: Разделяя переменные: или: Потенциируя: или:
- 45. Удельная теплоемкость политропного процесса (2) (1) Ранее было обозначено: Тогда с учетом:
- 46. Уравнение политропного процесса Показатель политропы Теплоемкость процесса Соотношения между параметрами состояния Политропные процессы в идеальных газах
- 47. Уравнение адиабатического процесса
- 48. Уравнение процесса Теплоемкость процесса Показатель адиабаты) Соотношения между параметрами состояния Адиабатические процессы в идеальных газах
- 49. Термодинамические процессы
- 50. Изменение энтальпии Энергетические параметры состояния для неизотермического политропного процесса Изменение внутренней энергии Изменение энтропии
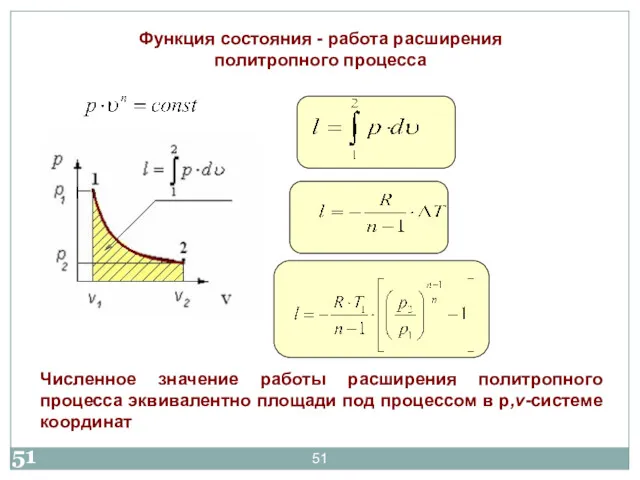
- 51. Функция состояния - работа расширения политропного процесса Численное значение работы расширения политропного процесса эквивалентно площади под
- 52. Функция состояния – располагаемая работа политропного процесса Численное значение располагаемой работы политропного процесса эквивалентно площади под
- 53. Численное значение теплоты политропного процесса эквивалентно площади под процессом в T,Δs-системе координат Функция состояния - теплота
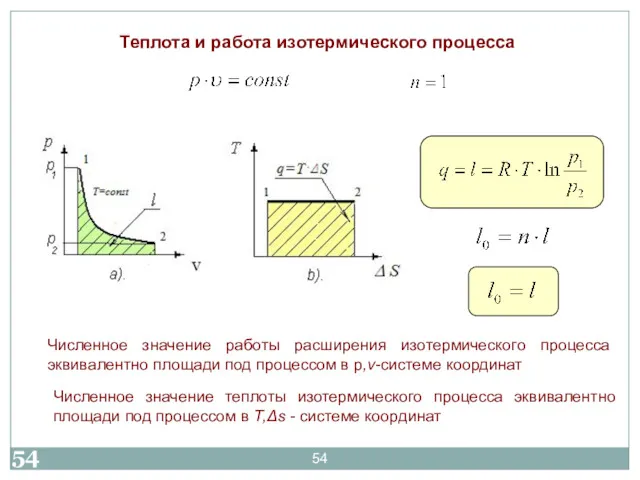
- 54. Численное значение теплоты изотермического процесса эквивалентно площади под процессом в T,Δs - системе координат Теплота и
- 55. Все о политропных процессах
- 57. Скачать презентацию



































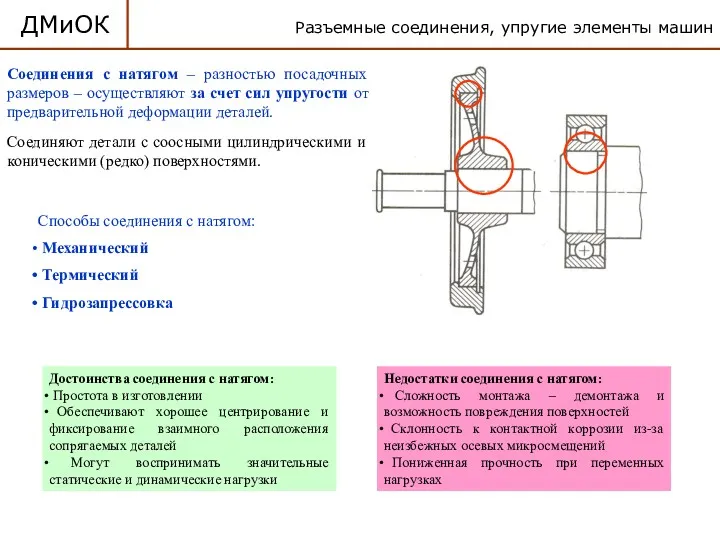 Детали машин и основы конструирования. Разъемные соединения, упругие элементы машин. Соединения с натягом. (Лекция 15)
Детали машин и основы конструирования. Разъемные соединения, упругие элементы машин. Соединения с натягом. (Лекция 15) Радиографические методы
Радиографические методы Станция управления приводов ШГН СКАД-0-УЗЭП. Устройство, диагностика и ремонт
Станция управления приводов ШГН СКАД-0-УЗЭП. Устройство, диагностика и ремонт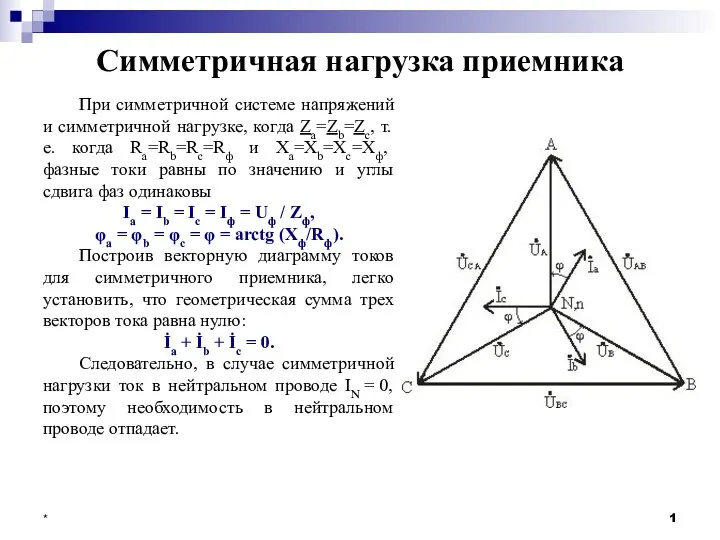 Симметричная нагрузка приемника
Симметричная нагрузка приемника Система наддува в двигателях внутреннего сгорания. Тема 2.16
Система наддува в двигателях внутреннего сгорания. Тема 2.16 Солнечные батареи
Солнечные батареи Управление и характеристики машин
Управление и характеристики машин Тепловые двигатели. Проблемы использования тепловых двигателей
Тепловые двигатели. Проблемы использования тепловых двигателей кейс-технологии на уроках математике
кейс-технологии на уроках математике Топливные форсунки автомобиля
Топливные форсунки автомобиля Термодинамические основы работы тепловых машин (теплотехника)
Термодинамические основы работы тепловых машин (теплотехника)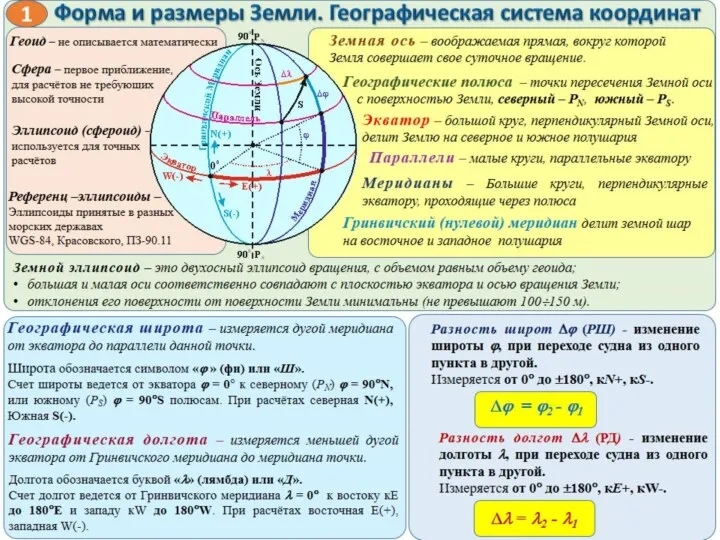 Навигация и лоция
Навигация и лоция Электромагнетизм
Электромагнетизм Теория относительности Эйнштейна
Теория относительности Эйнштейна Kosmicheskoe-izluchenie
Kosmicheskoe-izluchenie Типы волоконной оптики, способы изготовления и применения
Типы волоконной оптики, способы изготовления и применения Жаңбырлатқыш машиналар қондырғылар
Жаңбырлатқыш машиналар қондырғылар Электромагнитная картина мира
Электромагнитная картина мира Решение задач по теме Давление
Решение задач по теме Давление Термоэлектрические и термомагнитные явления. Диффузионный ток
Термоэлектрические и термомагнитные явления. Диффузионный ток Шкала Фаренгейта
Шкала Фаренгейта Электрическая цепь и ее элементы
Электрическая цепь и ее элементы Колебательное движение
Колебательное движение Пара сил и момент силы относительно точки
Пара сил и момент силы относительно точки Энергия. Закон сохранения энергии
Энергия. Закон сохранения энергии Здравствуй,физика!
Здравствуй,физика! Постоянные магниты 9 класс.
Постоянные магниты 9 класс. Урок по теме Излучение 8 класс
Урок по теме Излучение 8 класс