Содержание
- 2. Число степеней свободы молекулы Внутренняя энергия – кинетическая энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов,
- 3. Внутренняя энергия 1 моля газа: Внутренняя энергия для произвольной массы т газа: , где M –
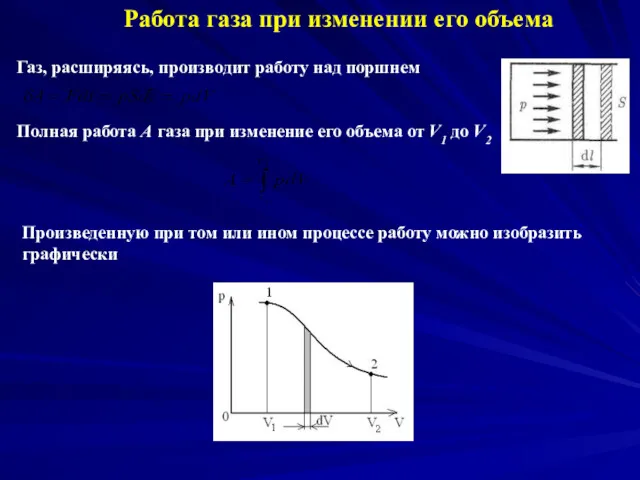
- 4. Работа газа при изменении его объема Газ, расширяясь, производит работу над поршнем Полная работа A газа
- 5. Первое начало термодинамики U – внутренняя энергия; Q – количество теплоты; A – работа внешних сил.
- 6. Т.к. работа внешних сил равна работе системы, взятой с противоположным знаком, то 2) Первое начало термодинамики
- 7. Теплоемкость Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на
- 8. Первое начало термодинамики для 1 моль газа Молярная теплоемкость газа при постоянном объеме: Молярная теплоемкость газа
- 9. Применение первого начала термодинамики к изопроцессам 1. Изохорный процесс (V = const) Газ не совершает работы
- 10. 2. Изобарный процесс (P = const) Работа газа при увеличении объема от V1 до V 2
- 11. 3. Изотермический процесс (T = const) Работа изотермического расширения газа: Так как Т=const внутренняя энергия идеального
- 12. Адиабатный процесс Адиабатным называется процесс, при котором отсутствует теплообмен между системой и окружающей средой (dQ =
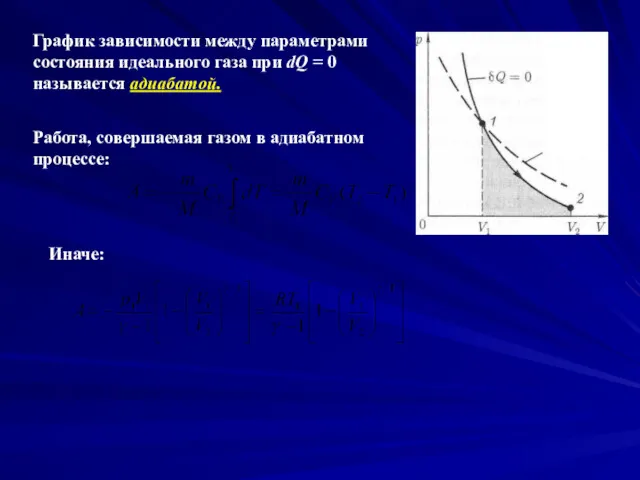
- 13. График зависимости между параметрами состояния идеального газа при dQ = 0 называется адиабатой. Работа, совершаемая газом
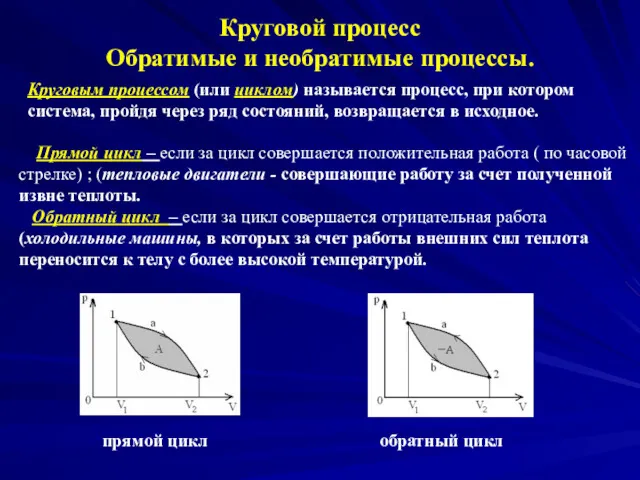
- 14. Круговой процесс Обратимые и необратимые процессы. Круговым процессом (или циклом) называется процесс, при котором система, пройдя
- 15. Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении.
- 16. Тепловые двигатели и холодильные машины Тепловая машина – это устройство , позволяющее преобразовать некоторую часть внутренней
- 17. Цикл Карно и его КПД для идеального газа Цикл Карно — круговой процесс, состоящий из четырех
- 18. Термический КПД цикла Карно Работа, совершаемая в результате кругового процесса Теорема Карно: КПД обратимых машин, работающих
- 19. Энтропия Энтропия - функция состояния, полным дифференциалом которой является δQ/T – приведенное количество теплоты. Приведенное количество
- 21. Скачать презентацию















 эл ток в газах
эл ток в газах Высокоточные системы навигации. Лекция №1.3
Высокоточные системы навигации. Лекция №1.3 Катушки индуктивности
Катушки индуктивности Источники света,Прямолинейное распространение света
Источники света,Прямолинейное распространение света Инфракрасное излучение
Инфракрасное излучение Открытый урок в 8 классе Действие тока
Открытый урок в 8 классе Действие тока Механическая коробка передач
Механическая коробка передач 5 класс 14.06
5 класс 14.06 Шкала электромагнитных излучений
Шкала электромагнитных излучений Плавление льда и снега. Опыты
Плавление льда и снега. Опыты Физический десант
Физический десант Прочность металлов и сплавов как совокупная характеристика влияния структурных уровней
Прочность металлов и сплавов как совокупная характеристика влияния структурных уровней Физика. 8 класс. Перышкин А.В. Урок Электрическое сопротивление проводников. Удельное сопротивление
Физика. 8 класс. Перышкин А.В. Урок Электрическое сопротивление проводников. Удельное сопротивление Электромагнитные помехи
Электромагнитные помехи Магнитное поле токов. Занятие 4
Магнитное поле токов. Занятие 4 Аэродинамика автомобиля
Аэродинамика автомобиля Сейсморазведка. Волны в однородных средах
Сейсморазведка. Волны в однородных средах Механические колебания и волны
Механические колебания и волны Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Электромагнитные излучения. Источники ЭМИ
Электромагнитные излучения. Источники ЭМИ Энергия. Кинетическая энергия. Потенциальная энергия
Энергия. Кинетическая энергия. Потенциальная энергия Техническое обслуживание и ремонт карбюратора автомобиля ВАЗ-2109
Техническое обслуживание и ремонт карбюратора автомобиля ВАЗ-2109 Внеклассная работа: презентация КВН (7 класс)
Внеклассная работа: презентация КВН (7 класс) Перший омнібус Д.Шилібіра
Перший омнібус Д.Шилібіра Смесители
Смесители Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой
Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой Презентация урока по физике для 8 класса на тему Двигатель внутреннего сгорания
Презентация урока по физике для 8 класса на тему Двигатель внутреннего сгорания Электр қауіпсіздігі
Электр қауіпсіздігі