Содержание
- 2. План Сущность метода ОВТ Классификация методов ОВТ Требования к реакциям Кривые окислительно-восстановительного титрования Перманганатометрия Возможности метода
- 3. Сущность метода Red1 + Ox2 ⇄ Ox1 + Red2 или Ox1 + Red2 ⇄ Red1 +
- 4. Классификация Оксидиметрия – титрантом является раствор окислителя: - перманганатометрия (KMnO4); - дихроматометрия (K2Cr2O7); - броматометрия (KBrO3);
- 5. Требования к реакциям Реакции должны протекать практически до конца. - стандартные ОВ потенциалы редокс-пар, участвующих в
- 6. Реальные потенциалы редокс-пар рассчитывают по уравнению Нернста: - стандартный окислительно-восстановительный потенциал данной редокс-пары; - количество электронов,
- 7. Реакции должны протекать достаточно быстро. Конечная точка титрования должна определяться четко и однозначно.
- 8. Если схематично обозначить окисленную и восстановленную формы индикатора в виде IndOx и IndRed, то полуреакцию, отвечающую
- 9. Кривые окислительно-восстановительного титрования Кривая титрования в редокс-метрии – это графическое изображение изменения потенциала от объема прибавленного
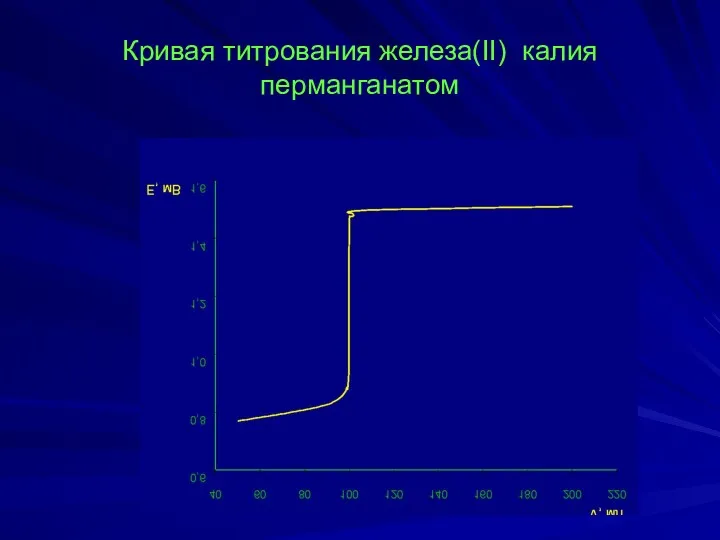
- 10. 5 Fe2+ - ē ⇄ Fe3+ 1 MnO4- + 8 H+ + 5ē ⇄ Mn2+ +
- 11. = +0,77 В = +1,51 В Точка начала скачка титрования: ТЭ После ТЭ: Точка конца скачка
- 12. Кривая титрования железа(II) калия перманганатом
- 13. В сильнокислой среде в присутствии серной кислоты: MnO4- + 8 H+ + 5ē ⮀ Mn2+ +
- 14. В КТТ розовая окраска частично обесцвечивается вследствие реакции: 2 MnO4- + 3 Mn2+ + 2 H2O
- 15. 4 MnO4- + 2 H2O ⮀ 4 MnO2 + 3 O2↑ + 4 OH-
- 16. Стандартизацию раствора КМnO4 проводят по Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, As2O3, Fe(мет.), К4[Fe(CN)б], соли Мора (NH4)2SO4·FeSO4·6Н2О.
- 17. Стандартизация по H2C2О4·2H2О 2 MnO4- + 8 H+ + 5ē ⮀ Mn2+ + 4 H2O 5
- 18. Возможности метода восстановители: ионы низших степеней окисления (Fe2+, Cr2+, Sn2+, AsIII и др.), анионы (Cl-, Br-,
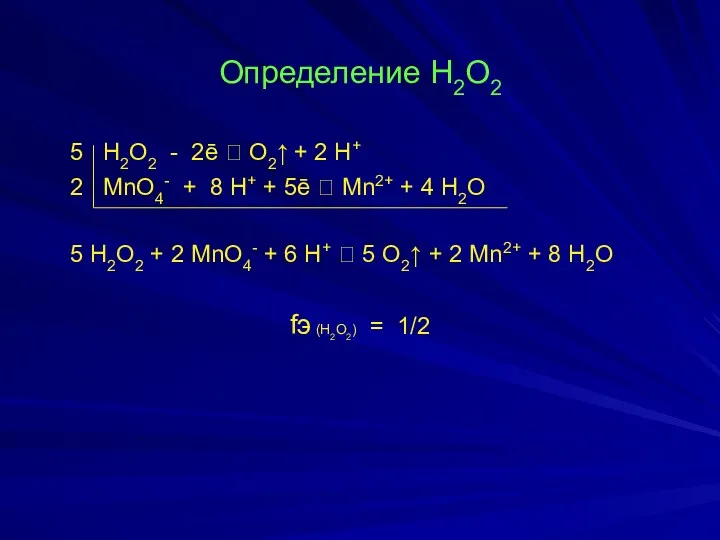
- 19. Определение Н2О2 5 Н2О2 - 2ē ⮀ О2↑ + 2 Н+ 2 MnO4- + 8 H+
- 20. Определение железа(II) в соли Мора (NH4)2Fe(SO4)2∙6H2O или FeSO4∙7H2O 5 Fe2+- ē ⇄ Fe3+ 1 MnO4- +
- 22. Скачать презентацию













![Стандартизацию раствора КМnO4 проводят по Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, As2O3, Fe(мет.), К4[Fe(CN)б], соли Мора (NH4)2SO4·FeSO4·6Н2О.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/263929/slide-15.jpg)



 Устройство, техническое обслуживание и ремонт системы смазки грузового автомобиля КамАЗ 4310
Устройство, техническое обслуживание и ремонт системы смазки грузового автомобиля КамАЗ 4310 Общие сведения о направляющих системах
Общие сведения о направляющих системах Технология термической обработки
Технология термической обработки Микропрезентация как способ оформления домашнего экспериментального задания
Микропрезентация как способ оформления домашнего экспериментального задания Семінар №3. Закони розвитку технічних систем
Семінар №3. Закони розвитку технічних систем Измерение радиусов кривизны сферических поверхностей на сферометре, с помощью автоколлимационных микроскопа и зрительной трубы
Измерение радиусов кривизны сферических поверхностей на сферометре, с помощью автоколлимационных микроскопа и зрительной трубы Свободное падение тел. Равноускоренное движение
Свободное падение тел. Равноускоренное движение Правило Ленца. Явление самоиндукции. Энергия магнитного поля
Правило Ленца. Явление самоиндукции. Энергия магнитного поля ОБРАЗОВАТЕЛЬНАЯ РОБОТОТЕХНИКА ВО ВНЕУРОЧНОЙ ДЕЯТЕЛЬНОСТИ ШКОЛЫ ОБРАЗОВАТЕЛЬНАЯ РОБОТОТЕХНИКА ВО ВНЕУРОЧНОЙ ДЕЯТЕЛЬНОСТИ ШКОЛЫ
ОБРАЗОВАТЕЛЬНАЯ РОБОТОТЕХНИКА ВО ВНЕУРОЧНОЙ ДЕЯТЕЛЬНОСТИ ШКОЛЫ ОБРАЗОВАТЕЛЬНАЯ РОБОТОТЕХНИКА ВО ВНЕУРОЧНОЙ ДЕЯТЕЛЬНОСТИ ШКОЛЫ Расчет сопротивления проводника. Удельное сопротивление
Расчет сопротивления проводника. Удельное сопротивление Формула Максвелла для относительных скоростей
Формула Максвелла для относительных скоростей Сообщающиеся сосуды
Сообщающиеся сосуды Мощность и работа электрического тока
Мощность и работа электрического тока Электрические цепи постоянного тока (лекция 1)
Электрические цепи постоянного тока (лекция 1) Механическая работа. Мощность. 7 класс
Механическая работа. Мощность. 7 класс Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Властивості електромагнітних хвиль
Властивості електромагнітних хвиль Действие жидкости и газа на погруженное в них тело
Действие жидкости и газа на погруженное в них тело Учимся переводить в СИ. презентация для учеников 7 класса.
Учимся переводить в СИ. презентация для учеников 7 класса. Спектры. Виды спектров. Спектральный анализ
Спектры. Виды спектров. Спектральный анализ Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма
Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма Презентация к уроку по физике по теме Давление в твердых телах, жидкостях и газах
Презентация к уроку по физике по теме Давление в твердых телах, жидкостях и газах Работа электрического тока. Мощность электрического тока. Единицы работы электрического тока, применяемые на практике
Работа электрического тока. Мощность электрического тока. Единицы работы электрического тока, применяемые на практике Дисперсия света. Цвета тел
Дисперсия света. Цвета тел План конспект урока по теме Испарение и конденсация 8 класс
План конспект урока по теме Испарение и конденсация 8 класс Адиабатные процессы в природе
Адиабатные процессы в природе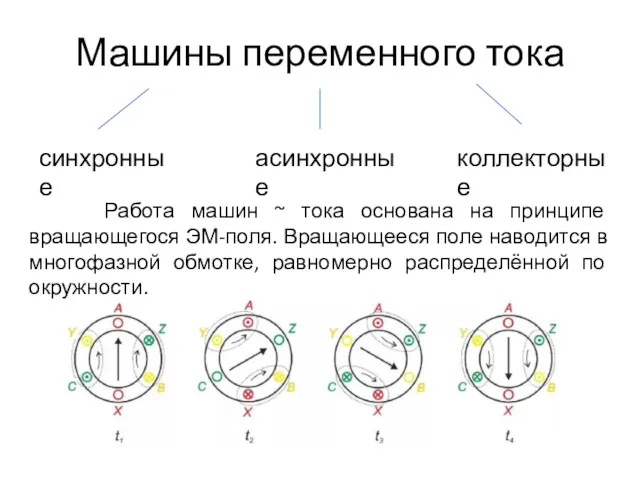 Электрические машины. Машины переменного тока. Лекция №1
Электрические машины. Машины переменного тока. Лекция №1 Сила упругости. Закон Гука
Сила упругости. Закон Гука