Содержание
- 2. §1. Понятия о теплоте и работе Изменение состояния ТДС обусловлено передачей энергии от одного тела к
- 3. §2. Первое начало термодинамики Этот закон устанавливает соотношение между U, A, Q. Он выражает закон сохранения
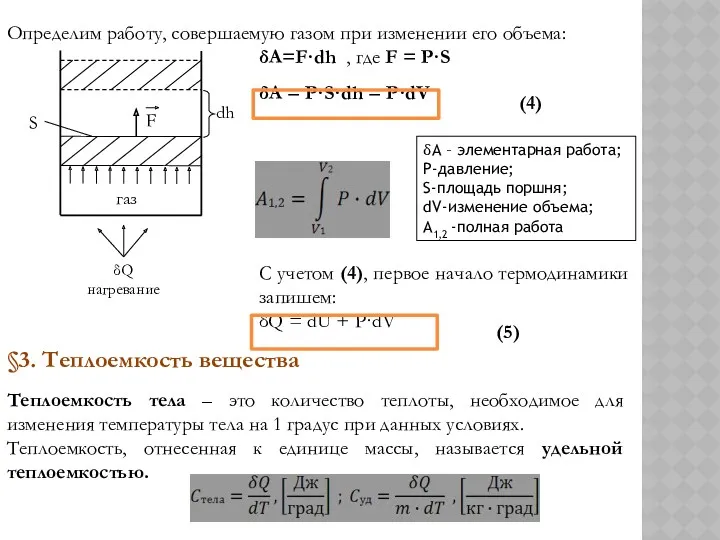
- 4. Определим работу, совершаемую газом при изменении его объема: δA=F·dh , где F = P·S δA =
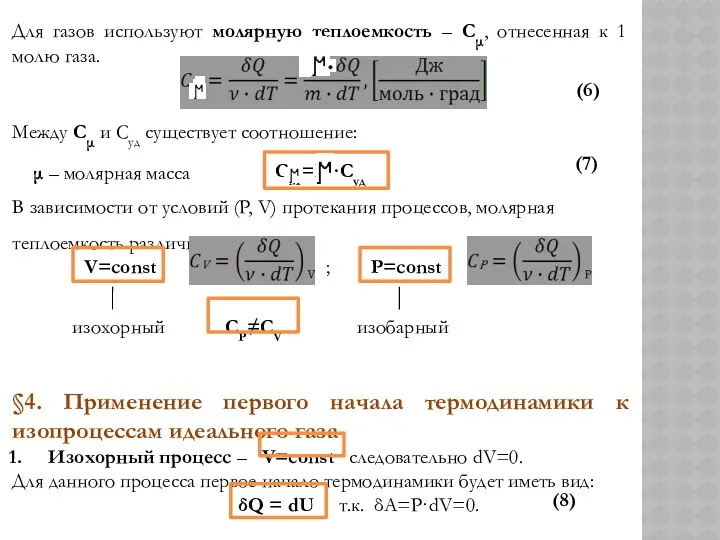
- 5. Для газов используют молярную теплоемкость – Сμ, отнесенная к 1 молю газа. Между Сμ и Суд
- 6. Подведенное тепло к газу при изохорном процессе идет на увеличение его внутренней энергии. Изобарный процесс –
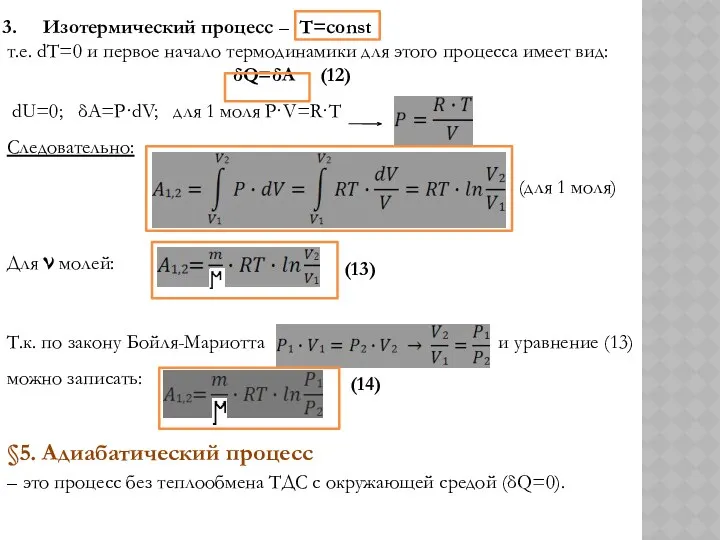
- 7. Изотермический процесс – Т=const т.е. dT=0 и первое начало термодинамики для этого процесса имеет вид: δQ=δA
- 8. Возможность реализации этого процесса: – быстропротекающие процессы (ДВС, взрыв); – хорошо теплоизолированная система. Поскольку δQ=0, то
- 9. Вывод уравнения адиабаты (уравнение Пуассона) В уравнении CV·dT+P·dV=0 исключим dT, заменяя из уравнения P·dV+V·dP=R·dT (1 моль).
- 10. (16) (17)
- 11. §6. Теплоемкость газов на основе МКТ а) Рассмотрим изохорный нагрев системы. Согласно первому началу термодинамики имеем:
- 13. Скачать презентацию
§1. Понятия о теплоте и работе
Изменение состояния ТДС обусловлено передачей энергии
§1. Понятия о теплоте и работе
Изменение состояния ТДС обусловлено передачей энергии
Существует две формы передачи энергии в виде теплоты и работы:
Передача энергии в форме «теплоты» связана с хаотическим движением молекул и их теплообменом.
Передача энергии в форме «работы» связана с упорядоченным движением макроскопических тел при их взаимодействии.
Общее свойство Q и A – они существуют в процессе передачи энергии, их численные значения зависят от пути процесса. Эти параметры не являются однозначными функциями состояния.
Различие между Q и A – это неравноценные формы передачи энергии.
A – может привести к увеличению любого вида энергии системы (WК, WП, U).
Q – ведет к увеличению только U – внутренней энергии.
Взаимосвязь Q и A. Обе эти формы энергии переходят одна в другую.
Опыт: Количественное соотношение (Q) 1 кал. = 4,18 Дж (А).
I=4,18 Дж/кал. – механический эквивалент работы.
§2. Первое начало термодинамики
Этот закон устанавливает соотношение между U, A, Q.
§2. Первое начало термодинамики
Этот закон устанавливает соотношение между U, A, Q.
Закон сохранения энергии утверждает: «Изменение энергии (ΔU) системы при её переходе из одного состояния в другое равно сумме совершенной работы над системой – A' и сообщенной ей теплоты - Q».
ΔU=A'+Q
Вместо A' можно ввести (–А) – работу, совершаемая ТДС над внешними телами, тогда выражение (1) можно записать:
Q = ΔU + A
«Теплота, сообщенная системе, расходуется на увеличение её внутренней энергии (ΔU) и на совершение системой работы над внешними силами».
В дифференциальной форме этот закон будет иметь вид:
δQ = dU + δA
Различия в записи δQ, δA и dU связаны с тем, что:
U – однозначная функция состояния,
Q и A – это функции процесса.
(1)
(2)
(3)
Определим работу, совершаемую газом при изменении его объема:
δA=F·dh , где F
Определим работу, совершаемую газом при изменении его объема:
δA=F·dh , где F
δA = P·S·dh = P·dV
C учетом (4), первое начало термодинамики запишем:
δQ = dU + P·dV
§3. Теплоемкость вещества
Теплоемкость тела – это количество теплоты, необходимое для изменения температуры тела на 1 градус при данных условиях.
Теплоемкость, отнесенная к единице массы, называется удельной теплоемкостью.
(4)
(5)
δА – элементарная работа;
Р-давление;
S-площадь поршня;
dV-изменение объема;
A1,2 -полная работа
Для газов используют молярную теплоемкость – Сμ, отнесенная к 1 молю
Для газов используют молярную теплоемкость – Сμ, отнесенная к 1 молю
Между Сμ и Суд существует соотношение:
СМ=Μ·Суд
В зависимости от условий (P, V) протекания процессов, молярная
теплоемкость различна:
V=const ; P=const
изохорный СP≠CV изобарный
§4. Применение первого начала термодинамики к изопроцессам идеального газа
Изохорный процесс – V=const следовательно dV=0.
Для данного процесса первое начало термодинамики будет иметь вид:
δQ = dU т.к. δA=P·dV=0.
(8)
(6)
μ – молярная масса
(7)
Подведенное тепло к газу при изохорном процессе идет на увеличение его
Подведенное тепло к газу при изохорном процессе идет на увеличение его
Изобарный процесс – P=const
Для 1 моля: δQ=dU+δA
CP·dT=CV·dT+P·dV ;
Учитывая P·V=R·T P·dV=R·dT (для 1 моля)
Найдем соотношение между CP и CV
CP·dT=CV·dT+R·dT R= CP – CV (10) - уравнение Майера
«Универсальная газовая постоянная равна разности молярных теплоёмкостей идеального газа при постоянном давлении (P=const) и при постоянном объёме (V=const)».
Физический смысл R – ?
Из уравнения CP·dT=CV·dT+P·dV (CP – CV )dT=δA R= δA/dT (11) – численно равна работе изобарического расширения одного моля идеального газа при нагреве на 1 градус.
(9)
R
Изотермический процесс – Т=const
т.е. dT=0 и первое начало термодинамики для этого
Изотермический процесс – Т=const
т.е. dT=0 и первое начало термодинамики для этого
δQ=δA (12)
dU=0; δA=P·dV; для 1 моля P·V=R·T
Следовательно:
Для ν молей:
Т.к. по закону Бойля-Мариотта и уравнение (13) можно записать:
§5. Адиабатический процесс
– это процесс без теплообмена ТДС с окружающей средой (δQ=0).
(для 1 моля)
(13)
(14)
Возможность реализации этого процесса:
– быстропротекающие процессы (ДВС, взрыв);
– хорошо теплоизолированная система.
Поскольку
Возможность реализации этого процесса:
– быстропротекающие процессы (ДВС, взрыв);
– хорошо теплоизолированная система.
Поскольку
dU+δA=0 или CV·dT+P·dV=0
При адиабатическом процессе возможны два крайних случая:
dV>0 (газ расширяется).
В этом случае: δA= – dU , т.е. dT<0.
Работа расширения газа совершается за счет убыли внутренней энергии газа (T↓).
dV<0 – адиабатическое сжатие.
Под действием внешних сил: CV·dT= -P·dV, при этом внутренняя энергия увеличивается dT>0.
Затраченная извне работа целиком идет на увеличение запаса внутренней энергии газа (T↑).
Вывод уравнения адиабаты (уравнение Пуассона)
В уравнении CV·dT+P·dV=0 исключим dT, заменяя из
Вывод уравнения адиабаты (уравнение Пуассона)
В уравнении CV·dT+P·dV=0 исключим dT, заменяя из
Получим:
Заменим R= CP – CV и упростим до выражения CV·V·dP+CP·P·dV=0.
Обозначим CP/CV=γ. Заменяя CP=CV·γ, получим:
CV·V·dP+CV·γ·P·dV=0 →
В предположении, что γ=const, проинтегрируем выражение
Потенцируем последнее выражение, имеем:
уравнение адиабаты (уравнение Пуассона)
- показатель адиабаты; γ>1.
|поделим обе части уравнения на PV
(15)
(16)
(17)
(16)
(17)
§6. Теплоемкость газов на основе МКТ
а) Рассмотрим изохорный нагрев системы. Согласно
§6. Теплоемкость газов на основе МКТ
а) Рассмотрим изохорный нагрев системы. Согласно
Т.е. – первая производная внутренней энергии по температуре.
Согласно МКТ, внутренняя энергия 1 моля газа – . дифференцируя последнее выражение, получим:
Таким образом, при V=const изохорном процессе мольная теплоемкость
б) Для изобарного процесса P=const используем уравнение Майера:
CP – CV =R (10)
Формулы (18) и (19) позволяют найти соотношение CP/CV :
γ – показатель адиабаты.
(18)
(19)
(20)







 Стиральные машины SPA STEAM
Стиральные машины SPA STEAM Основные неисправности ходовой части. Техническое обслуживание рамы и подвески
Основные неисправности ходовой части. Техническое обслуживание рамы и подвески презент....ЭЛЕКТРОДИНАМИКА,,,
презент....ЭЛЕКТРОДИНАМИКА,,, А.С. Попов – изобретатель радио
А.С. Попов – изобретатель радио Динамика материальной точки и абсолютно твердого тела
Динамика материальной точки и абсолютно твердого тела Физика, как наука о природе повторение. Масса. Плотность. Урок 1
Физика, как наука о природе повторение. Масса. Плотность. Урок 1 Простые механизмы. Рычаг
Простые механизмы. Рычаг Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар
Магнит өрісінің тогы бар өткізгішке әрекеті. Электрқозғалтқыштар. Электр өлшеуіш аспаптар Применение ЭОР в образовательном процессе
Применение ЭОР в образовательном процессе Колебательные цепи при гармонических воздействиях. Лекция 5
Колебательные цепи при гармонических воздействиях. Лекция 5 Текущий ремонт разъединителя РНДЗ-1-35/1000
Текущий ремонт разъединителя РНДЗ-1-35/1000 Электростатика. Электродинамика
Электростатика. Электродинамика Применение аккумуляторов
Применение аккумуляторов Техническое обслуживание и ремонт автотранспорта. Устройство автомобилей
Техническое обслуживание и ремонт автотранспорта. Устройство автомобилей Дифракция света. Лекция 3
Дифракция света. Лекция 3 Динамика материальной точки. Законы Ньютона
Динамика материальной точки. Законы Ньютона Проводниковые материалы
Проводниковые материалы Влияние музыки на рост растений
Влияние музыки на рост растений Техногенные опасности. Статическое электричество. Лазерное излучение
Техногенные опасности. Статическое электричество. Лазерное излучение Методическая разработка по физике (9 класс) по теме: Решение задач по теме Закон всемирного тяготения. ИСЗ
Методическая разработка по физике (9 класс) по теме: Решение задач по теме Закон всемирного тяготения. ИСЗ Дефектування і комплектування
Дефектування і комплектування Гидродинамические передачи. (Лекция 15-16)
Гидродинамические передачи. (Лекция 15-16) Oscillatory motion. Simple harmonic motion. The simple pendulum. Damped harmonic oscillations. (Lecture 1)
Oscillatory motion. Simple harmonic motion. The simple pendulum. Damped harmonic oscillations. (Lecture 1) Термоядерный синтез
Термоядерный синтез Паровая турбина. КПД теплового двигателя
Паровая турбина. КПД теплового двигателя Дозиметрия ионизирующих излучений. Лекция 2
Дозиметрия ионизирующих излучений. Лекция 2 История ядерного реактора
История ядерного реактора Кристаллические и аморфные тела
Кристаллические и аморфные тела