Ernest Rutherford (1871-1937)
Изотопы -- разновидности атомов какого-либо химического элемента, которые имеют
одинаковый атомный номер, но разные массовые числа.
Химические свойства их почти идентичны, поскольку (как мы знаем сейчас) определяются электронной оболочкой.
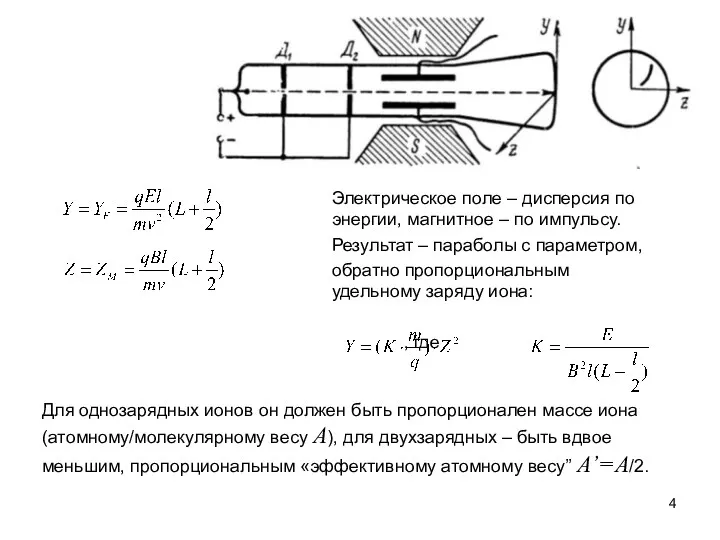
Эксперимент Томсона с неоном:
Обнаружены параболы, соответствующие значениям A’= 20, 22 и 44.
При этом известное «химическое» значение
массового веса неона равно 20.2.
A’ =44 соответствует CO2+ . А 22? Это CO2++?
Удалили CO2 вымораживанием. Но составляющая «A’ =22» осталась. Элемент с таким атомным весом был неизвестен.
Обнаружен новый элемент?
Это не совсем тот рисунок. Но параболы 20, 22 и 44 также присутствуют.






 Урок физике в 7 классе Решение задач на расчёт механической работы и мощности
Урок физике в 7 классе Решение задач на расчёт механической работы и мощности Истечение жидкости через отверстия и насадки
Истечение жидкости через отверстия и насадки урок-игра по физике по теме Плотность
урок-игра по физике по теме Плотность Сила трения. Тест
Сила трения. Тест Взаимодействие тел. Масса
Взаимодействие тел. Масса Лекция №6 (6 ). Поле системы элементарных излучателей
Лекция №6 (6 ). Поле системы элементарных излучателей Термоядерная реакция
Термоядерная реакция Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем
Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем Повторение курса физики. 8 класс
Повторение курса физики. 8 класс Анализ эксплуатационной надежности бурового вертлюга ВБ-80М
Анализ эксплуатационной надежности бурового вертлюга ВБ-80М Открытие электромагнитных колебаний. 11 класс
Открытие электромагнитных колебаний. 11 класс Точність обробки. (Лекция 3)
Точність обробки. (Лекция 3) Закон Кулона. Электрическое поле
Закон Кулона. Электрическое поле Молекулярная физика. Атом
Молекулярная физика. Атом Явление электромагнитной индукции
Явление электромагнитной индукции Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Цифровые сигналы
Цифровые сигналы МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР
МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР Электромагнитные явления. Своя игра
Электромагнитные явления. Своя игра Аэродинамические весы
Аэродинамические весы Движение под действием силы тяжести. Решение задач
Движение под действием силы тяжести. Решение задач Динамика вязкой жидкости
Динамика вязкой жидкости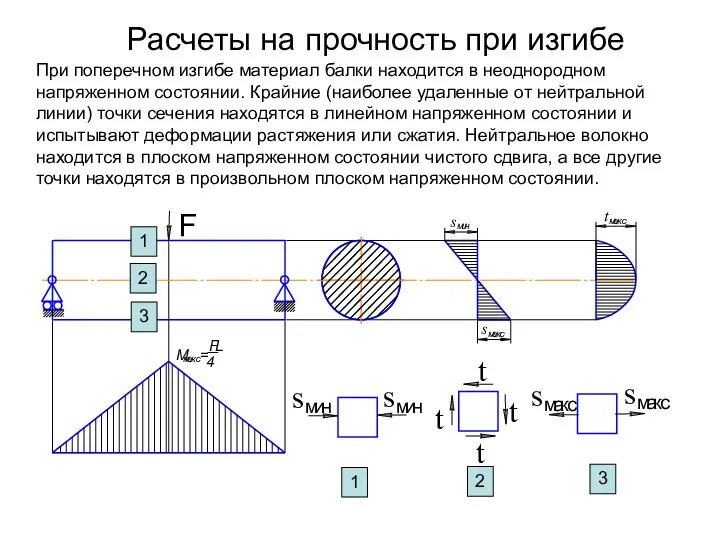 Расчеты на прочность при изгибе
Расчеты на прочность при изгибе Реактивное движение. Ракеты
Реактивное движение. Ракеты Соединения деталей. Виды изделий. Резьбовые соединения
Соединения деталей. Виды изделий. Резьбовые соединения Создание источника электричества из овощей и фруктов
Создание источника электричества из овощей и фруктов Момент инерции. Теорема Штейнера. Кинетическая энергия вращательного движения твердого тела. (Лекция 5)
Момент инерции. Теорема Штейнера. Кинетическая энергия вращательного движения твердого тела. (Лекция 5) Закон сохранения энергии в тепловых процессах.
Закон сохранения энергии в тепловых процессах.