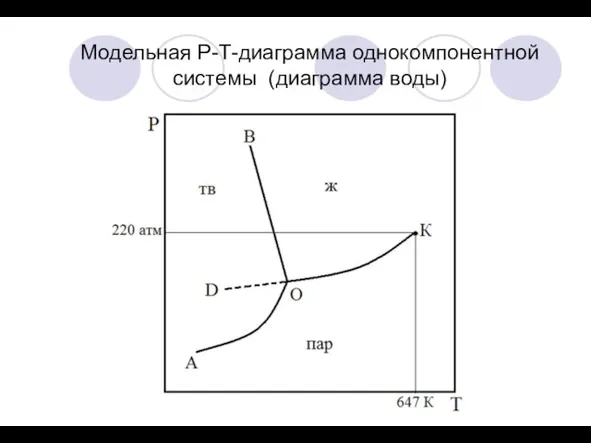
Диаграммы, отражающие фазовый состав системы, называют фазовыми диаграммами или диаграммами состояния
(объемные и плоские).
Принципы фазового анализа:
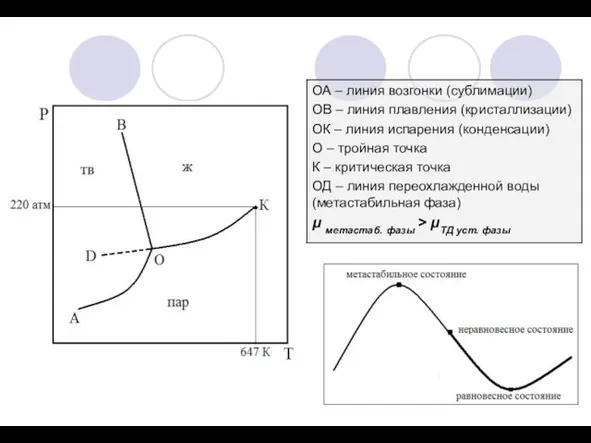
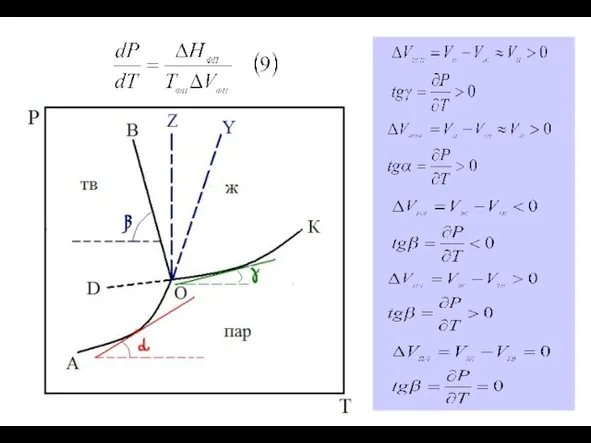
1) Принцип непрерывности: при непрерывном изменении параметров состояния системы свойства системы в пределах фазы также меняются плавно и непрерывно. При появлении новой фазы или исчезновении старых свойства системы меняются скачкообразно.
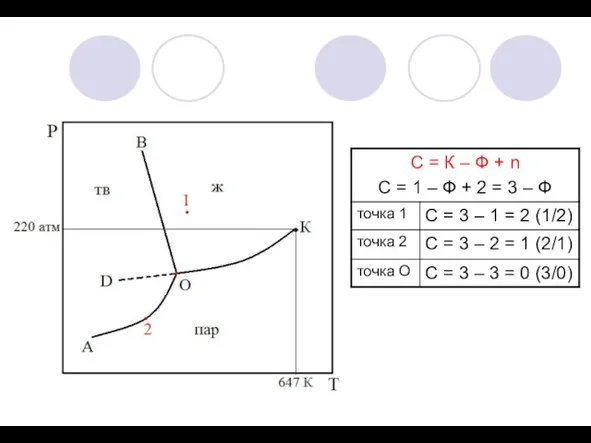
2) Принцип геометрического соответствия: на диаграмме состояния каждому фазовому состоянию системы соответствует свой геометрический образ (плоскость, линия, точка).









 Презентация. Гости из космоса
Презентация. Гости из космоса Люди нашего края Голобоков
Люди нашего края Голобоков Электроосветительные приборы
Электроосветительные приборы Электроемкость. Конденсаторы. Урок физики в 10 классе
Электроемкость. Конденсаторы. Урок физики в 10 классе Фрикционные передачи
Фрикционные передачи Поляризация света
Поляризация света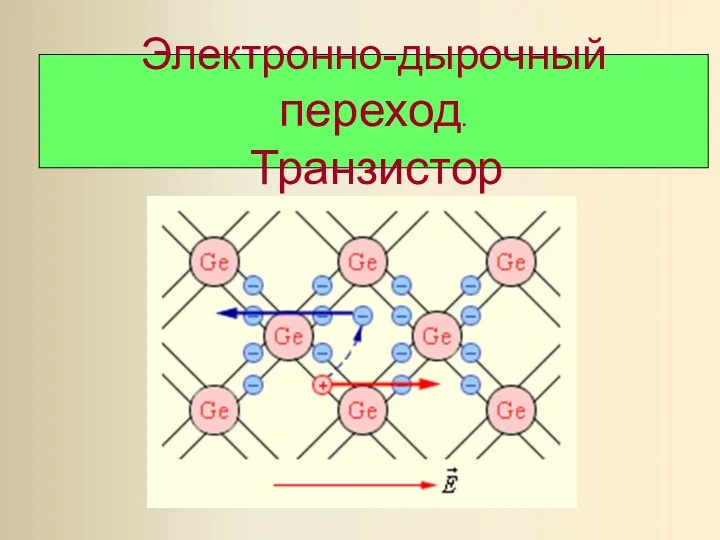 Презентация Электронно-дырочный переход. Транзистор
Презентация Электронно-дырочный переход. Транзистор Инерция
Инерция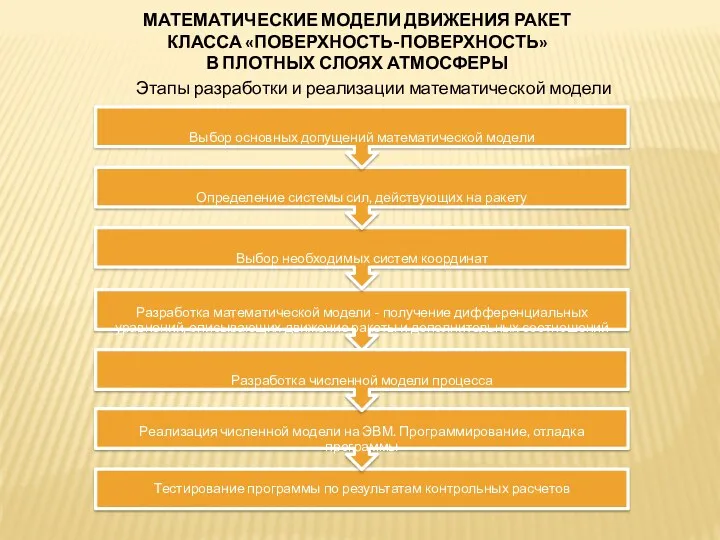 Математические модели движения ракет класса поверхность-поверхность в плотных слоях атмосферы
Математические модели движения ракет класса поверхность-поверхность в плотных слоях атмосферы Сдвиг и кручение. Закон Гука при сдвиге. Условие прочности при чистом сдвиге
Сдвиг и кручение. Закон Гука при сдвиге. Условие прочности при чистом сдвиге Многодисковая муфта с фрикционными дисками
Многодисковая муфта с фрикционными дисками Презентация к уроку по физике для 8 класса по теме Влажность воздуха
Презентация к уроку по физике для 8 класса по теме Влажность воздуха Тұтас орталар механикасының элементтері
Тұтас орталар механикасының элементтері Масса и размеры молекул. Количество вещества
Масса и размеры молекул. Количество вещества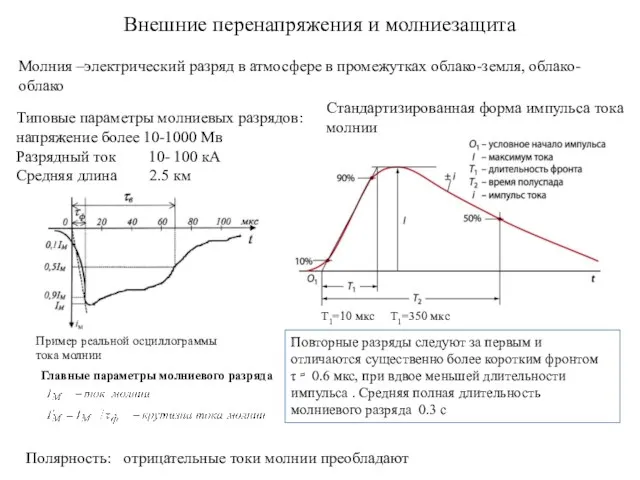 Внешние перенапряжения и молниезащита. (Лекция 2.4)
Внешние перенапряжения и молниезащита. (Лекция 2.4) Структурные уровни организации материи. Микро-, макро-, мегамиры
Структурные уровни организации материи. Микро-, макро-, мегамиры урок по физике Магнитное поле
урок по физике Магнитное поле Тормозная система
Тормозная система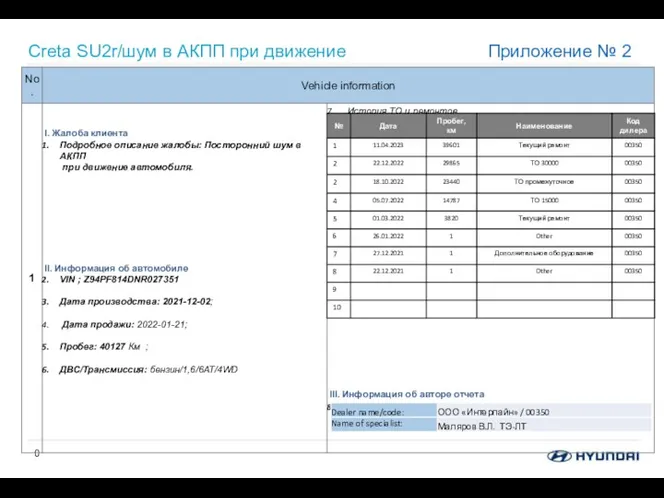 Creta SU2r/шум в АКПП при движение
Creta SU2r/шум в АКПП при движение Состав ядра. Ядерные силы
Состав ядра. Ядерные силы Элементарные частицы. Античастицы
Элементарные частицы. Античастицы Презентация.Реактивное движение
Презентация.Реактивное движение Архимедова сила
Архимедова сила М.В.Ломоносов
М.В.Ломоносов Испарение и конденсация. Кипение жидкости. Подготовка к ГИА
Испарение и конденсация. Кипение жидкости. Подготовка к ГИА Заземляющие устройства в установках высокого напряжение. (Лекция 17)
Заземляющие устройства в установках высокого напряжение. (Лекция 17) виды излучений. физика 11 класс
виды излучений. физика 11 класс Электрический ток в различных средах. Вещества
Электрический ток в различных средах. Вещества