Содержание
- 2. Урок физики 10 класс Учитель физики Коваль Антонина Валентиновна
- 3. Первый закон термодинамики Закон сохранения энергии для тепловых процессов ©visi
- 4. «За основу тут мы берем положение такое: из ничего не творится ничего» Лукреций Карл, «О природе
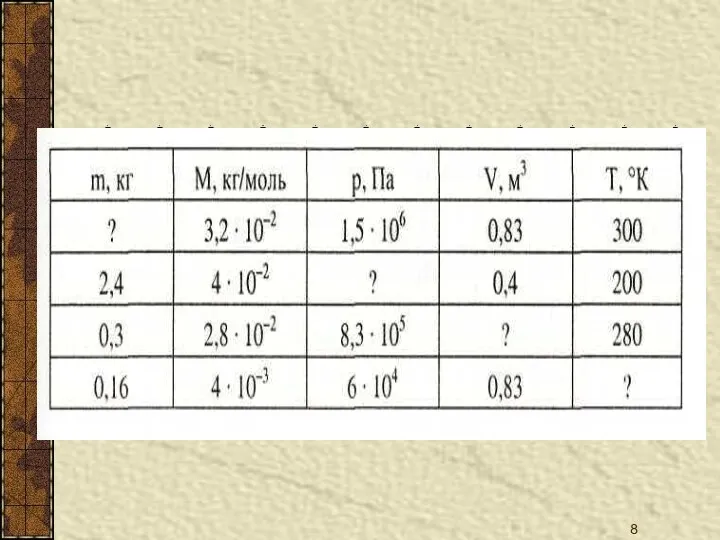
- 6. Знание формул 1.Количество вещества 2. число частиц 3. концентрация молекул 4.основное уравнение МКТ 5. уравнение МКТ
- 7. 8. уравнение Клапейрона 9. закон Бойля-Мариотта 10.средняя кинетическая энергия молекул
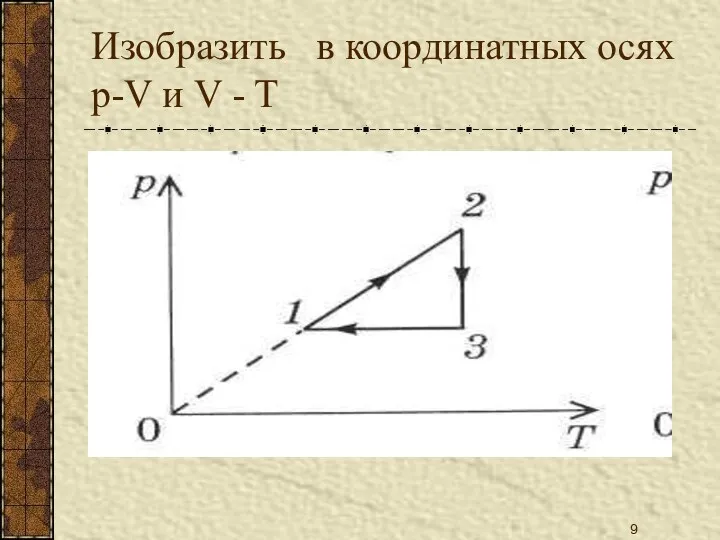
- 9. Изобразить в координатных осях p-V и V - T
- 10. Что надо выяснить: Связь между какими величинами выражает данный закон? Формулировка закона и математическая запись закона.
- 11. Внутренняя энергия U = (WK + W П ) N. Как же можно изменить?
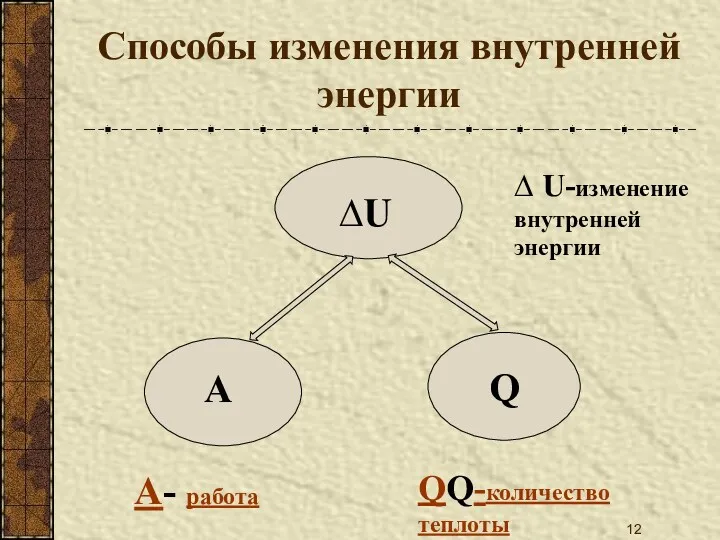
- 12. Способы изменения внутренней энергии А- работа QQ-количество теплоты ∆ U-изменение внутренней энергии
- 13. ΔU = Q + A' Изменение внутренней энергии термодинамической системы при переходе из одного состояния в
- 14. Так как работа внешних сил над газом A' равна работе самого газа А , но взятого
- 15. Первый закон термодинамики А- работа газа Q-количество теплоты ∆ U-изменение внутренней энергии Q=A + ∆ U
- 16. Запомни правила: Q > 0 , если теплота передается системе (газу) A > 0 , если
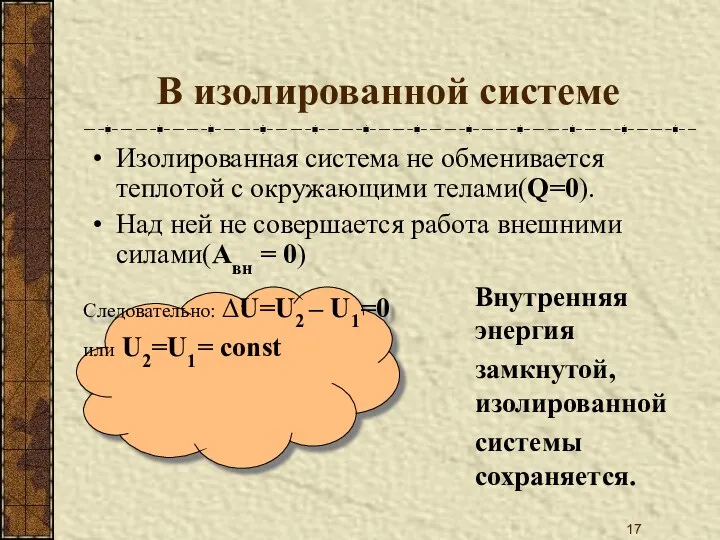
- 17. В изолированной системе Изолированная система не обменивается теплотой с окружающими телами(Q=0). Над ней не совершается работа
- 18. Суть 1 закона термодинамики Изменение определенной энергии не зависит от процесса и определяется только начальным и
- 19. Этот закон был открыт в середине XIX в. немецким ученым, врачом по образованию Р. Майером (1814-1878),
- 20. Закон учитывается и в животном мире. Объясните форму ушей лис, применяя 1 закон термодинамики
- 21. Невозможность создания вечного двигателя Из первого закона термодинамики вытекает невозможность создания вечного двигателя - устройства, способного
- 22. Домашнее задание 1. § 5.2 2. Зачем протапливают помещения: для повышения температуры или внутренней энергии? 3.
- 23. Роберт Юлиус Майер Майер по профессии врач, работал некоторое время судовым врачом. Однажды штурман сказал ему,
- 24. Майер правильно объяснил яркость крови у жителей тропиков: вследствие высокой температуры организму приходится вырабатывать меньше теплоты.
- 25. Выполни задание 1. Идеальный газ получил количество теплоты, равное 300 Дж, и совершил работу, равную 100
- 26. 3. Идеальный газ совершил работу, равную 300 Дж. При этом внутренняя энергия уменьшилась на 300 Дж.
- 28. Скачать презентацию





















 Geschichte der Eisenbahn
Geschichte der Eisenbahn Коробка передач на ВАЗ-2106
Коробка передач на ВАЗ-2106 Электросинтез. (Тема 7)
Электросинтез. (Тема 7) Презентации по физике
Презентации по физике Изучение электрической цепи.
Изучение электрической цепи. Смачивание и несмачивание.Капиллярные явления
Смачивание и несмачивание.Капиллярные явления Защита от перенапряжений в электоустановках. (Лекция 16)
Защита от перенапряжений в электоустановках. (Лекция 16) Урок по теме: Физические величины и их измерение.
Урок по теме: Физические величины и их измерение. Вихретоковый неразрушающий контроль
Вихретоковый неразрушающий контроль Система параллельных сил и пар
Система параллельных сил и пар Особенности разработки рабочей программы по физике в соответствии с обновленным ФГОС ООО
Особенности разработки рабочей программы по физике в соответствии с обновленным ФГОС ООО Electrical potentials of the cell
Electrical potentials of the cell Основные положения электромагнитной теории Максвелла
Основные положения электромагнитной теории Максвелла Металлорежущие станки и станочные комплексы. Общие сведения и механизмы станков. (Темы 1 и 2)
Металлорежущие станки и станочные комплексы. Общие сведения и механизмы станков. (Темы 1 и 2) Адаев Презхентация
Адаев Презхентация решение задач на давление в жидкости
решение задач на давление в жидкости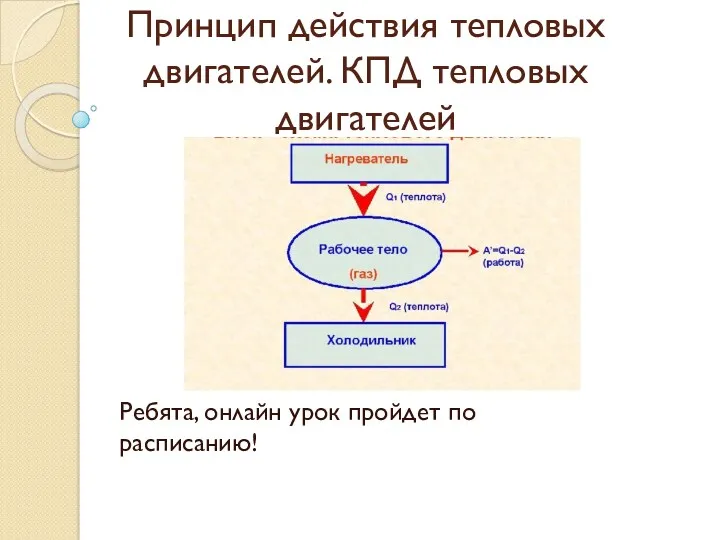 Принцип действия тепловых двигателей. КПД тепловых двигателей
Принцип действия тепловых двигателей. КПД тепловых двигателей Гамма-сәуле шығару
Гамма-сәуле шығару Стандарт выброса третьего этапа внедорожных машин в Китае. Правильная эксплуатация по транспортному средству
Стандарт выброса третьего этапа внедорожных машин в Китае. Правильная эксплуатация по транспортному средству Использование комплекта Я сдам ЕГЭ для подготовки к экзамену по физике
Использование комплекта Я сдам ЕГЭ для подготовки к экзамену по физике Основи молекулярно - кінетичної теорії газів (лекція 6)
Основи молекулярно - кінетичної теорії газів (лекція 6) Жарық дифракциясы
Жарық дифракциясы Соединения. Резьбовые, сварные, заклепочные, шпоночные, шлицевые, штифтовые, гладкие соединения
Соединения. Резьбовые, сварные, заклепочные, шпоночные, шлицевые, штифтовые, гладкие соединения Вырожденные фазовые равновесия на экспериментальных t-x диаграммах
Вырожденные фазовые равновесия на экспериментальных t-x диаграммах Тепловые двигатели. Работа газа при расширении. ДВС
Тепловые двигатели. Работа газа при расширении. ДВС Устройство и принцип работы крана машиниста 394
Устройство и принцип работы крана машиниста 394 Кинематика. Виды движения
Кинематика. Виды движения Силы в механике. Для изучения темы в курсе 10 класса
Силы в механике. Для изучения темы в курсе 10 класса