Слайд 19

Эмпирические правила для интерпретации спектров флуоресценции белков
1. Вся флуоресценция белка обусловлена наличием остатков триптофана, тирозина и фенилаланина.
2. При уменьшении
полярности растворителя lмах в спектре флуоресценции триптофана смещается в область более коротких волн, а интенсивность при lмах возрастает.
3. Если вещество, известное как тушитель, например, иодид, нитрат, или ионы цезия, тушат флуоресценцию триптофана или тирозина, то эти аминокислоты должны быть на поверхности белка. Если тушения не происходит, то это возможно по нескольким причинам:
а) Аминокислота находится внутри молекулы.
б) Аминокислота находится в полости, размеры которой слишком малы, чтобы туда вошел тушитель.
в) Аминокислота в сильно заряженном участке, и заряд может отталкивать тушитель (если тушитель заряжен противоположно).
4. Если вещество, которое не влияет на квантовый выход свободной аминокислоты, действует на флуоресценцию белка, то это происходит за счет конформационных перестроек белка.
5. Если триптофан или тирозин находится в попеременном окружении, характерные для них величины Q понижаются при возрастании температуры, тогда как в неполярном окружении изменения величин Q незначительны.
6. Q триптофана и тирозина понижается, если a-карбоксильная группа этих аминокислот протонирована.
7. Флуоресценция триптофана тушится соседними протонодонорными группами. Следовательно, если рК, измеренная путем контроля флуоресценции триптофана, такой же, как рК известной, способной к ионизации группы ( например, имидазола гистидина), то эта группа должна находится очень близко от триптофана.
8. Если при связывании какой-либо молекулы с белком тушится флуоресценция триптофана, то это происходит либо в результате конформационной перестройки белка, либо часть триптофановых участков находится в месте связывания или близко от него.
Конечно все эти правила не дают абсолютной уверенности в правильности интерпретации, поскольку флуоресценция очень чувствительна к факторам окружения, тем не менее они очень полезны для предварительного получения информации, что должно быть дополнено получением данных другими независимыми методами.












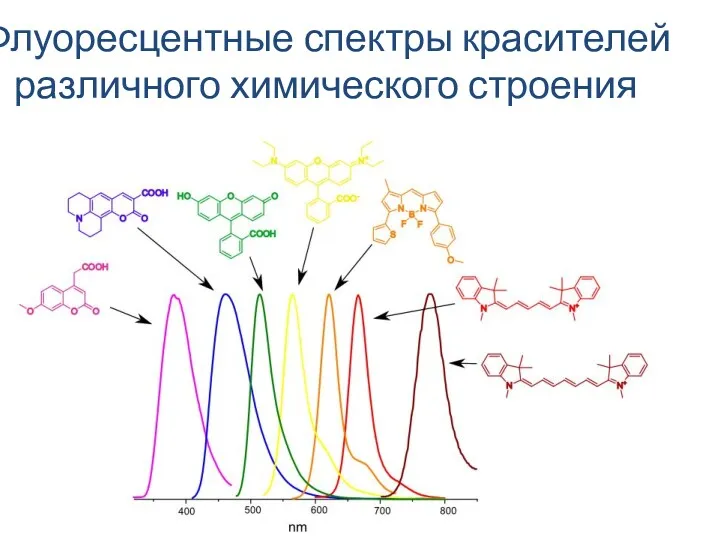
 Буксовые узлы электровозов ВЛ80, ВЛ85, 2ЭС5К
Буксовые узлы электровозов ВЛ80, ВЛ85, 2ЭС5К Строение атома, энергия связи атомных ядер, радиоактивность. Применение радиоактивных изотопов
Строение атома, энергия связи атомных ядер, радиоактивность. Применение радиоактивных изотопов Организация ТО и ремонта автомобиля Ваз-2170
Организация ТО и ремонта автомобиля Ваз-2170 Петров презентация
Петров презентация Уравнения Максвелла для электромагнитного поля
Уравнения Максвелла для электромагнитного поля Общие направления технического обслуживания и ремонта автомобилей
Общие направления технического обслуживания и ремонта автомобилей Методы измерения по фазе
Методы измерения по фазе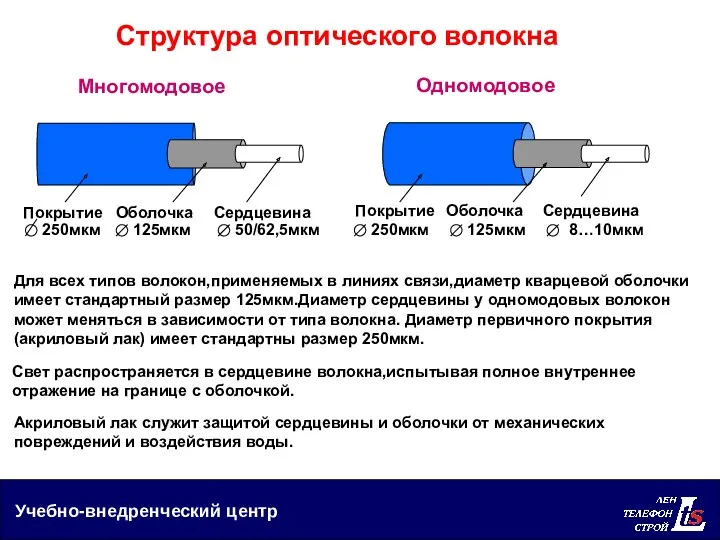 Структура оптического волокна
Структура оптического волокна Автомобиль и люди
Автомобиль и люди Точечные дефекты и их влияние на свойства кристаллов. Равновесные и неравновесные дефекты. Примеси в полупроводниках
Точечные дефекты и их влияние на свойства кристаллов. Равновесные и неравновесные дефекты. Примеси в полупроводниках Автоматические трансмиссии
Автоматические трансмиссии Оптичні явища в природі
Оптичні явища в природі Constant Jerk Trajectory Generator
Constant Jerk Trajectory Generator Презентация к уроку физики в 7 классе по теме Сообщающиеся сосуды
Презентация к уроку физики в 7 классе по теме Сообщающиеся сосуды Пространственная система сил. (Тема 1.5)
Пространственная система сил. (Тема 1.5) Расчёт отдельных участков контура циркуляции воды
Расчёт отдельных участков контура циркуляции воды Электрические цепи постоянного тока
Электрические цепи постоянного тока Полупроводниковые кристаллы
Полупроводниковые кристаллы Определение давления тела на опору
Определение давления тела на опору Курс лекций по теоретической механике
Курс лекций по теоретической механике Давление твердых тел, жидкостей и газов
Давление твердых тел, жидкостей и газов Аппараты до 1000В. Рубильники. (Лекция 10)
Аппараты до 1000В. Рубильники. (Лекция 10) Как человек научился считать время (окружающий мир, 4 класс)
Как человек научился считать время (окружающий мир, 4 класс) Трение
Трение Агрегатные состояния вещества: твердые тела, жидкости, газы
Агрегатные состояния вещества: твердые тела, жидкости, газы Виды парообразования, Насыщенный пар
Виды парообразования, Насыщенный пар Обобщение и уточнение Ньютоном законов Кеплера
Обобщение и уточнение Ньютоном законов Кеплера интегрированный урок физика+математика
интегрированный урок физика+математика