Содержание
- 2. Вопросы для повторения: В чём сущность явления радиоактивности? Кем оно было открыто и исследовано? Опишите опыт
- 3. Радиоактивность Радиоактивность – способность атомов некоторых химических элементов к самопроизвольному излучению.
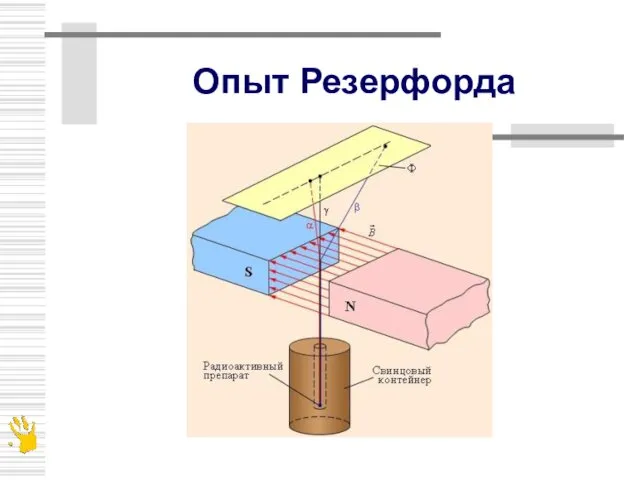
- 4. Опыт Резерфорда
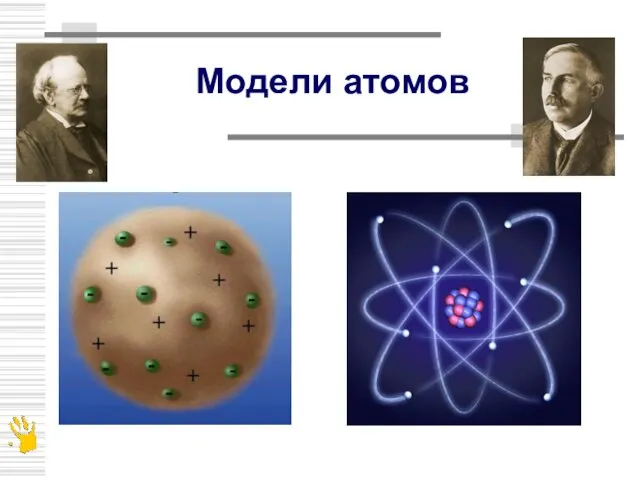
- 5. Модели атомов
- 6. Опыт Резерфорда по рассеянию альфа-частиц
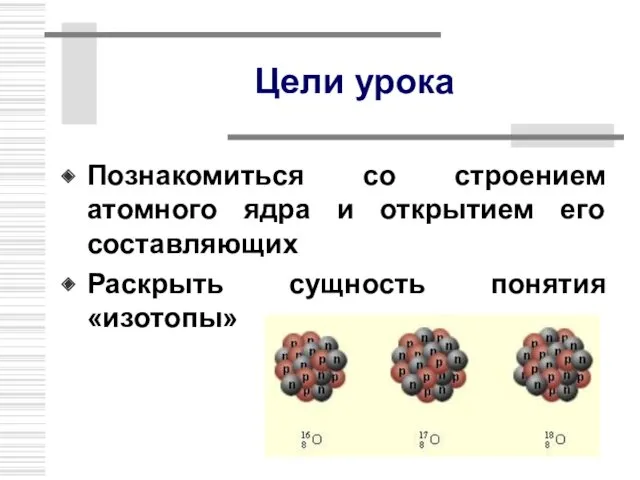
- 7. Цели урока Познакомиться со строением атомного ядра и открытием его составляющих Раскрыть сущность понятия «изотопы»
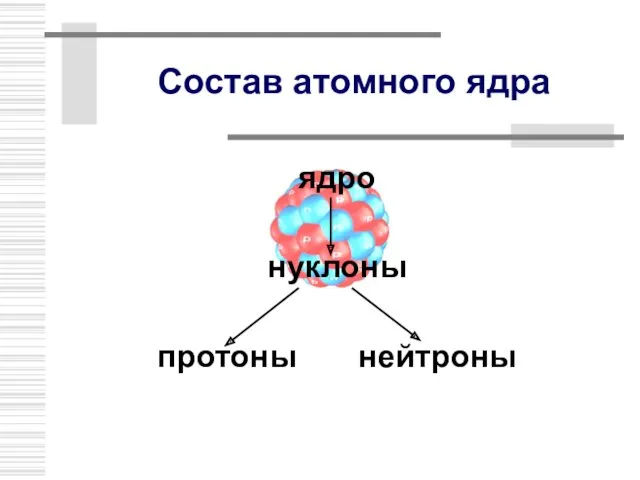
- 8. Состав атомного ядра ядро нуклоны протоны нейтроны
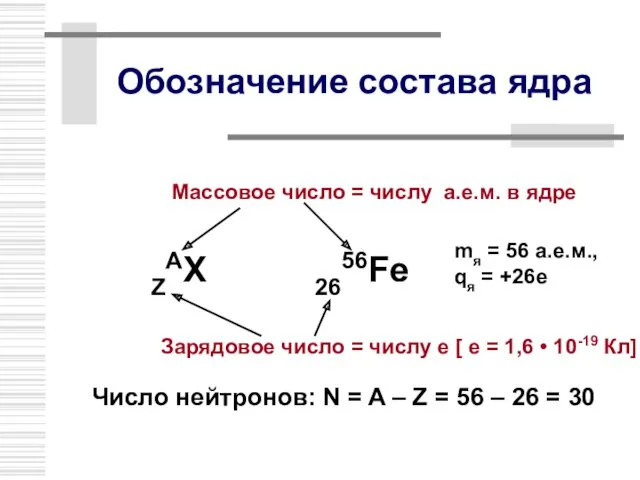
- 9. Обозначение состава ядра ZAX 2656Fe Зарядовое число = числу е [ е = 1,6 • 10-19
- 10. Радиоактивные превращения атомных ядер 88226Rd ? 86222Rn + 24He В 1903 г. Э.Резерфорд и Ф.Содди обнаружили
- 11. Открытие протона В 1919 г. Резерфорд поставил опыт по исследованию взаимодействия альфа-частиц с ядрами атомов азота,
- 12. Открытие протона 714N + 24He ? 817O + 11H Протоны входят в состав ядер атомов всех
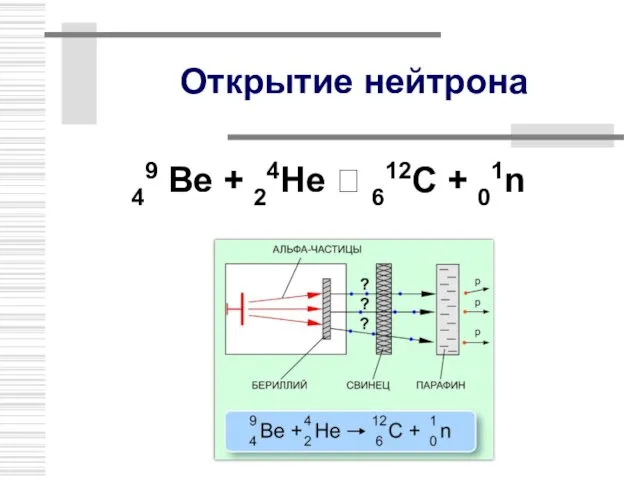
- 13. Открытие нейтрона В 1932 г. Дж. Чедвик , исследуя бериллиевое излучение,открыл нейтрон n0 или 01n mn
- 14. Открытие нейтрона 49 Ве + 24Не ? 612C + 01n
- 15. Протонно-нейтронная модель ядра В 1932 г. Д.Д.Иваненко и В.Г.Гейзенберг выдвинули гипотезу о протонно-нейтронном строении ядра: атомные
- 16. Протонно-нейтронная модель ядра Общее число нуклонов в ядре называется массовым и обозначается буквой А. Число протонов
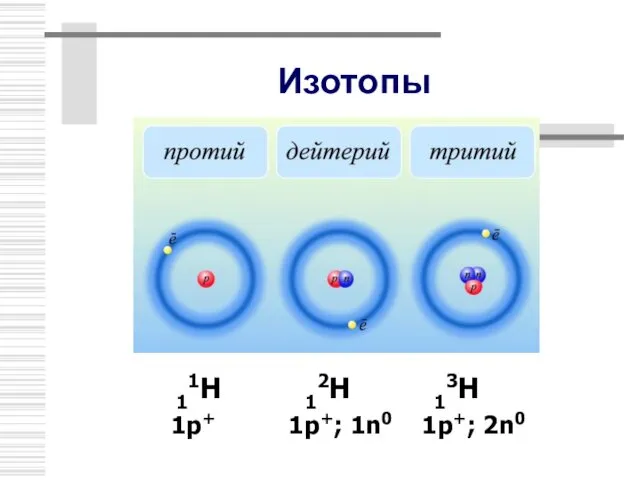
- 17. Изотопы В 1911 г. Ф.Содди предположил, что ядра с одинаковым числом протонов, но разным числом нейтронов
- 18. Изотопы 11Н 12Н 13Н 1р+ 1р+; 1n0 1p+; 2n0
- 19. Относительная атомная масса химического элемента 100 атомов Cl 75 атомов 25 атомов 1735Cl 1737Cl Ar=mср= 35
- 20. Закрепление изученного Сборник задач Лукашик № 1656 №1658 №1661 упр. 51 № 3-5, с. 234-235
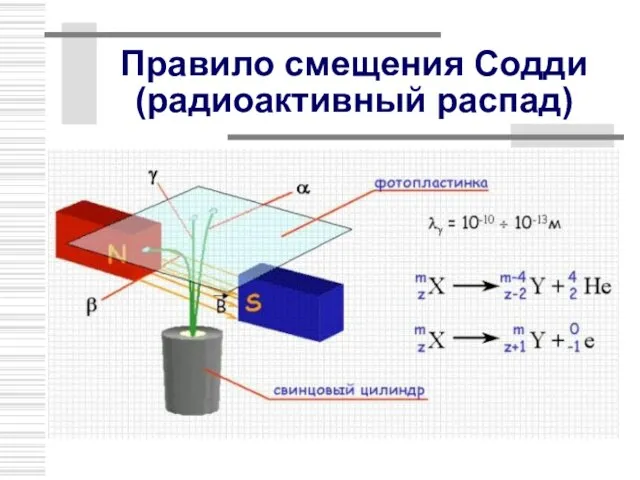
- 21. Правило смещения Содди (радиоактивный распад)
- 22. Правило смещения (α- распад)
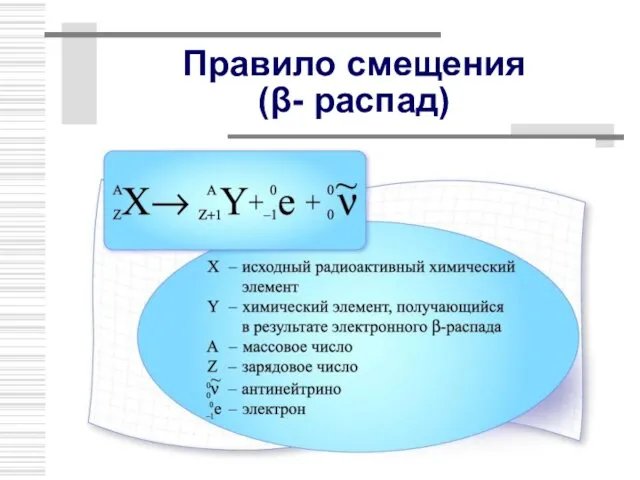
- 23. Правило смещения (β- распад)
- 25. Скачать презентацию













 Система KE - Motronic
Система KE - Motronic Классификация строительных машин
Классификация строительных машин Роль фізики в нашому житті
Роль фізики в нашому житті Законы Ньютона
Законы Ньютона Передача давления жидкостями и газами. Закон Паскаля. Проверка знаний
Передача давления жидкостями и газами. Закон Паскаля. Проверка знаний Компенсация реактивной мощности. Потребители реактивной мощности. Лекция 01
Компенсация реактивной мощности. Потребители реактивной мощности. Лекция 01 Модель малого космического аппарата, движимого солнечным парусом
Модель малого космического аппарата, движимого солнечным парусом презентация к внеклассному мероприятию Что? Где? Когда?
презентация к внеклассному мероприятию Что? Где? Когда? Газовые лазеры
Газовые лазеры Визуальная, квантовая физика
Визуальная, квантовая физика физика 3Эт
физика 3Эт Симметричный вибратор. Антенно-фидерные устройства и распространение радиоволн
Симметричный вибратор. Антенно-фидерные устройства и распространение радиоволн Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Презентация по теме Внутренняя энергия и способы ее изменения8кл
Презентация по теме Внутренняя энергия и способы ее изменения8кл Призмы калейдоскопа
Призмы калейдоскопа Системы автоматизации производства и ремонта вагонов
Системы автоматизации производства и ремонта вагонов Классификация методов расчета полей нейтронов и гамма-квантов. Обзор методов расчета полей нейтронов и гамма-квантов
Классификация методов расчета полей нейтронов и гамма-квантов. Обзор методов расчета полей нейтронов и гамма-квантов Радиация. Биологическое действие радиации
Радиация. Биологическое действие радиации Професія зварювальник
Професія зварювальник Основы технологии двигателя
Основы технологии двигателя Эволюция вселенной
Эволюция вселенной Сверхпроводимость
Сверхпроводимость Презентация к уроку Изменение агрегатных состояний вещества
Презентация к уроку Изменение агрегатных состояний вещества Тепломассообмен. Конвекция
Тепломассообмен. Конвекция Виды излучений. Инфракрасное излучение
Виды излучений. Инфракрасное излучение Проблема освоения космоса
Проблема освоения космоса Исследование сканирующим зондовым микроскопом рельефа отложений, остающихся после испарения воды
Исследование сканирующим зондовым микроскопом рельефа отложений, остающихся после испарения воды Неинерциальные системы отсчета. Силы инерции. Лекция 4
Неинерциальные системы отсчета. Силы инерции. Лекция 4