Процес називається оборотним, якщо він допускає можливість повернення системи до початкового
стану без будь-яких змін у навколишньому середовищі
Необоротні процеси:
розширення газу у вакуум
перехід при дії сили тертя мех. енергії у внутрішню
дифузія
теплообмін
В кожному напрямку система проходить через одні і ті ж проміжні стани в двох зворотних напрямках
Система повертається в початковий стан
Якщо не виконується один з пунктів - процес необоротний
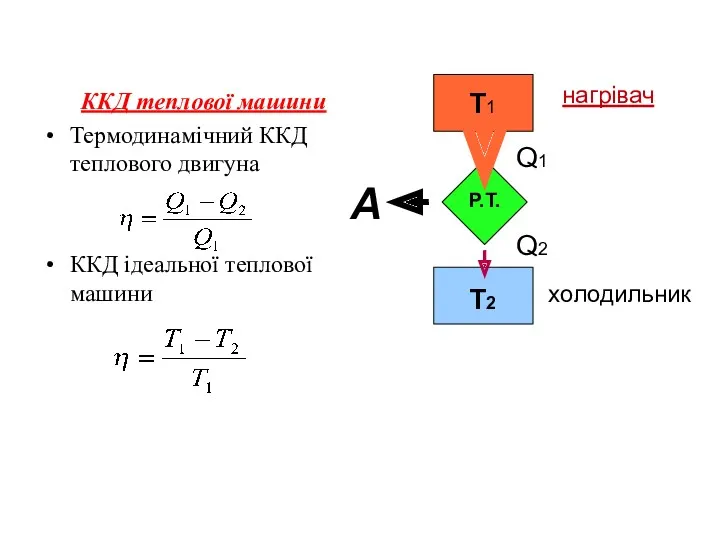
У термодинаміці важливе значення мають такі процеси, коли термодинамічна система після проходження ряду станів повертається до початкового стану (P1,V1,T1)⇔(P2,V2,T2). Такі процеси називаються коловими процесами або циклами.
Колові процеси, при яких виконується корисна робота теплового двигуна, називають прямими, а ті, при яких відбувається охолодження робочих тіл до температур, нижчих за температуру навколишнього середовища, - зворотними. За зворотним циклом працює холодильна машина.















 Основные законы электродинамики. Лекция 1
Основные законы электродинамики. Лекция 1 Обслуживание и ремонт системы питания дизельных автомобилей
Обслуживание и ремонт системы питания дизельных автомобилей Закон Ома. Сопротивление. Что такое электрический ток?
Закон Ома. Сопротивление. Что такое электрический ток? Модели атомов. Опыт Резерфорда
Модели атомов. Опыт Резерфорда Телевидение. Телевизионный приём
Телевидение. Телевизионный приём Вентиляційна акустика та її основні положення. Основні фізичні величини, що характеризують звукове поле. Лекція 4
Вентиляційна акустика та її основні положення. Основні фізичні величини, що характеризують звукове поле. Лекція 4 Индикаторы. Промышленные регуляторы
Индикаторы. Промышленные регуляторы Bajaj intracity. Время для новых возможностей
Bajaj intracity. Время для новых возможностей Тепломассообмен. Основы теории массообмена. (Лекция 16)
Тепломассообмен. Основы теории массообмена. (Лекция 16) Задачі. Правила рук
Задачі. Правила рук Солнечные источники энергии. Солнечные батареи
Солнечные источники энергии. Солнечные батареи Техническое обслуживание системы управления
Техническое обслуживание системы управления Атом Резерфорда - Бора
Атом Резерфорда - Бора Kernfusion in der sonne
Kernfusion in der sonne Выбор режимов при ручной дуговой сварке
Выбор режимов при ручной дуговой сварке Микроструктурные эффекты в порошковой дифракции и методы их описания
Микроструктурные эффекты в порошковой дифракции и методы их описания Жылу алмасу үдерістері
Жылу алмасу үдерістері Сила тяжести. Движение в поле силы тяжести
Сила тяжести. Движение в поле силы тяжести Организация технического обслуживания и ремонта автомобиля Шевроле Нива
Организация технического обслуживания и ремонта автомобиля Шевроле Нива Физика – наука о наиболее общих формах движения материи и их взаимных превращениях. Лекция №1
Физика – наука о наиболее общих формах движения материи и их взаимных превращениях. Лекция №1 Физика. Сила. Законы Ньютона
Физика. Сила. Законы Ньютона Основные неисправности и нормы ТОиР. Лекция 6
Основные неисправности и нормы ТОиР. Лекция 6 Радиолокация
Радиолокация Презетнация для урока по физике 11 класс Соединение проводников
Презетнация для урока по физике 11 класс Соединение проводников Батарейка. Гальванический элемент.
Батарейка. Гальванический элемент. Динамика негіздері
Динамика негіздері Тема: Фотоэффект. Теория фотоэффекта
Тема: Фотоэффект. Теория фотоэффекта Техническое обслуживание и ремонт автомобилей
Техническое обслуживание и ремонт автомобилей