Содержание
- 2. Актуализация опорных знаний Что является объектом изучения МКТ? Идеальный газ. Что в МКТ называется идеальным газом?
- 3. НОВЫЕ ЗНАНИЯ Что называется изопроцессами? Изопроцессы – процессы, протекающие при неизменном значении одного из параметров. «Изо»
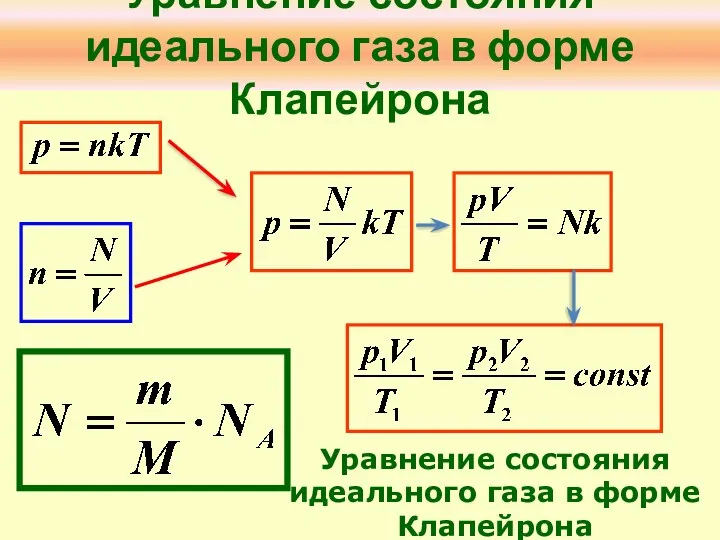
- 5. Уравнение состояния идеального газа в форме Клапейрона Уравнение состояния идеального газа в форме Клапейрона
- 6. Обобщив уравнение Клапейрона, в 1874 вывел общее уравнение состояния идеального газа Менделеев Дмитрий Иванович (8.II.1834–2.II.1907)
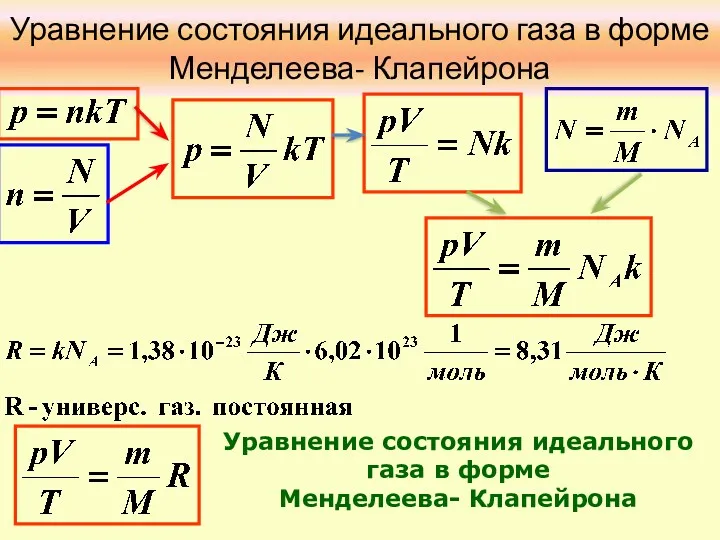
- 7. Уравнение состояния идеального газа в форме Менделеева- Клапейрона Уравнение состояния идеального газа в форме Менделеева- Клапейрона
- 8. Практическое применение уравнения состояния: 1. В термометрах… Уравнение позволяет определить одну из величин, характеризующих состояние, если
- 9. 2. В газовых законах… Зная уравнение состояния, можно сказать, как протекают в системе процессы при определённых
- 10. 3. В молекулярной физике… Зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает
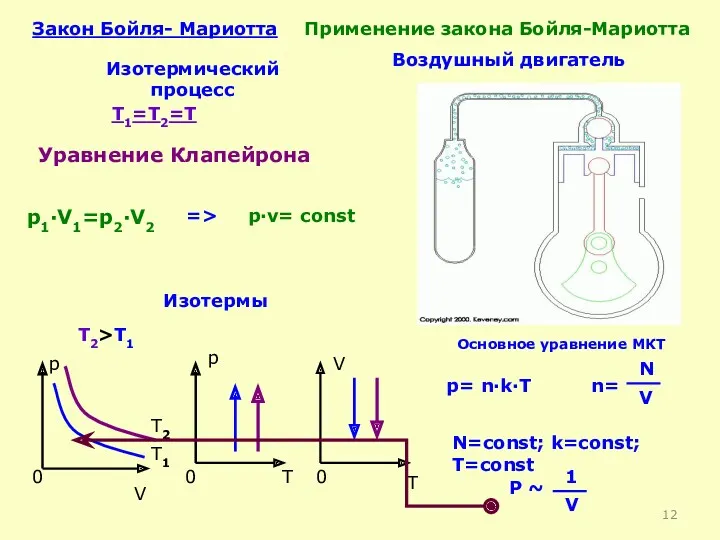
- 11. Df. Изотермический процесс-процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре Т= const Закон Бойля-Мариотта:
- 12. Закон Бойля- Мариотта Изотермический процесс T1=T2=T p·v= const p1·V1=p2·V2 p V 0 p 0 T V
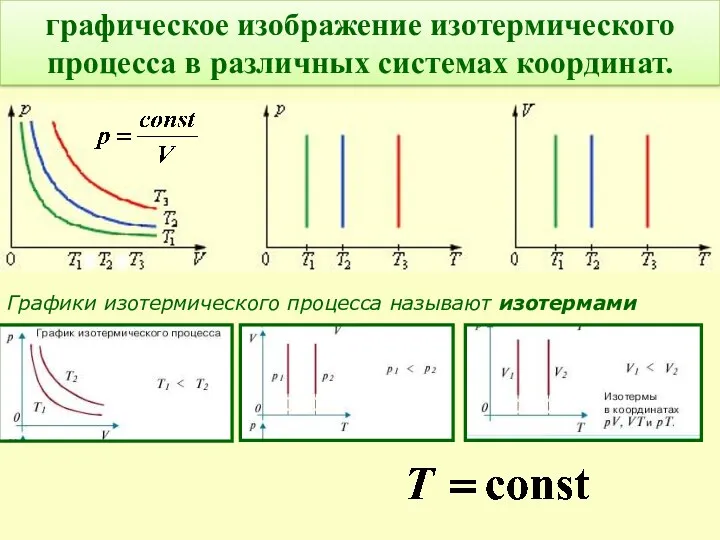
- 13. графическое изображение изотермического процесса в различных системах координат. Графики изотермического процесса называют изотермами
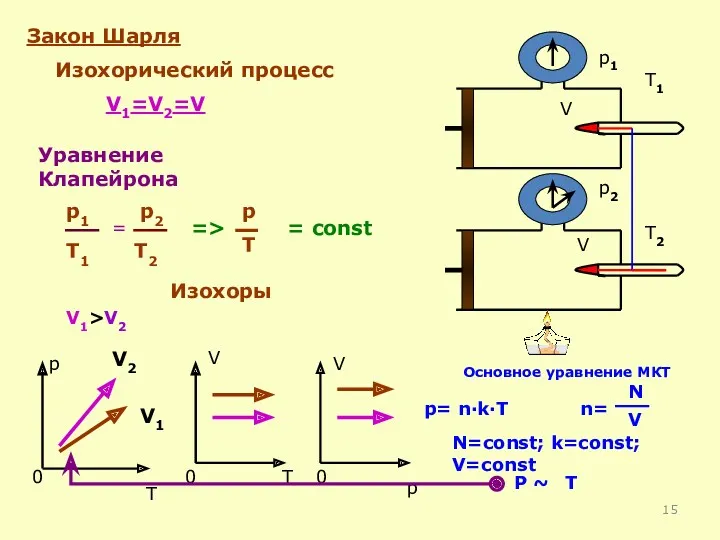
- 14. Df. Изохорный процесс-процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме V= const Закон Шарля:
- 15. Закон Шарля Изохорический процесс V1=V2=V = const p T 0 V 0 T V 0 p
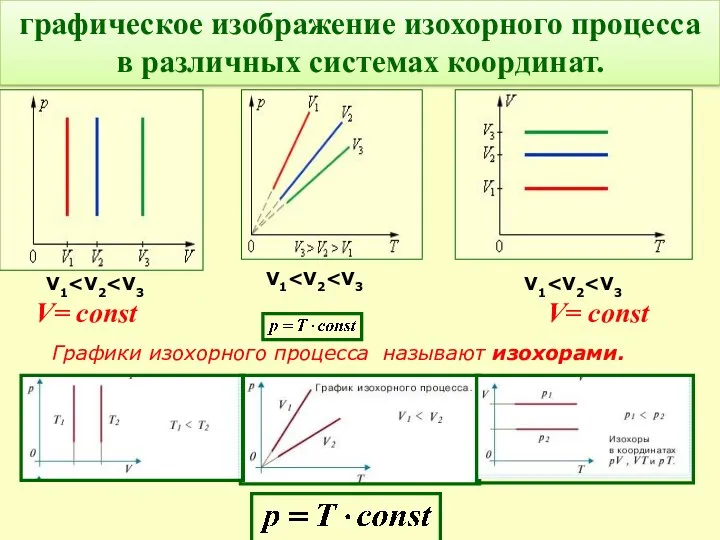
- 16. Графики изохорного процесса называют изохорами. графическое изображение изохорного процесса в различных системах координат. V= const V=
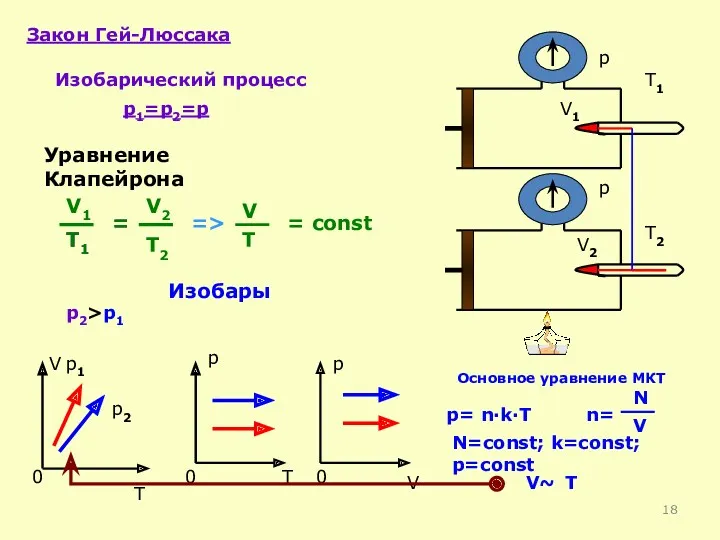
- 17. Df. Изобарный процесс-процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении р= const Закон Гей-Люссака:
- 18. Закон Гей-Люссака Изобарический процесс p1=p2=p = const V T 0 p 0 T p 0 V
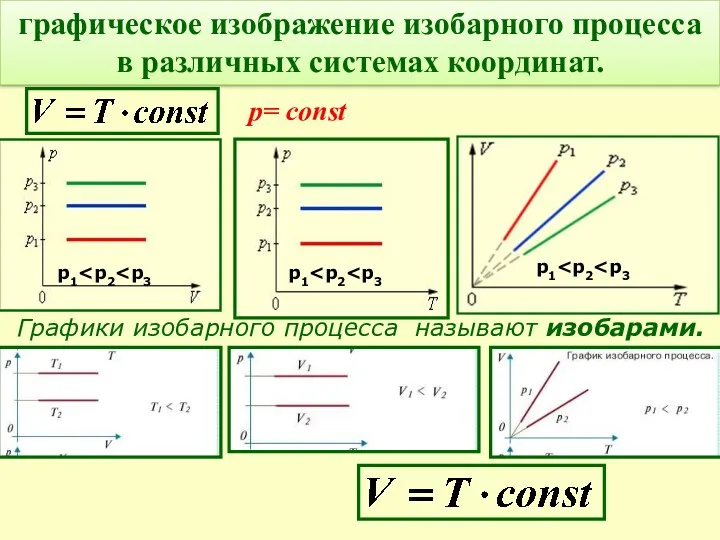
- 19. Графики изобарного процесса называют изобарами. графическое изображение изобарного процесса в различных системах координат. р= const р1
- 20. Изопроцессы в газах Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. ИЗОПРОЦЕССЫ:
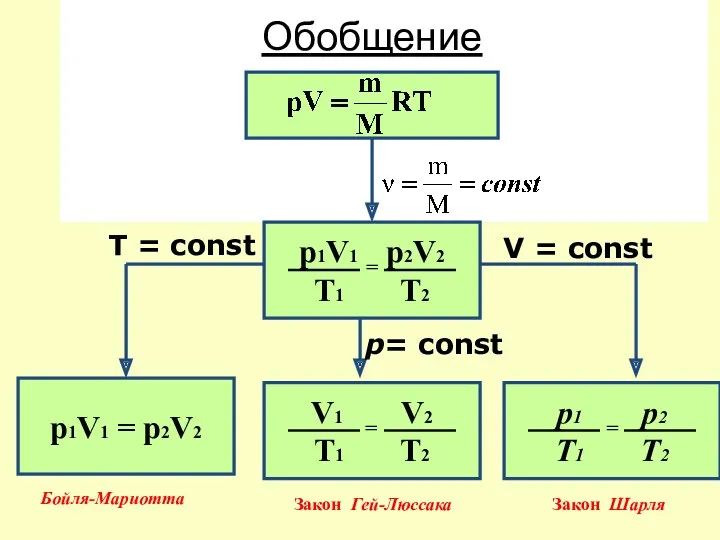
- 21. Обобщение р1V1 = р2V2 V = const T = const р= const Бойля-Мариотта Закон Гей-Люссака Закон
- 22. Выполнение лабораторной работы. Практическая часть Инструктаж по ТБ. Выполнение практической части работы по инструкции Аналитическая часть
- 23. Опытная проверка закона Гей – Люссака
- 24. 1. Последовательность действий 2. Измерить ℓ в мм, t в ºС 3. С индексом (1) –
- 25. 1. Последовательность действий 2. Измерить ℓ в мм, t в ºС 3. С индексом (1) –
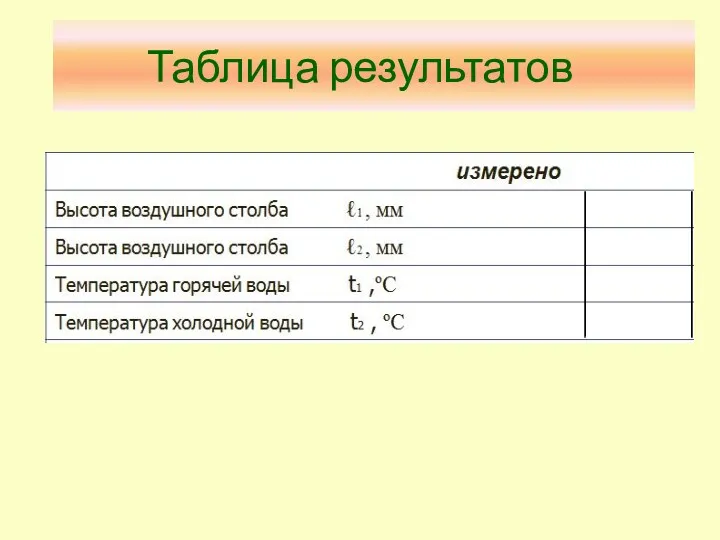
- 26. Таблица результатов
- 27. Таблица результатов (продолжение)
- 28. Таблица результатов (продолжение)
- 29. Вычисления: Т = t + 273 T1 = 64+273=327K T2 = 20+273 = 293K Погрешности измерений:
- 30. Абсолютные погрешности: Вывод: закон Гей- Люссака выполняется, так как отношение объемов равно отношению температур с учетом
- 32. Скачать презентацию



















 Диапазоны частот. Радиоволны
Диапазоны частот. Радиоволны Электрический ток в металлах
Электрический ток в металлах Газовые законы. 10 класс
Газовые законы. 10 класс Методика проведения урока-исследования по теме Термодинамика
Методика проведения урока-исследования по теме Термодинамика Физика для любознательных
Физика для любознательных Время
Время Биомеханика двигательных действий: составные движения в биокинематических цепях
Биомеханика двигательных действий: составные движения в биокинематических цепях Атомная энергетика. Электроэнергия
Атомная энергетика. Электроэнергия Микроскоп – знакомство, создание, опыты
Микроскоп – знакомство, создание, опыты Семифизик. Обобщающий урок по курсу физики 7 класса
Семифизик. Обобщающий урок по курсу физики 7 класса Постоянный электрический ток
Постоянный электрический ток Растяжение и сжатие
Растяжение и сжатие Технический проект моторного участка зоны ТР, при эксплуатации автомобилей ГАЗ 2705 в г. Нижний Тагил
Технический проект моторного участка зоны ТР, при эксплуатации автомобилей ГАЗ 2705 в г. Нижний Тагил Микропрезентация как способ оформления домашнего экспериментального задания
Микропрезентация как способ оформления домашнего экспериментального задания Фотоэффект_ Давление света_ Химическое действие света_ Фотография_ Выполнил_
Фотоэффект_ Давление света_ Химическое действие света_ Фотография_ Выполнил_ Mechanical vibrations
Mechanical vibrations Исследовательская работа в области естествознания. Анемометр в измерении силы ветра. Автор: Григорьев Никита, 11 лет, 6 Б класс
Исследовательская работа в области естествознания. Анемометр в измерении силы ветра. Автор: Григорьев Никита, 11 лет, 6 Б класс Конференция Физика в моей будущей профессии
Конференция Физика в моей будущей профессии Устойчивость к скачкам потока. Лекция 8
Устойчивость к скачкам потока. Лекция 8 Лекция №13 рабочие циклы ДВС
Лекция №13 рабочие циклы ДВС Смазочные масла. Тема 1.5
Смазочные масла. Тема 1.5 Внутренняя энергия. Работа. Количество теплоты
Внутренняя энергия. Работа. Количество теплоты Физика плазмы
Физика плазмы Технология разборочных и моечно-очистных работ
Технология разборочных и моечно-очистных работ Презентация к уроку Энергия топлива
Презентация к уроку Энергия топлива Первый закон Ньютона
Первый закон Ньютона Звуковые волны
Звуковые волны Буксовые узлы. Устройство. Наблюдение и уход за буксами в эксплуатации. Основные детали и их неисправности
Буксовые узлы. Устройство. Наблюдение и уход за буксами в эксплуатации. Основные детали и их неисправности